改良PCR-RFLP法检测MTHFR基因C677T位点多态性
2019-11-11何震宇顾取良游娟
何震宇,顾取良,游娟
(广东药科大学生物化学与分子生物学系,广东 广州 510006)
5,10-亚甲基四氢叶酸还原酶(MTHFR)是叶酸代谢途径的关键酶,其编码基因定位于1p36.3[1],全长2.2 kb,包含11个外显子[2]。MTHFR基因错义突变是引起酶活性缺乏和降低的主要机制,最常见的一个突变是DNA分子第677位碱基发生C→T 的突变(C677T),它会导致编码肽链第222位的丙氨酸被缬氨酸取代,从而降低MTHFR的热稳定性和活性,杂合子(TC)个体的MTHFR活性降低35%,突变纯合子(TT)个体的MTHFR活性降低70%[3]。MTHFR活性下降可引起血浆同型半胱氨酸(homocysteine,Hcy)水平上升、一碳单位代谢障碍,与唐氏综合征[4]、神经管缺陷[5]、唇腭裂[6]、心脑血管疾病[7]、自闭症[8]、反复自然性流产[9]、肿瘤[10]等多种疾病的发生相关。加强MTHFRC667T基因分型研究,对临床疾病诊断、风险性预测及指导医生用药等有重要意义。
1 材料与方法
1.1 主要试剂
口腔拭子基因组提取试剂盒(天根生化科技有限公司);2×HS PCR Mix(广州东盛生物科技有限公司);上游引物FP:5′-CTGGGGTCAGAAGCATATCAGTCATG-3′及下游引物RP:5′-AAGCAACGCTGTGCAAGTTCTGG-3′(自行设计,北京六合华大基因科技股份有限公司合成);HinfI(Thermo Fisher Scientific Inc);DNA分子量标准low ladder(广州东盛生物科技有限公司)。
1.2 主要仪器
5804R型低温高速离心机(德国Eppendorf 公司);DDY- 6c型电泳仪(北京市六一仪器厂);凝胶成像分析仪(英国 Syngene 公司);2720型PCR仪(美国ABI公司)。
1.3 研究对象
正常口腔拭子标本100例,采自广东药科大学在读本科生,其中男57例,女43例,平均年龄20.28岁,事先均签署了知情同意书。
1.4 DNA制备
准备消毒的医用棉签,志愿者先用清水漱口,然后手持棉签伸进口腔,在口腔内侧(腮帮子)上反复擦拭10次左右,取出棉签,-20 ℃保存。按试剂盒说明书提取基因组DNA。
1.5 引物设计
根据NCBI中MTHFR基因全序列(登录号:NG_013351.1)及dbSNP数据库的序列信息(编号:rs1801133),采用primer premier 5.0软件辅以人工修改设计引物,使用在线Primer-BLAST程序验证引物的特异性。最终选定的引物与模板的对应关系见图1。

图1PCR的模板序列及引物结合位置
Figure1Template sequence and primer binding location of PCR
上述序列中2个末端的大写碱基为引物的对应位置,以突变型等位基因为模板的PCR产物在多态位点附近含有GAGTC序列,它能被HinfI(G^ANTC)识别切割;相反,以野生型等位基因为模板的PCR产物在多态位点附近的相应序列为GAGCC序列,它不能被HinfI识别切割。此外,野生型等位基因、突变型等位基因的PCR产物在多态位点上游均包含1个GACTC序列【104~108位】,其为HinfI识别位点。
1.6 PCR扩增及产物的电泳鉴定
PCR总体积25 μL,其中2×HS PCR Mix 12.5 μL、上下游引物各10 pmol、基因组DNA 1 μL。PCR反应条件:94 ℃预变性3 min,然后94 ℃ 30 s、55 ℃ 30 s、72 ℃ 35 s,共计30个循环,再于72 ℃延伸7 min。PCR产物用2.0%的琼脂糖凝胶电泳进行检测,得到预期大小的片断后,再进行下一步的酶切反应。
1.7 PCR产物的酶切分型
酶切反应体系30 μL,其中PCR产物10 μL、FastDigest Green Buffer 2 μL、FastDigestHinfI 1 μL、灭菌三蒸水17 μL,37 ℃水浴消化10 min。酶切产物经3.0%的琼脂糖凝胶电泳进行检测,根椐限制性酶切图谱确定每份样品C677T位点的基因型。
1.8 测序验证
随机选取上述PCR-RFLP法检出的3种基因型样品各1例,PCR扩增535 bp的靶序列测序,测序引物采用PCR上游引物FP。
1.9 统计学处理
基因型和等位基因频率采用直接计数法,Hardy-Weinberg遗传平衡定律的吻合度检验采用χ2检验。
2 结果
2.1 改良PCR-RFLP法对MTHFR基因 C677T 位点的鉴定
PCR产物理论大小为535 bp(见图2中的P),用HinfI进行酶切,野生型等位基因677C可得到429.5、105.5 bp 2种片段,突变型等位基因677T可得到264.5、165、105.5 bp 3种片段。故野生型纯合子CC的条带应为429.5、105.5 bp;突变型纯合子TT的条带应为264.5、165、105.5 bp;杂合子CT的条带应为429.5、264.5、165、105.5 bp,事实上,仅通过429.5、264.5 bp 2种特征片段就可从电泳图谱上清晰地分辨出CC、CT、TT 3种基因型(图2)。测序结果(图3)表明,本研究建立的改良PCR-RFLP法对3种基因型样品的分型结果完全正确。
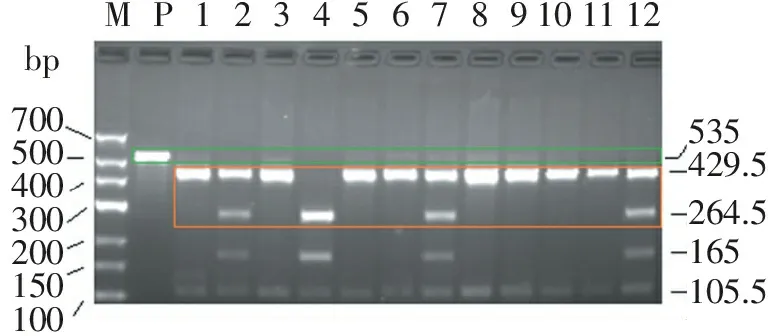
MP123456789101112bp700500400300200150100535429.5264.5165105.5
M. DNA分子量标准; P. PCR产物;1、3、5、6、8、9、10、11.野生型纯合子CC; 2、7、12. 杂合子CT; 4.突变型纯合子TT。
图2改良PCR-RFLP检测MTHFR基因C677T位点基因型之电泳图谱
Figure2Electrophoresis map for genotyping C677T locus ofMTHFRgene by improved PCR-RFLP
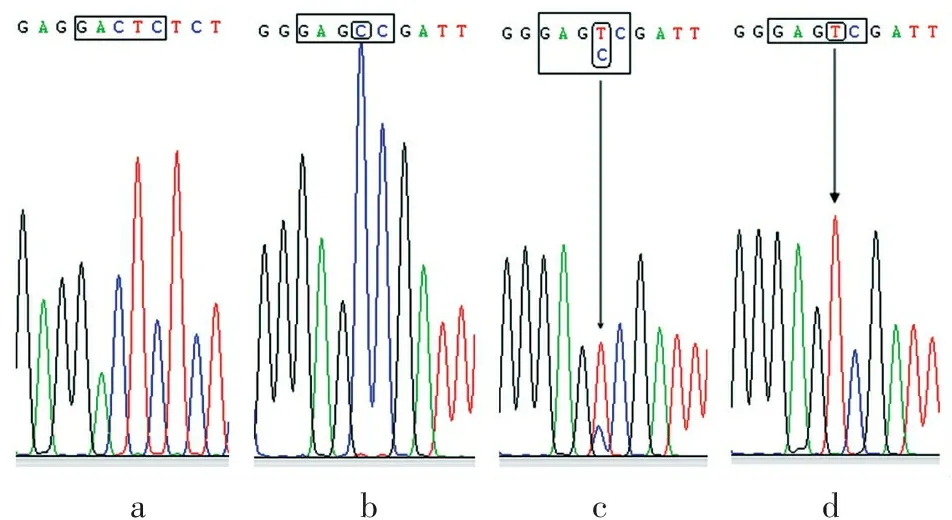
abcd
a.中框内序列为内对照酶切位点; b、c、d.中圆角矩形圈住的碱基为多态位点碱基, 相应的基因型分别为野生型纯合子CC,杂合子CT,突变型纯合子TT。
图3MTHFR基因C677T位点3种基因型样品测序峰图
Figure3Sequencing map of three genotypes of C677T locus ofMTHFRgene
2.2 Hardy-Weinberg 遗传平衡检验
本研究检测到CC、CT、TT 3种基因型的例数分别为:59、35、6,相应的基因型频率分别为0.59、0.35、0.06。等位基因C的频率为0.765,等位基因T的频率为0.235。经Hardy-Weinberg 遗传平衡检验,χ2=0.0723(P=0.965>0.05),说明样本具有群体代表性。
3 讨论
由于MTHFR基因多态性与临床上多种疾病的发生、发展密切相关,故临床开展MTHFR基因多态性检测意义重大、前景广阔。目前,国内外用于MTHFR基因C677T位点(rs1801133)的分型方法有直接测序(Sanger 双脱氧链终止法)[11]、焦磷酸测序[12]、微测序[13]、基于引物延伸反应的基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)基因分型技术[14]和荧光偏振光基因分型技术[15]、基因芯片[16]、Taqman探针法[17]、高分辨率熔解曲线(HRM)法[18-19]及PCR-RFLP[20-25]等,各有其优点及局限性。
PCR-RFLP是一种经典的基因分型方法,相较于大多数方法而言,不需要贵重仪器,技术简单,容易实现,因而在MTHFR基因C677T位点的检测中应用广泛。不过,通过分析(表1),不难发现,既有方法在PCR产物酶切不完全时,残留的PCR产物容易导致TT型(突变型纯合子)样品被误判为CT型(杂合子)(图4)。在薛丽等[15]的实验中就出现过这种情形:他们用PCR-RFLP检测了100例标本,发现了48例CT杂合子,用TDI-FP、Pyrosequencing测序2种方法均证实其中有2例所谓的“CT杂合子”属于误判,实质上为TT纯合子。
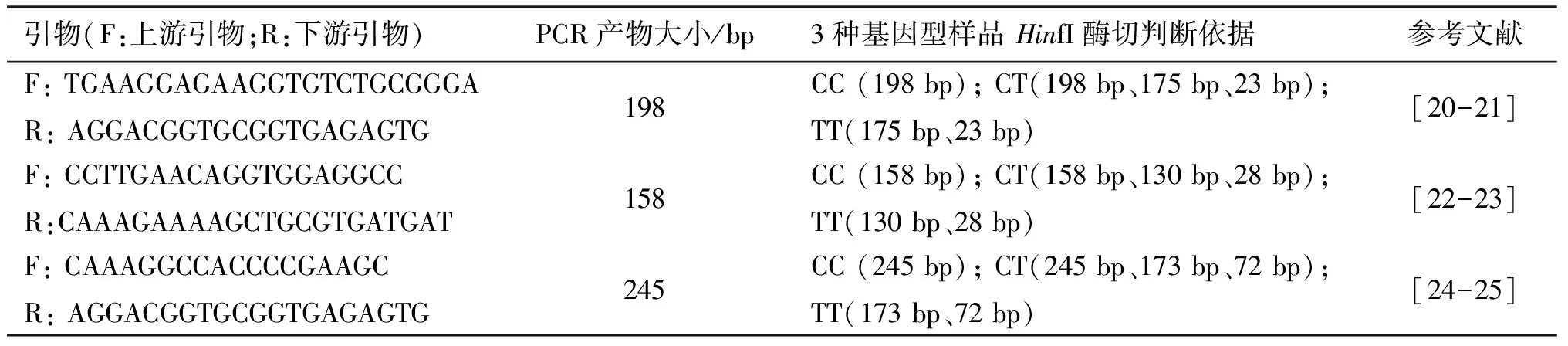
表1 采用PCR-RFLP法鉴定MTHFR基因C677T位点的引物及基因型判断依据Table 1 Primers and genotype judgment basis for identification of MTHFR gene C677T locus by PCR-RFLP

完全酶切图 不完全酶切图
图4既有PCR-RFLP法检测MTHFR基因C677T位点之完全酶切及不完全酶切示意图
Figure4Complete and incomplete digestion maps ofMTHFRgene C677T locus detected by existing PCR-RFLP method
本研究对既有PCR-RFLP分型法进行了改良,通过巧妙的引物设计使得所有样品的PCR产物在多态位点之外均包含一个HinfI识别位点作为酶切效果的内对照,一旦在该位点发生切割,得到的所有真正反映样品基因型的酶切片段的大小必然小于PCR产物的大小(即局部小于整体),不会由于PCR产物的残留干扰基因型判断。如图2所示,仅凭橙色框中的429.5、264.5 bp片段的组合情况就可清晰区分3种基因型样品,它们的大小均小于PCR产物(535 bp,绿色框框住的条带)。除了引入酶切内对照确保分型结果的准确性外,本法还具有如下优点:(1)只涉及离心、PCR、酶切、电泳等常规分子生物学技术,操作较为简便;(2)通过酶切产物的电泳图谱判断基因型,结果非常直观;(3)不需昂贵的仪器设备和试剂,可极大地降低实验成本;(4)酶切反应时间极短(FastDigest快速内切酶可在10 min内完成酶切反应),而常规酶切反应需要数小时乃至过夜[23-24],故可极大节省检测时间。总之,改良PCR-RFLP法准确、简便、快速、成本低廉,对实验平台要求不高,在临床检测上有较高的推广应用价值。此外,该法还可用于流行病学调查以促进相关疾病发病机制的深入研究。
