实验性脑缺血损伤大鼠Nrf2/ARE信号通路相关基因NQO1、GCLC和GCLM表达的变化
2019-11-09胡跃强王启芝李媛媛廖泰荣秦红玲
胡跃强,唐 农,王启芝,李媛媛,廖泰荣,秦红玲
氧化应激(oxidative stress,OS)是脑缺血缺氧后引起大脑神经损伤的关键因素之一[1,2]。抑制OS反应,是减轻脑缺血再灌注(ischemia/reperfusion,I/R)损伤的重要途径。还原型烟酰胺腺嘌呤二核苷酸磷酸醌氧化还原酶1(nicotinamide adenine dinucleotide phosphate quinine oxidoreductase,NQO1)是人体内重要的Ⅱ相代谢酶,谷氨酰半胱氨酸连接酶(Glutamatecysteine ligase,GCL)是还原型谷胱甘肽(Glutathione tablets,GSH)的合成限速酶,其催化亚基GCLC和调节亚基GCLM是非常重要的抗氧化蛋白酶,对抗氧化应激能力的提高有重要作用。NQO1、GCLC和GCLM三者均为核转录因子-E2 相关因子2(NF-E2-related factor 2,Nrf2) 细胞抗OS反应信号重要调控通路的下游因子[3~6],在脑I/R损伤中鲜有研究。本文我们探讨了大鼠脑缺血再灌注后缺血半暗带Nrf2/ARE信号通路相关蛋白NQO1、GCLC和GCLM的表达的动态变化,以阐明脑缺血后三者和脑缺血损伤的关系。
1 材 料
1.1 分组及处理 健康雄性SPF级SD大鼠80只,体重(250±50)g,湖南斯莱克景达实验动物有限公司提供,合格证号:SCXK(湘)2016-0002。随机将大鼠分为两组:假手术组(sham-operation,SO)、模型组(MCAO),每组40只。每组按照再灌注后12 h、1 d、2 d、3 d 4个时间点平均分为4个亚组(n=10)。分别作如下处理:假手术组(SO 组):以假手术代替缺血再灌注,线栓只插入颈内动脉9 mm,然后正常饲养,自由饮水;MCAO组:动物行MCAO 2 h,再灌注后12 h、1 d、2 d、3 d处死。
1.2 主要试剂 还原型谷胱甘肽(GSH)检测试剂盒 (上海酶联生物);活性氧(ROS)检测试剂盒(南京建成生物工程研究所);兔抗鼠NQO1多克隆抗体和兔抗鼠GCLC、GCLM单克隆抗体(Abcam公司);偶联有辣根过氧化物(HRP)羊抗兔 IgG二抗(武汉博士德生物工程有限公司);总RNA 提取试剂盒(TIANGEN公司);PCR反应试剂盒及逆转录试剂盒Trizol reagent(Takara公司);引物及内参均由桂林恒顺公司提供。
1.3 动物模型制备 采用大鼠大脑中动脉梗阻模型,参照Longa的线栓法进行,颈正中线切口3 cm~4 cm,钝性分离,暴露右侧胸锁乳突肌和胸骨舌骨肌之间的三角区域,沿胸锁乳突肌内侧分离肌肉筋膜,暴露颈总动脉,在颈总动脉的近心端和远心端分别穿线(4-0号,硅胶包被的圆头尼龙线栓),近心端系紧,距此节1 cm处的远心端系一松节备用,在颈总动脉近颈内动脉分叉处以微动脉夹暂时夹闭,在颈总动脉的两线间,距颈总动脉分叉处5 mm左右,剪一斜行45°小口,松开分叉处动脉夹进行插线,在栓线标记接近颈总动脉与颈内动脉分叉处或遇阻力感时停止。在大鼠造模麻醉清醒后1 h灌胃,2 h后再灌注,规定时间点处死。
2 实验检测方法
2.1 氧化应激水平检测 取再灌注后12 h、1 d、2 d、3 d每个时间点各10只大鼠缺血侧皮质脑组织约50 mg,置于玻璃匀浆器中匀浆,1000×g离心10 min,取上清液,按照试剂盒说明书步骤检测ROS水平和GSH活性。
2.2 荧光定量PCR检测NQO1、GCLC和GCLM mRNA 既定的时间点处死大鼠,参照文献方法立即分离同侧大脑的顶叶皮质约50 mg,该区域被认为缺血半暗带区或边缘区。按照Trizol试剂盒说明书提取总mRNA试剂盒说明进行操作。提取大脑组织总RNA参考Trizol试剂盒说明书提取。(1)提取大脑组织mRNA:参考Trizol试剂盒说明书提取总mRNA。(2)引物序列:NQO1:上游:5’- ACCTTGCTTTCCATCACCAC-3’;下游:5’-AAGACC TGGAAGCCACAGAA-3’;GCLC:上游:5’- AACAAGAAACATCCGGCATC-3’;下游:5’- TTTGATGCCTCCTCATCCTC-3’;GCLM:上游:5’-AATCTTGCCTTCCT TCCCATTG-3’;5’-GGCTTCAATGTCAGGGATGCTTTC-3’;β-actin:上游:5’-TGTCACCAACTGGGACGATA-3’;下游:5’-GGGGTGTTGAAGGTCTCAAA-3’。(3)反应体系及条件:反应体系均为10 μl,其中 SYBR Premix Ex Taq Ⅱ(2×)5 μl,cDNA 模板1.0 μl、上下游引物(10 pmol/μl)各0.4 μl、探针(10 pmol/μl)各0.4 μl,加无RNA 酶的水至3.2 μl,在DNA Engine Opticon TM 2连续荧光检测系统(MJ Research公司)中进行扩增反应。(4)反应条件为: 94 ℃预变性30 s,95 ℃ 5 s,60 ℃,30 s,55 ℃ 20 s 40个循环,4 ℃保存。每例样品及阴性对照均设3个平行复孔,取均值;(5)结果处理:ΔΔCT法:A=CT(目的基因,待测样本)-CT(内标基因,待测样本);B=CT(目的基因,对照样本)-CT(内标基因,对照样本);K=A-B,表达倍数=2-K。ΔCT值与mRNA表达量成反比,即ΔCT值越小,表明mRNA表达量越多。
2.3 Western blot检测NQO1、GCLC和GCLM蛋白表达 参照前法取大脑的顶叶皮质约50 mg,作以下处理:(1)收集蛋白样品:使用细胞裂解液对缺血半暗带组织(100 mg)样品进行裂解,然后测定每个蛋白样品的蛋白浓度; (2)电泳:在收集的蛋白样品中加入适量浓缩的5×SDS-PAGE蛋白上样缓冲液,100 ℃变性3 min,冷却到室温后,把蛋白样品(20 μg)直接上样到SDS-PAGE胶加样孔内垂直电泳进行分离(120 V);(3)PVDF转膜:使用Bio-Rad转膜装置,转膜电流为300 mA,时间为60 min;(4)封闭:转膜完毕后,立即把蛋白膜放置到预先准备好的Western洗涤液中,漂洗2 min,5%BSA37 ℃封闭60 min;(5)一抗孵育:立即加入稀释好的NQO1、GCLC和GCLM一抗(1∶50),4 ℃孵育过夜;(6)二抗孵育:二抗稀释液稀释辣根过氧化物酶(HRP)标记的二抗(1∶100),室温孵育60 min;(7)蛋白检测:超敏ECL发光液来检测蛋白,置于X-感光盒于暗室内曝光;(8)结果处理:采用凝胶成像分析系统进行图像分析,获取各组Western blot 条带的平均光密度(OD)值,内参为β-actin,目的蛋白与内参光密度比值即为目的蛋白的相对值。
2.4 统计学分析 采用SPSS 22.0统计软件包处理,成组设计多样本均数的比较用单因素方差分析,多样本均数与同组均数间的比较用LDS-t检验,检验水准α=0.05。
3 结 果
3.1 各组ROS水平和GSH活力的比较 与SO组比较,MCAO组脑组织中GSH活力显著降低,ROS活性显著升高(P<0.05或P<0.01)(见表1、表2)。
3.2 各组NQO1及GCLC和GCLM mRNA表达的变化 实时荧光定量PCR结果显示,SO组有少量NQO1、GCLC及GCLM mRNA表达;MCAO组大鼠脑缺血再灌注缺血半暗带三者表达1 d到达高峰(P<0.05或P<0.01),随再灌注时间延长其表达逐渐下降,但3 d时仍保持较高表达水平(P<0.05)(见表3)。
3.3 各组NQO1、GCLC及GCLM蛋白表达的变化 Western blot检测结果表明,SO组三者均可检测到较弱的蛋白表达,MCAO 组大鼠脑缺血再灌注12 h 缺血半暗带三者蛋白表达开始升高,24 h表达达高峰(P<0.01),随再灌注时间延长其表达逐渐下降,3 d后但仍保持较高表达水平(P<0.05) (见表4、图1)。
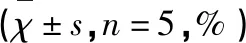
表1 各组大鼠ROS水平比较
与SO组比较*P<0.01
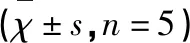
表2 各组大鼠GSH比较
与SO组比较*P<0.01

表3 各组大鼠NQO1、GCLC及GCLM mRNA表达的变化
与SO组比较*P<0.05,#P<0.01

表4 各组大鼠NQO1、GCLC及GCLM蛋白表达的变化
与SO组比较*P<0.05,#P<0.01
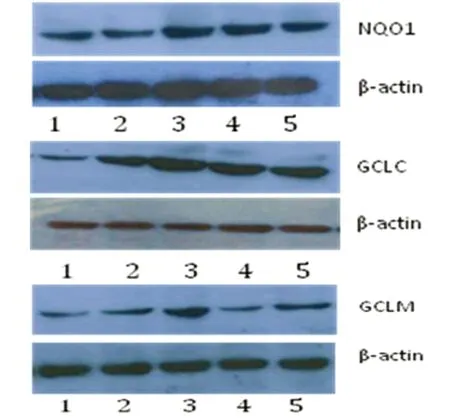
注:1~5道分别代表SO组和MCAO组12 h、24 h、2 d、3 d
图1 NQO1、GCLC及GCLM蛋白表达的Western blot图
4 讨 论
脑缺血再灌注后神经细胞损伤,从而引起其氧化磷酸化的能力大大下降,进而使ATP的合成减少,最终导致体内活性氧(Reactive oxygen species,ROS)蓄积,产生氧化应激反应。NQO1属于黄素酶,是人体Ⅱ相抗氧化酶和重要的抗氧化物质。它以NADPH为受体,催化包括ROS、辅酶Q在内的还原反应。在该酶的作用下,醌类在体内直接被还原成氢醌,减少了醌类转化产生的氧自由基,从而对醌类物质代谢引起氧化应激损伤形成一种保护机制[7],进而维持细胞内线粒体等细胞器的膜结构的稳定。NQO1的表达受到Nrf2/ARE通路的调控,其表达量与Nrf2的表达有关[8],在Nrf2敲除小鼠中它的表达明显减少[9]。
还原型谷胱甘肽(Glutathione tablets,GSH)是神经细胞内的重要还原性物质,具有清除自由基、稳定线粒体膜等作用,是体内重要的抗氧化剂。GCL是GSH合成关键酶,亦为Nrf2-ARE通路的Ⅱ相解毒酶,由GCLC和GCLM组成,其中前者分子量较大,负责ATP依赖性谷氨酸的γ-羧基和半胱氨酸氨基的连接形成[10]。后者分子量较小,通过直接与GCLC相互作用增加其催化效率。两者对GSH合成亦起着关键性的作用[11],其表达下调可引起细胞GSH合成减少,清除ROS能力下降,从而促进细胞损伤[12]。Nrf2的表达增加,GCLC则随之増加,上调GCLC的表达,能够减轻有机毒物引起的氧化应激性损伤[13]。在一些诸如阿尔兹海默病、帕金森病等神经变性病当中观察到二者的表达下降,应用抗氧化剂后,两者均上调[14~16]。而在脑血管病二者表达的变化中国内外均未见报道。
本研究结果表明,脑缺血再灌注损伤后,NQO1、GCLC及GCLM表达均明显上升,进而减少ROS的形成,并使GSH合成催化效率提高,使细胞内氧化还原反应更趋于平衡,最终减轻了神经细胞的氧化应激损伤。提示大鼠在I/R损伤后,可能通过药物影响Nrf2信号通路的下游GCLC、NQO1等蛋白的表达水平而发挥抗氧化作用从而达到神经保护的作用,这可能为脑缺血再灌注损伤的治疗提供新靶点和新思路。
