化生性乳腺癌26例临床分析
2019-11-08冉冉刘姗灵涂刚
冉冉,刘姗灵,涂刚
400016 重庆,重庆医科大学附属第一医院 内分泌乳腺外科
化生性乳腺癌是一类罕见的特殊乳腺癌,包含混合上皮及肉瘤样成分,由腺体和非腺体组织组成,仅占所有乳腺癌的0.25%~1%[1]。根据 WHO乳腺癌的国际组织病理学分类标准,化生性乳腺癌包括低级别腺鳞癌、纤维瘤病样化生性癌、梭形细胞癌、鳞状细胞癌、伴间叶分化的化生性癌(软骨、骨和其他类型的间充质分化)、混合性化生癌和肌上皮癌[2]。由于此类病例数较少,因此对其临床病理特点、诊治及预后的研究报道也比较少。本文回顾分析26例化生性乳腺癌的临床病理特征,探讨化生性乳腺癌的诊治及预后分析。
1 资料与方法
1.1 临床资料
收集重庆医科大学附属第一医院2014年1月至2018年12月收治入院的26例化生性乳腺癌患者的临床病理资料。
1.2 疗效评价
根据实体瘤的疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST 1.1)对新辅助化疗患者进行疗效评估。
1.3 随访情况
所有患者通过电话进行随访,随访内容包括生存现状、术后辅助治疗、复发及转移情况。总生存期(overall survival,OS)为患者从病理确诊乳腺癌开始至因任何原因导致死亡的时间。无病生存期(disease-free survival,DFS)为患者从病理确诊乳腺癌开始至疾病复发转移或因病情进展导致死亡的时间。
1.4 统计学方法
应用SPSS 17.0软件进行统计学分析。使用Kaplan-Meier法绘制OS、DFS生存曲线。
2 结 果
2.1 一般资料
入组26例患者,占本院同期初诊乳腺癌总数的0.6%,女性25例、男性1例,中位年龄49岁(17~80岁),均无乳腺恶性肿瘤家族史,女性患者中已绝经者11例,未绝经者14例。
2.2 临床病理特征
本组患者均表现为单侧乳房肿块,其中左乳肿块13例,右乳13例。乳腺彩超和钼靶为常规检查项目,根据彩超结果统计,肿块平均直径(3.9±1.8)cm,直径≤2.0cm者3例,介于2.0~5.0cm者17例,>5.0cm者6例。7例患者钼靶检查可见毛刺、分叶、钙化等特殊影像学征象。2例患者于确诊时合并肺转移,5例患者合并腋窝淋巴结转移。根据第8版AJCC乳腺癌TNM分期标准,本组包括I期患者3例,IIa期12例,IIb期5例,IIIa期1例,IIIb期2例,IIIc期1例,IV期2例。根据WHO国际乳腺癌组织病理学分类标准,包括混合性化生性乳腺癌5例,梭形细胞癌10例、鳞状细胞癌7例和伴间叶分化的化生癌4例。其中23例患者雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人表皮生长因子受体-2(human epidermal growth factor receptor-2,Her-2)均为阴性,2例患者ER、PR阴性、Her-2阳性,1例患者ER阳性、PR、Her-2均为阴性,详见表1。
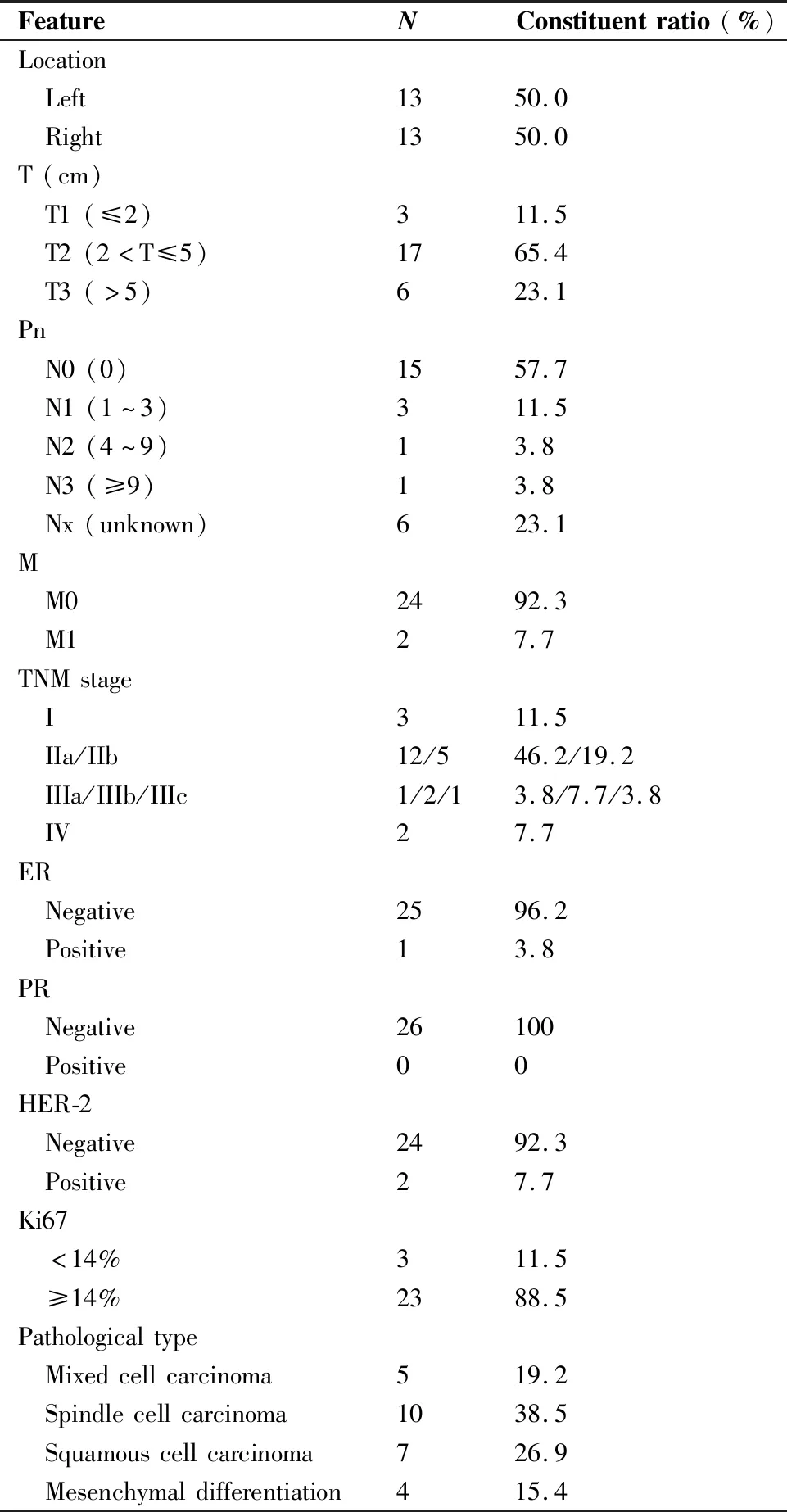
表1 26例化生性乳腺癌患者的临床病理特征Table 1. Clinicopathologic Features of 26 Metaplastic Breast Cancer Patients
ER: Estrogen receptor; PR: Progesterone receptor; HER-2: Human epidermal growth factor receptor-2.
2.3 治疗及预后
本组接受手术治疗患者共25例,仅1例患者拒绝手术选择口服卡培他滨化疗,其中改良根治术19例,单纯乳房切除术5例,保乳术1例。5例IIb~IIIc期患者术前接受新辅助化疗,化疗药物以蒽环类、紫杉醇类和铂类为主,其中4例患者临床疗效达到部分缓解,1例疾病进展。16例患者术后接受辅助化疗,化疗方案以TEC(多西他赛+表柔比星+环磷酰胺)和TP(多西他赛+顺铂)为主,术后化疗的患者中有4例分别于7~36个月出现远处转移,其中2例患者分别于14、19个月死亡,术后未接受辅助化疗的9例患者中1例于术后2个月出现局部复发,并于术后4个月死亡,另有2例患者分别于术后8、11个月出现肝转移,其中1例于术后16个月死亡。截至随访时间,全组患者中位生存期16.5个月(4~56个月),其中术后接受辅助化疗的患者中位生存期为15.0个月(4~56个月),术后未化疗患者中位生存期为17.0个月(4~23个月),术后化疗和术后未化疗患者的中位生存期差异无统计学意义(15.0个月vs17.0个月,P=0.865)。7例患者术后化疗完成后继续辅助放疗,接受放疗的患者中无局部复发出现,未接受放疗的18例患者中1例于术后2个月出现胸壁复发。另有1例 Her-2阳性患者化疗结束后继续赫赛汀靶向治疗,截至随访时间,该患者未出现疾病进展。
全组患者2年OS和2年 DFS分别为69.5%和72.7%(图1、2)。1例梭形细胞癌患者于术后2个月发生局部复发,6例患者分别于7~36个月发生远处转移(包括1例混合性化生性癌、3例梭形细胞癌以及2例鳞状细胞癌),不同病理类型化生性乳腺癌的局部复发、远处转移和死亡率差异无统计学意义(P>0.05)(表2)。截至随访时间,全组患者因肿瘤复发转移死亡5例,带瘤生存2例。

图1 26例化生性乳腺癌患者总生存曲线Figure 1. Overall Survival of 26 Patients with Metaplastic Breast Cancer

图2 26例化生性乳腺癌患者无病生存曲线Figure 2. Disease Free Survival of 26 Patients with Metaplastic Breast Cancer
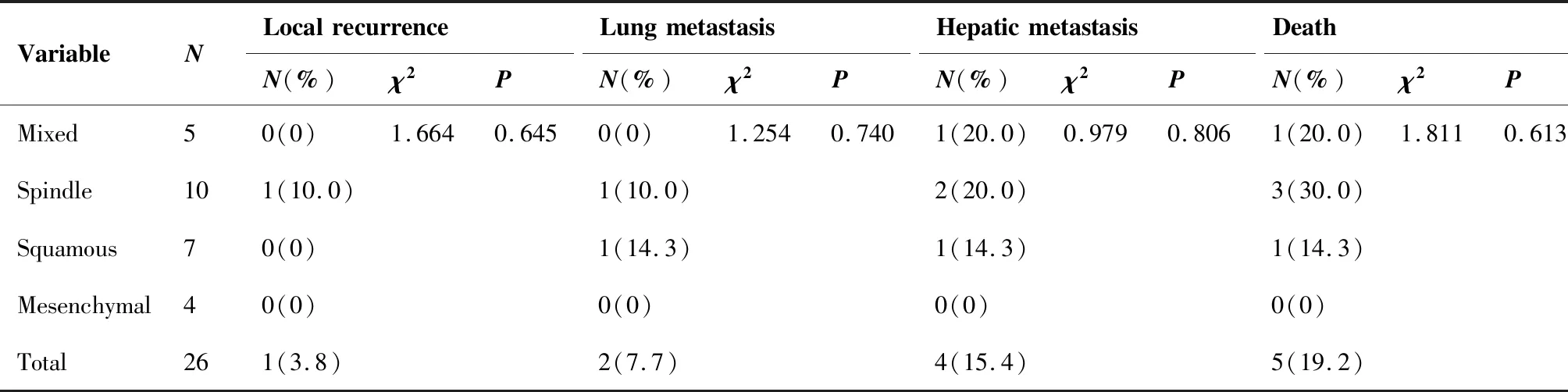
表2 不同病理亚型化生性乳腺癌的预后情况Table 2. Prognosis of Metaplastic Breast Cancer with Different Pathological Types
3 讨 论
化生性乳腺癌通常好发于50岁以上妇女,近半数患者肿瘤直径可超过5.0cm[3]。作为特殊类型乳腺癌,化生性乳腺癌的发生与上皮-间质转化有关,常包含多种异质性成分,如肉瘤样成分、鳞癌、梭形细胞癌、间叶成分以及坏死组织等[4-5]。有研究表明,即使不同成分的化生性乳腺癌均表现为基底样表型,但是在化生性乳腺癌中ER、PR和Her-2常常呈三阴性表达[6],在本组患者中三阴性化生性乳腺癌患者占比高达88.5%(23/26)。与非特殊类型浸润性乳腺癌相比,化生性乳腺癌患者早期出现血源性转移比淋巴转移更常见[7]。但本组19.2%(5/26)的患者存在腋窝淋巴结转移,仅7.7%(2/26)的患者早期出现肺转移,这与国内外大宗文献所报道结论相悖,但Davis等[8-9]发现腋窝淋巴结转移多发生于纯上皮性化生性乳腺癌中。在本组患者中,纯上皮性化生性乳腺癌占比65.4%(17/26),因此在本组研究结果血运转移率低于淋巴结转移率,可能与研究样本量少,纯上皮性化生性癌与上皮/间质化生性乳腺癌占比不均衡相关。
目前手术仍是化生性乳腺癌主要治疗手段,本组由于样本量较少,未根据手术方式进行亚组生存分析,有研究发现手术方式不影响化生性乳腺癌患者OS和DFS,但由于患者初诊时肿瘤体积较大,因此保乳率相对较低[10]。此外,Leyrer等[11]认为术后辅助放疗可能使化生性乳腺癌患者获益,研究纳入61例接受放疗的化生性乳腺癌术后患者,中位放疗总剂量为6 000cGy(范围4 256~6 640cGy),中位随访时间58个月,与未接受辅助放疗的52例化生性乳腺癌患者相比,结果发现未接受辅助放疗的患者局部复发风险更高[RR: 3.100(1.130~9.880),P=0.027]。也有研究发现术后辅助放疗可以同时提高OS和DFS这一结果与患者所接受手术方式无明显联系,但对于肿瘤直径≥5.0cm或伴有4个及以上腋窝淋巴结转移的患者,更建议行改良根治术合并术后放疗[12-13]。
根据美国国立综合癌症网络指南,化生性乳腺癌治疗原则与非特殊类型浸润性乳腺癌一致,建议患者术后接受辅助化疗。Cimino-Mathews等[14]纳入45例化生性乳腺癌患者,研究结果发现接受辅助化疗患者的OS高于未接受化疗患者。Rakha等[15]也在研究中发现接受辅助化疗患者的乳腺癌特异生存率相比未接受辅助化疗的患者更高(HR:0.305,95%CI:0.143~0.650,P=0.002)。但目前化疗对化生性乳腺癌治疗效果尚不明确,并且在指南中提出病理亚型是化生性乳腺癌的一个独立预后因素。国内外有文献报道化生性乳腺癌患者对全身化疗反应较差,且相比于非特殊类型浸润性癌患者更容易产生耐药性[16-17]。Adams等[18]报道了1例梭形细胞癌患者在术后接受阿霉素联合环磷酰胺化疗仅3次后即出现局部复发和肺转移。本组有16例患者术后接受辅助化疗,化疗方案以TEC和TP为主,接受化疗患者与9例术后未接受化疗患者中位生存期差异无统计学意义(15.0个月vs17.0个月,P=0.865)。这一结果可能与化生性乳腺癌对常规化疗药物不敏感且不同病理亚型的预后情况尚不明确相关。但由于本组纳入患者较少,随访时间较短,化疗方案单一,且缺乏不同病理亚型的亚组分析,因此还需要进一步累积样本量、延长随访时间对化生性乳腺癌辅助化疗进行深入研究。
此外,新辅助化疗在化生性乳腺癌的治疗中也备受争议。由于化生性乳腺癌初诊时肿瘤体积较大,分期较晚,根据指南建议,临床中晚期化生性乳腺癌患者常常接受新辅助化疗。本组有5例患者术前行新辅助化疗,化疗药物以蒽环类、紫杉醇类和铂类为主,根据RECIST1.1评估标准临床疗效达病情部分缓解者4例,临床进展者1例。与我们的研究结果相似,国外有文献报道铂类联合紫杉醇类药物可以使化生性乳腺癌患者在新辅助化疗中明显获益[19]。Alan等[20]也报道了1例鳞状细胞癌患者在接受紫杉醇类联合蒽环类药物新辅助化疗后达到病理完全缓解。尽管部分案例报道化生性乳腺癌患者可于新辅助化疗中短期获益,但目前尚无明确证实有效的新辅助化疗方案。并且有研究报道3例化生性乳腺癌患者(1例梭形细胞癌、1例鳞状细胞癌和1例伴软骨分化化生性乳腺癌)接受TEC方案(多西他赛+表柔比星+环磷酰胺)新辅助化疗后均未见肿瘤缩小[21]。在临床中传统的新辅助化疗方案对化生性乳腺癌患者的治疗效果仍不明确,还有待进一步探究敏感有效的化疗方案。
本组患者ER、 PR、 Her-2均表达阴性者占比高达88.5%(23/26),与国内外报道相似[22-23],因此多数患者不适合内分泌治疗,但针对激素受体阳性患者,内分泌治疗是必不可少的。此外靶向治疗有望成为化生性乳腺癌的有效治疗方式。德克萨斯大学安德森癌症中心发现PI3K/mTOR/Akt信号通路可能是治疗化生性乳腺癌的潜在靶点,他们发现接受替西罗莫司联合脂质体多柔比星、贝伐单抗治疗治疗的患者病情可达临床稳定至少6个月,临床获益率可达60.0%[24-25]。
肿瘤直径较大、血运转移发生较早、激素受体阳性表达率低等特点共同决定了化生性乳腺癌的不良预后,研究发现化生性乳腺癌患者生存率甚至低于同期三阴性乳腺癌患者[26]。由于本组研究以单中心病例进行回顾性研究,研究样本量少,随访时间短,仅仅分析研究患者的2年DFS和OS分别为72.7%和69.5%,并且得出不同病理亚型化生性乳腺癌患者局部复发和远处转移以及死亡率无明显统计学差异,这与Takala等[27]研究报道梭形细胞癌与鳞状细胞癌复发转移风险相比其他亚型化生性乳腺癌更高有所不同,因此我们还需要积累研究样本、延长随访时间来进一步了解化生性乳腺癌预后情况。
总之,化生性乳腺癌是一类侵袭性高、预后较差的特殊类型乳腺癌,目前治疗以手术为主,辅助放疗可能使患者获益,但化疗疗效尚存争议,中晚期患者可接受新辅助化疗,但需密切随访肿瘤进展,对于新辅助化疗不敏感的可手术患者,还应尽早手术治疗。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
