谷胱甘肽S-转移酶P-1基因遗传变异对接受替莫唑胺联合放疗的脑胶质瘤患者预后的影响*
2019-11-08陈劲松林富朱双根范少平马建国李归宿
陈劲松,林富,朱双根,范少平,马建国,李归宿
518109广东 深圳,深圳市龙华区人民医院 神经内科(陈劲松、林富、朱双根、李归宿), 神经外科(范少平),肿瘤科(马建国)
脑胶质瘤起源于神经胶质细胞,是颅内最常见的原发性肿瘤,约占所有中枢神经系统肿瘤的27%,根据权威的流行病学数据显示,目前脑胶质瘤在我国每年新发病例5万人左右,而且其发病率逐年递增,年增长率约为1%~2%[1]。根据WHO中枢神经系统肿瘤分类将胶质瘤分为WHO I~Ⅳ级,其中Ⅲ和Ⅳ级为高级别脑胶质瘤[2]。近年来,脑胶质瘤研究领域进展较为缓慢,尽管根治性手术加放化疗给患者带来了显著的生存获益,但由于胶质瘤呈浸润性生长,对周围正常脑组织的放射性损伤以及替莫唑胺等化疗药物的耐药等因素都给胶质瘤的治疗带来了极大的挑战[3]。因此,术后放疗联合替莫唑胺的耐药机制以及探讨对同步放化疗敏感的生物标记物是当前脑胶质瘤领域的研究热点。
目前常规分割放疗的基础上联用替莫唑胺化疗是成人高级别脑胶质瘤患者术后辅助治疗的标准方案,患者中位生存时间达到14.6个月[4]。作为一种新型的口服烷化剂,替莫唑胺具有广谱的抗肿瘤活性,通过口服吸收,以接近100%的生物利用度进入全身血液循环[5]。在生理pH状态下,迅速转化为活性产物3-甲基-(三嗪-1-)咪唑-4-甲酸胺[3-methyl-(triazine-1-)imidazole-4-formamide,MTIC]从而通过甲基化加成物的错配修复发挥细胞毒作用,同时和放疗联用具有协同增敏作用[6-7]。
谷胱甘肽S-转移酶P-1(the glutathione S-transferase P-1,GSTP1)在胶质瘤细胞外源性物质解毒过程中具有重要作用,通过催化许多疏水和亲电化合物与还原型谷胱甘肽的结合进而发挥生物解毒或生物转化的作用。编码该蛋白的GSTP1基因位于染色体11q13.2,包含7个外显子,该基因具有较大的种族差异,不同人群中GSTP1基因mRNA的表达也不同。目前在中国人群中,该基因的多态性研究尚不多。在先前高加索人群的研究中发现,位于GSTP1基因编码区的Ile105Val变异在接受同步放化疗治疗的胶质瘤患者中与总生存期相关[8],也有研究表明该位点和接受铂类为基础的化疗药物引起的骨髓抑制显著相关[9]。
因此,本研究旨在探讨GSTP1基因遗传变异对术后接受替莫唑胺联合放疗的脑胶质瘤患者预后的影响,并探讨该位点和GSTP1基因mRNA表达的关联。
1 资料与方法
1.1 研究设计及治疗方案
本研究纳入2010年1月到2018年6月在深圳市龙华区人民医院术后接受替莫唑胺联合放疗的脑胶质瘤患者175例。入组标准:组织学确诊为高级别的脑胶质瘤且接受了手术切除治疗;年龄≥18岁;东部肿瘤协作组(Eastern Cooperative Oncdogy Group,ECOG)评分0~2分;肝肾功能正常,血常规正常(中性粒细胞计数≥1.5×109/L,血小板计数≥100×109/L)。排除标准:合并其他肿瘤或严重疾病的患者,没有接受术后替莫唑胺联合放疗治疗的患者。
调强适形放疗的实施方案为:接受手术切除后6周以内开始放疗计划,总剂量结合患者情况给予54或60Gy,30次分割,1.8或2.0Gy/次,每天一次,每周前5天,共计6周。替莫唑胺用法用量为:同步放疗期间,和放疗同一天开始,75mg/m2每天,共计42天,治疗过程中根据患者耐受情况可暂停用药,不超过49天。同步放化疗结束后4周,患者接受6个周期的替莫唑胺单药辅助化疗,第一个周期150mg/m2,随后每个周期200mg/m2,第1~5天,28天一个周期。治疗过程中根据患者的耐受情况调整替莫唑胺的治疗周期。本研究得到医院伦理委员会的批准,每位入组的患者或患者家属均签署了知情同意书。根据RECIST 1.1标准进行疗效评估。
1.2 GSTP1基因Ile105Val位点基因分型
入组该研究的患者在接受放化疗前用EDTA抗凝管收集外周血样本4mL,用苯酚氯仿法提取基因组DNA,进行后续PCR扩增。GSTP1基因Ile105Val变异(rs1695)的基因分型通过限制性片段长度多态性聚合酶链反应(PCR-RFLP)方法进行。扩增包含该位点的PCR产物的上游引物为:5’-CCCCAGTGACTGTGTGTTGA-3’,下游引物为:5’-CAAGAAGCCCCTTTCTTTGT-3’。PCR产物大小为226bp,通过限制性内切酶Tail对产物进行孵育消化,通过条带的大小判断基因型:AA型有两条带,一条45bp带,一条181bp带;AG型有三条带,一条45bp带,一条181bp带,一条226bp带;GG型仅有一条带,为226bp带。另外,随机挑选部分样本通过飞行质谱的方法进行基因型的验证。
1.3 GSTP1基因mRNA表达分析
从入组研究的175例患者中收集接受放化疗前的新鲜外周血样本提取外周血单核细胞(peripheral blood mononuclear cell,PBMC),最终纳入表达分析的为78例PBMC标本。使用Trizol试剂进行RNA提取,通过罗氏real-time PCR仪器进行对GSTP1mRNA表达进行分析,上游引物为:5’-GTAGTTTGCCCAAGGTCAAG-3’,下游引物为:5’-AGCCACCTGAGGGGTAAG-3’。RT-PCR反应体系如下:SYBN Premix Ex Tag溶液10μL,上下游引物(20μM)各0.2μL,ddH2O 7.6μL,cDNA2μL,总计20μL,GAPDH mRNA表达作为内部参照。GSTP1 mRNA的表达计算是采用2-△△Ct相对定量法来进行。
1.4 统计分析
统计分析采用SPSS 19.0版本。在基线临床资料当中,离散型的变量和Ile105Val变异不同基因型的分布采用χ2检验。连续型的变量和该位点不同基因型的分析采用非参检验的Mann-WhitneyU检验。用Stata 14.0绘制Kaplan-Meier曲线比较不同基因型患者无进展生存期(progress free survival,PFS)和总生存期(overall survival,OS)的差异,曲线间的差异用对数秩检验进行统计学差异的比较。PFS为从手术日至疾病进展或任何原因导致的死亡(以先发生的计算),OS为从手术日至任何原因导致的死亡,未出现进展死亡的,按末次随访记录为截止。构建多变量Cox风险比例模型校正相应的评价指标,显著性差异的水准为P<0.05。
2 结 果
2.1 患者基线临床资料及GSTP1 Ile105Val变异基因分型情况
纳入研究的175例脑胶质瘤患者的基线临床资料如表1所示:中位年龄58岁(25~79岁),男性患者111例(63.43%)。ECOG评分0、1、2分的患者分别为73例,65例和37例。病灶活检切除或部分切除患者103例(58.86%),全部切除患者72例(41.14%)。WHO分级Ⅲ级和Ⅳ级患者分别为33例和142例。异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)基因突变阳性患者48例,突变阴性患者74例,无法评价患者53例。放射治疗的剂量方面,接受54Gy者29例,60Gy者146例。
Ile105Val变异的基因分型结果为:AA型119例(68.00%),AG型51例(29.14%),GG型5例(2.86%),最小等位基因频率为0.17,该位点基因型分布频率符合Hardy-Weinberg平衡(P=0.868)。后期分析以显性遗传方式将AG型和GG型患者合并进行分析。如表1所示,Ile105Val变异不同基因型患者在基线临床资料中分布均衡。
2.2 GSTP1基因Ile105Val变异对预后的影响
研究最后一次随访为2018年12月,中位随访时间29.5个月(0.9~40个月)。
无进展生存期的分析如图1所示,携带A等位基因的AG/GG基因型和AA基因型患者的中位PFS分别为4.4和6.9个月,差异有统计学意义(P=0.005)。

表1 175例脑胶质瘤患者中根据GSTP1 Ile105Val多态性位点不同基因型的患者基线临床资料对比Table 1. Baseline Characteristics of 175 Glioblastoma Patients According to GSTP1 Ile105Val Genotypes
ECOG: Eastern Cooperative Oncology Group; WHO: World Health Organization; IDH: Isocitrate dehydrogenase.

图1 175例脑胶质瘤患者中根据GSTP1 Ile105Val位点不同基因型的患者的无进展生存期曲线对比Figure 1. Progression Free Survival of 175 Glioblastoma Patients According to GSTP1 Ile105Val Genotypes
OS的分析如图2所示,AG/GG型和AA基因型患者的中位OS分别为11.0和15.3个月,差异有统计学意义(P<0.001)。另外,本研究为了校正其他混杂因素对OS的影响构建了Cox风险比例模型,将可能影响OS的风险因素如年龄,性别,ECOG评分(1~2分为一组),WHO分级,放疗剂量以及Ile105Val变异纳入该模型。经过多变量校正后(表2),Ile105Val变异对OS仍然具有独立的影响意义(OR=1.85,P=0.008)。其他在Cox模型当中对OS具有独立影响意义的因素有:年龄(OR=1.45,P=0.015),ECOG评分(OR=2.11,P=0.011),WHO分级(OR=0.45,P<0.001)。
2.3 GSTP1基因Ile105Val变异对GSTP1基因mRNA表达的影响
此外,研究还纳入了78例PBMC标本,通过提取总RNA检测GSTP1mRNA的表达情况,之后和这78例样本中Ile105Val变异的基因型进行关联分析。在78例PBMC标本中,AA型53例,AG型23例,GG型2例,三种基因型分布频率同样符合Hardy-weinberg平衡(P=0.790)。同样,以显性遗传的方式将AG和GG基因型分为一组,共计25例。结果如图3所示,AG/GG基因型相对于野生型的AA型患者,PBMC中GSTP1mRNA的相对表达明显较高[(4.01±0.472)vs(2.76±0.624),P<0.001]。
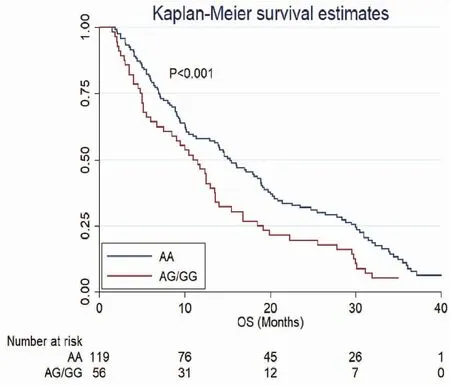
图2 175例脑胶质瘤患者中根据GSTP1 Ile105Val位点不同基因型的患者的总生存期曲线对比Figure 2. Overall Survival of 175 Glioblastoma Patients According to GSTP1 Ile105Val Genotypes

表2 根据基线临床资料及GSTP1基因Ile105Val位点针对OS的多变量Cox风险比例模型Table 2. Multivariate Cox Regression Analysis of OS According to Baseline Characteristics and GSTP1 Ile105Val Polymorphism
OS: Overall survival; OR: Odds ratio; CI: Confidence interval; df: Degree of freedom; ECOG: Eastern Cooperative Oncology Group; WHO: World Health Organization.

图3 78例PBMC标本中根据GSTP1基因Ile105Val位点不同基因型患者GSTP1基因mRNA相对表达情况对比Figure 3. GSTP1 mRNA Expression of 78 Peripheral Blood Mononuclear Cell Specimens According to GSTP1 Ile105Val Genotypes
3 讨 论
本回顾性分析纳入175例术后接受替莫唑胺同步放疗的脑胶质瘤患者,通过对GSTP1基因Ile105Val变异基因分型并与患者的预后进行关联性分析,发现Ile105Val变异AG/GG基因型患者具有显著较差的PFS和OS,另外在78例具有PBMC标本的患者的mRNA表达水平分析中发现,该位点不同的基因型患者的GSTP1基因mRNA表达水平呈现较大的差异。研究结果初步表明Ile105Val变异可能通过影响了GSTP1基因mRNA的表达进而影响了术后接受替莫唑胺同步放疗的脑胶质瘤患者的预后。
脑胶质瘤是异质性较强的恶性肿瘤,近年来给患者带来生存获益的治疗进展较为缓慢[10]。目前,研究结果表明最大安全切缘的手术切除可以进一步明确诊断,改善神经功能症状并为术后辅助放化疗提供有利条件[11]。另外也有大量的证据表明了术后同步放化疗无论对于低级别还是高级别脑胶质瘤患者具有明显的生存获益[12]。然而术后脑胶质瘤患者接受同步放化疗在临床治疗结果和预后上也有较大的个体差异,明确影响术后放化疗的预后因素有助于提高临床治疗脑胶质瘤的整体疗效。药物基因组学方面目前已经有较多的可以预测脑胶质瘤预后的生物标记物的研究成果:2018年报道的血管内皮生长因子遗传变异位点rs1005230和胶质瘤的发病风险和预后显著相关[13]。2017年报道的MGMT基因启动子区域的多态性位点rs1625649的甲基化对脑胶质瘤患者的预后具有较差的影响[14]。随后报道的MC4R基因多态性rs489693位点在接受同步放化疗的脑胶质瘤患者中的疗效预测价值[15]。
本研究的结果首次发现了在中国脑胶质瘤患者接受同步放化疗后,GSTP1基因Ile105Val变异对患者预后具有明显的影响。首先,本研究中Ile105Val变异的最小等位基因频率为0.17,这和NCBI数据库中中国人群中的突变频率基本一致,但是从高加索人群的结果来看[16],该位点的基因型分布频率具有较大的种族差异。预后结果上,本研究和先前意大利的Pasqualetti团队[8]的研究基本一致,他们的研究纳入50例IDH1/2基因野生型的接受同步放化疗的脑胶质瘤患者,分析了XRCC1,XRCC3,RAD51和GSTP1基因的多态性与PFS以及OS的关联,结果发现GSTP1基因rs1695位点AA型患者具有显著较差的预后,这和本研究中AA基因型患者具有较好的预后结果不太一致,可能是因为该位点的种族差异所致,因为他们的研究中rs1695位点的最小等位基因频率达到了0.38,远高于我们研究中的0.17。不过,在亚洲人群中,日本学者Yoshihama团队[17]的研究纳入了320例接受卡铂紫杉醇治疗的妇科肿瘤患者,分析了GSTP1基因rs1695位点对接受治疗患者的预后及安全性的影响,结果发现rs1695位点AA型患者和较高的血液学毒性相关,另外G等位基因携带者具有较差的预后,这和本研究的结果基本一致,但是他们的研究并没有评估该位点和GSTP1基因mRNA表达的关系。另外有较多的研究发现,rs1695位点和接受顺铂为基础化疗出现的毒副作用有关,先前法国Lui团队[18]的研究纳入了161例接受顺铂或卡铂治疗的儿童肿瘤患者,结果发现rs1695位点AA基因型患者和较多的耳毒性显著相关,这说明了该位点会对化疗药物有一定的作用,本研究并没有评估该位点和毒副作用的关联,这需要后期进一步的探索。
GSTP1是谷胱甘肽S-转移酶家族中的一员,通过催化许多疏水和亲电化合物与还原型谷胱甘肽的结合进而发挥生物解读或生物转化的作用[19]。Ile105Val变异为非同义突变,位于该基因编码区改变了氨基酸序列,可能会影响GSTP1基因表达以及GSTP1蛋白的功能。关于GSTP1基因表达水平和患者预后目前尚没有统一结论,目前有研究报道了GSTP1在结直肠癌等肿瘤中为高表达状态[20]。先前Theisen团队[21]的研究纳入32例晚期食管癌患者,通过分析GSTP1基因表达状态和治疗反应率的关联后发现,GSTP1表达较低的患者具有较好的预后。这和本研究mRNA表达分析的结果具有一致的趋势。可能的解释为G等位基因携带者通常伴随了较高的GSTP1基因表达,使得更多的替莫唑胺被解毒或转化从而降低了替莫唑胺的细胞毒作用,进而伴随了较差的预后。此外,本研究纳入的多态性位点是位于GSTP1基因编码区的非同义突变,该位点可能和位于GSTP1基因启动子区域的某个多态性位点处于高度的连锁不平衡,从而造成了GSTP1基因mRNA表达上的差异。
综上所述,GSTP1基因Ile105Val多态性位点AG/GG基因型患者可能通过介导了较高的GSTP1基因mRNA表达,从而使脑胶质瘤患者具有较差的PFS和OS。GSTP1基因Ile105Val遗传变异位点可以作为评估接受替莫唑胺联合放疗辅助治疗的脑胶质瘤患者预后的生物标志物。本研究还存在一定的局限性,如样本量较少,为回顾性研究,期待后期的前瞻性大样本的研究提供更充分的证据。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
