食管癌根治性同步放化疗后局部失败病变补救性内镜治疗的研究进展
2019-11-08苏曼冯笑山高社干
苏曼 冯笑山 高社干
河南科技大学临床医学院,河南科技大学第一附属医院肿瘤科,河南洛阳 471003
0 引言
食管癌恶性程度高,预后差,居世界癌症相关死亡率的第六位[1]。对于局部晚期食管癌(Esophageal cancer,EC),目前的标准治疗方法是新辅助放化疗后行食管癌切除术[2-5],而对于无手术指征或拒绝手术的患者,根治性同步放化疗(definitive chemoradiotherapy,dCRT)已被作为非侵入性治疗的标准治疗方法[6-12]。在亚洲,大部分的食管癌患者是食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC),对dCRT 的反应较好。根据日本临床肿瘤学小组的研究,I 期和II/III 期的食管鳞状细胞癌患者接受dCRT 后的完全缓解(complete response,CR)率分别为89%和63%[13-14],T4 期和/或M1 期淋巴结转移患者的CR 率为33%[15]。尽管局部晚期食管癌患者接受dCRT 后的CR 率较高,但是仍有40%~60%的患者出现局部失败病变(残留或复发)[13-17]。目前针对dCRT 局部失败病变的补救性治疗包括:补救性食管癌切除术(Salvage surgery,SS)、补救性内镜治疗(salvage endoscopic treatments,sET)和补救性二线放化疗。其中SS 手术并发症的发生率和死亡率较高,而二线放化疗对dCRT 局部失败的食管癌患者的疗效极其有限,通常作为姑息治疗方法,所以创伤性小、安全性高的sET 近几年被中国学者广泛关注。
sET 主要包括补救性内镜下手术切除术(salvage endoscopic resection,sER)、补救性光动力治疗(salvage photodynamic therapy,sPDT)和补救性氩离子血浆凝固术(salvage Argon plasma coagulation,sAPC)。而sER 又包括补救性内镜下黏膜切除术(salvage Endoscopic mucosal resection,sEMR)和补救性内镜下黏膜下剥离术(salvage endoscopic submucosal dissection,sESD)。现对sET 适应证、不同手术效果预后进行归纳总结。
1 sET 的适应征
虽然sET 的创伤性小、安全性高,但并不是所有局部失败的患者均适应于该治疗方法。应根据癌症的类型、位置和局部累及状况,以及每个病人的功能状态进行个体化评估,以确定合适的治疗方案。
根据Hombu[16]、Nishisaki[17]及Matsutani[18]等人的报道进行总结。
sER(EMR、ESD)的治疗适应证包括:1)病变无深部溃疡;2)通过超声内镜(EUS)和计算机断层扫描(CT)临床确定无淋巴结转移和远处转移(NO 和MO);3)病变局限于粘膜下层(T1)的确定的或可疑的癌性肿块;4)通过内镜切除预期可以达到CR。
sPDT 的适应证包括:1)EUS 和CT 临床确定为NO 和MO;2)病变局限于固有肌层(T2)以内的局限性病变;3)患者拒绝或不能耐受SS。但是Hatogai 等人[19]则认为对于局限于T1b(SM1:粘膜下层的上1/3)以内的局部失败的病变应进行sER,对病变为T1b(SM2:粘膜下层的2/3)或T2 的局部失败病变应进行sPDT。
sAPC 治疗的适应证如下:1)原发灶残留或复发肿瘤;2)EUS 和CT 临床确定为NO 和MO;3)患者拒绝接受挽救手术或生理状况不佳,妨碍挽救手术。
2 sET 手术类型
2.1 sEMR
EMR 是利用高频电切技术而进行的,将病变所在黏膜剥离而达到治疗目的或作大块组织活检而协助诊断目的的内镜下操作技术。作为主要的内镜治疗技术之一,EMR 广泛的应用于早期消化道肿瘤的治疗。Makazu[20]等人回顾性分析了11 例dCRT 局部失败的食管癌患者(详见表1),在接受sEMR 治疗后,患者的5 年总体生存率为41.6%。sEMR 具有复发率低和预后好的优点,是IB、II、III 期食管鳞状细胞癌术后局部复发或残留病灶的有效治疗手段。Yano 等人[21]回顾性分析了21 例dCRT 局部失败后接受sEMR 治疗的食管癌患者(详见表1),38%的患者没有出现复发情况;5 年生存率为49.1%,并且没有严重并发症发生。由此推断,对于dCRT 局部失败的食管癌患者,如果患者病变不超过粘膜层且无淋巴结或远处转移,则sEMR 是对dCRT 局部失败的食管癌患者补救治疗的治疗选择之一。

表1 局部失败病变补救性内镜治疗的近期疗效及远期疗效
2.2 sESD
ESD 技术起源于日本,被用于治疗早期胃癌患者。近年来,我国在ESD 技术推广和应用方面取得了很大进步,ESD 已经成为早期食管癌患者和手术耐受性较差食管癌患者的重要治疗手段[22]。ESD 是在EMR 基础上发展的一种新的内镜治疗方法,使用多种内窥镜刀切开病变组织周围的黏膜,沿着黏膜的下层进行剥离切除病变组织的一种微创治疗方法。由于技术和设备的限制,传统EMR治疗食管癌的完整切除率较低,尤其是直径大于2 cm 的病变部位。另外,由于EMR 手术切除样本体积较小,需要多次进行多次切除,整块切除率低是EMR 治疗后复发的主要原因。由于EMR 对操作者的经验和娴熟程度要求比较高,操作时间长,在内镜下切除病变部位的精确度很难控制,不能完整地切除病变组织或者过多的黏膜被切除都会导致更多的术后并发症,增加治疗风险[23]。
相比EMR,ESD 不限病变部位的形状和大小,切除深度较深,具有整块切除率高的优势,黏膜下纤维化病变可一次性完整切除,并可评价切缘有无癌细胞残留等。至今国内关于EMR 和ESD 疗效比较的研究仍较少。Takeuchi 等[24]报道的采用sESD 治疗dCRT 局部失败病变的的研究中(详见表1),所有患者的病变均为粘膜内或粘膜下肿瘤且无转移。在短期疗效中(包括治疗期间),sESD与初次ESD(ESD 前未经任何治疗)之间没有显著差异。sESD 治疗后患者未发现严重并发症。在54.6 月中位随访时间内,患者局部复发率为0%。但其中15.8%的患者因淋巴结转移和远处转移而死亡,31.5%的患者死于其他疾病,无ESCC 复发。Inadomi 等[25]人研究发现当CRT 局部失败的病灶位于粘膜下层且无转移时,sESD 可以作为补救治疗的选择,延长患者的生存时间。
2.3 sPDT
PDT 是指通过静脉注射光敏剂,当肿瘤组织中有较高浓度光敏剂积聚时,用特定波长光源(激发光)对肿瘤组织进行照射,使之产生光化学反应,进而引起肿瘤细胞坏死、凋亡的治疗新方法。晚期食管癌患者由于无法进行根治性切除,放疗、化疗对晚期食管癌患者的疗效较差,并且并发症风险大,而PDT 具有可重复应用不产生耐药性的优点,所以,PDT 特别适用于晚期食管癌患者的临床治疗[26]。Hatogai 的团队一直在研究sPDT 对CRT 局部失败病变的疗效,在最新的一项回顾性研究中[11]共纳入了113 例dCRT 局部失败的患者,病变局限于T2 期以内且没有转移,sPDT 治疗后的完全缓解率为58.4%,sPDT 的5 年的疾病无进展生存率和总生存率分别为22.1%和35.9%。治疗相关死亡率为1.8%。此外,CRT 之前N0 与总生存率显著相关,而CRT 之前T1 或T2 与PFS,CRT 和PDT之间的间隔时间的长短与总生存率轻微相关。由此可见,sPDT 治疗dCRT 局部失败的食管癌患者安全有效,预后好。
2.4 sAPC
APC 是一种新型的非接触性凝固方法,其能量经电离的氩气传送至靶组织,使组织表面有效凝固,从而起到止血和破坏有关组织的作用。APC结合黏膜下药物注射是食管癌前病变局部阻断的有效治疗方法。与普通高频电凝固相比,APC 对医生的操作经验要求较高。在Matsutani 等[18]的研究中(详见表1),食管鳞癌患者dCRT 后,浅表生长组患者的无复发生存率和总体生存率均高于粘膜下生长组。sAPC 治疗60 个月后随访发现没有患者出现并发症。Nakamura 等[27]报道了对CRT或放疗(RT:radiotherapy)后没有淋巴结或远处转移的局部失败病变进行sET 治疗,由于CRT 或RT 后在粘膜层下面形成严重的纤维化,给sER 技术上带来了很大的困难,但没有造成严重并发症。初次治疗后5 年总生存率54.0%。
3 sET 治疗对食管癌患者预后的影响
影响食管癌患者预后的因素比较多,包括T分期、N 分期、临床分期、淋巴结转移、肿瘤体积、病变部位等。但是,关于dCRT 治疗后局部失败病变并接受sET 治疗的食管癌患者的预后因素仍不清楚,相关研究报道很少。Hatogai 等[19]共研究了716 例CRT 治疗的ESCC 患者(详见表1)。通过ER 根治性切除的患者51 例,PDT 后达到CR 的患者61 例。5 年总生存率和疾病无复发生存率率分别为38.6%和28.1%。5 年后随访发现35.4%在保留食管的情况下无一例转移。多因素分析显示,CRT 前N0 和CRT 与sET 之间的时间大于6 个月是总生存率和疾病无复发生存率的共同预后因子。Kondo 等[28]的研究发现(详见表1),T1-2 和N0是患者总生存率的重要预后因子。在Hatogai 等关于sPDT 的研究中[11]显示患者的OS 可能与CRT和PDT 间隔时间及CRT 之前肿瘤的临床分期有关。
4 sER 治疗后复发的危险因素
sER 已成为治疗局限性食管癌患者的有效治疗方案,然而关于经sER 治疗后影响患者复发的危险因素目前所知甚少。
sER 后的急性炎症反应和纤维结缔组织增生能够造成食管狭窄的发生,导致患者进食困难,严重者会引发吸入性肺炎。有研究报道,病灶大小及深度、手术切除范围是sER 后食管狭窄的形成主要危险因素。在切除病变部位的同时,尽可能保留正常的食管黏膜。在Hombu 等[16,29]的研究中显示(详见表1),患者3 年疾病无进展生存率和总生存率分别为48.9%和61.2%。多因素分析显示CRT 后晚期cT 分期和残留肿瘤与sER 术后复发显著相关。在Hatogai 等[30]的研究中显示(详见表1),5 年局部无复发生存率为59.6%(见图1),5 年总生存率为48.4%。病变大于食管周长1/4 以上是ESCC患者sET 后局部复发的唯一的显著的预后因子。CRT 之前的临床分期与总生存率轻微相关。
5 小结
据表1 中研究结果显示sET 对局限食管癌患者具有较好的疗效,dCRT 局部失败后,sEMR 治疗的R0 切除率在51%~84.6%之间,5 年OS 为41.6%~49.1%。sESD 的R0 切除率高达94.7%,3 年生存率为74%;包括sEMR 和ESD 在内的sER 的R0 切除率在51%~84.7% 之间,包括sPDT 和sAPC 的CR 率在57.5%~65.8%之间;总的sET 的3 年OS 在61.2%~74%之间,5 年OS 在38.6%~54%之间;对于局部失败病变位于浅表的患者可以进行sET 治疗。
sER 被认为是粘膜内病变的最佳一线治疗方法之一,但其不完全切除和局部复发仍然是临床上重要的问题。如果残留肿瘤或局部复发合并有溃疡、严重纤维化或狭窄,则进行sEMR 的难度较大,并有可能发生切除不完全[31]。
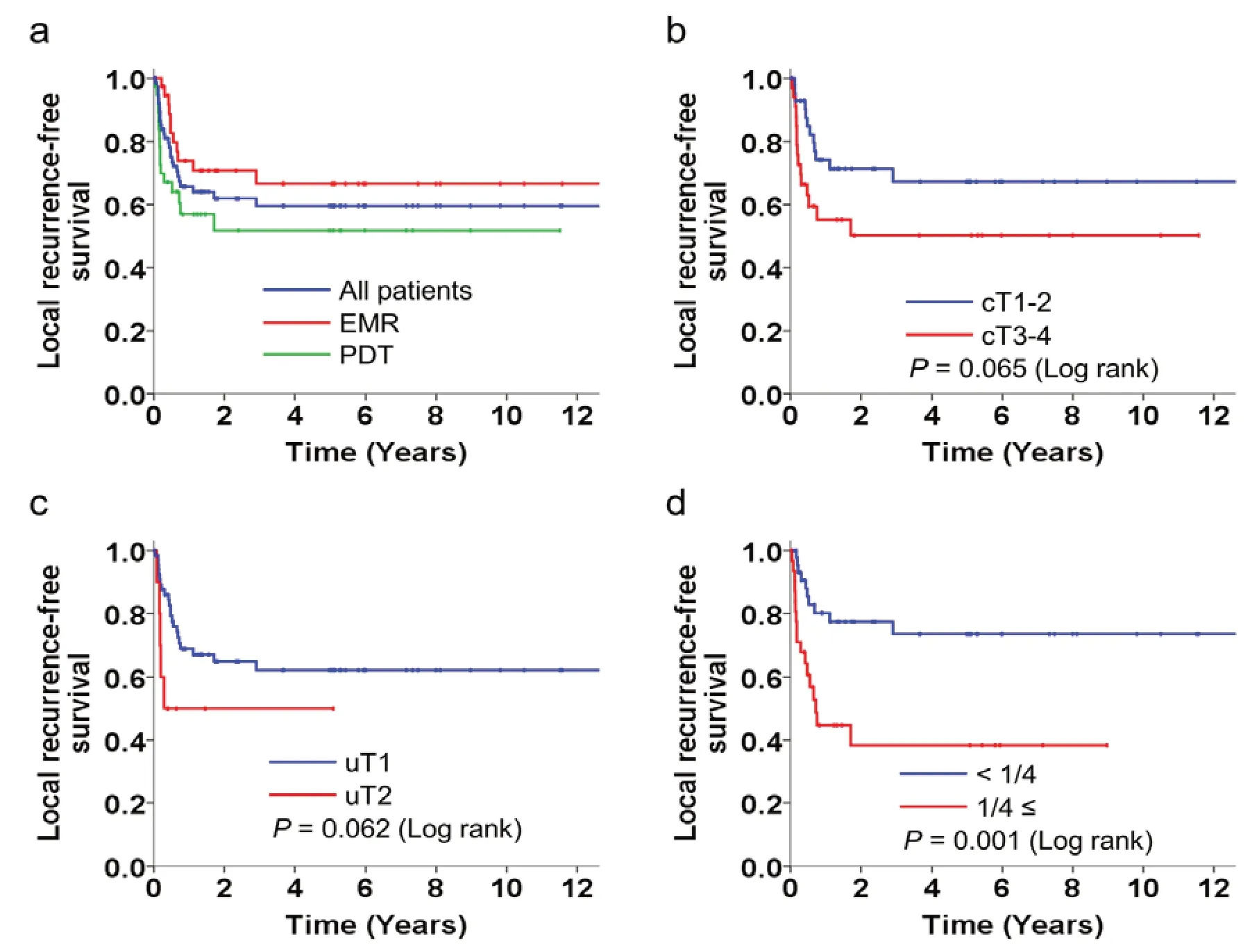
图1 补救性内镜治疗后LRFS
sPDT 疗法是适用于肿瘤入侵至粘膜下且sEMR 治疗不成功的病变。sPDT 可能是EMR 和手术之间的一个桥梁治疗。然而,临床上,sPDT 过程中发生食管瘘,纵隔炎和心包积液等并发症的机率较高[32-33]。此外,在dCRT 局部失败的食管癌患者中sPDT 的效果往往低于首次PDT,且sPDT 治疗过程中严重并发症发生率高[34]。
在综合评估本研究结果的基础上,我们认为sER、sAPC 治疗应该用于局部失败的浅表病变的治疗,而sPDT 应该是治疗粘膜下病变的治疗。患者的OS 可能与dCRT 和补救治疗间隔时间及dCRT 之前的临床分期有关,食管癌患者sET 局部复发的危险因素包括CRT 较高的T 分期、病变大于食管周长1/4 以上以及残留病变。
综上所述,与内镜切除标本的病理结果相比较,dCRT 或sER 之前的患者特征是sER 术后复发重要的预后因子。sER 是dCRT 局部失败病变的治疗选择之一。
