谢村黄酒酒曲微生物多样性分析及产γ-氨基丁酸能力的初步研究
2019-11-07杜丹解修超邓百万肖玉祥吴东平翟树峰
杜丹,解修超,2,3*,邓百万,2,肖玉祥,吴东平,翟树峰
1(陕西理工大学 生物科学与工程学院,陕西 汉中,723000) 2(陕西省食药用菌工程技术研究中心,陕西 汉中,723000) 3(中国谢村北派黄酒研究院,陕西 汉中,723000) 4(陕西省秦洋长生酒业有限公司,陕西 洋县, 723300)
我国黄酒产品品种繁多,生产工艺及产品风格多样。谢村黄酒源于陕西汉中,是中国北派黄酒的代表之一。黄酒酿造中微生物主要源于酒曲(Wheat Qu)的添加,在酒曲酿造过程中,微生物产生的多种代谢产物对黄酒的风味、品质及功能具有重要作用。因此,酒曲微生物群落分析对黄酒品质的稳定和提升具有指导性意义[1]。
目前酒曲微生物的研究主要有分离培养及分子生物学方法。分离培养法能够获取纯种微生物,但耗时长、工作量大,另外由于客观条件及认知限制,导致绝大多数微生物无法分离[2-4]。高通量测序技术作为一种新型分子生物学方法,能够同时对上百万条DNA序列进行测序,能够直接大规模准确分析其微生物组成,能更真实、全面、客观地分析微生物的群落结构[5-7]。高通量测序技术的应用不仅可以了解酒曲中微生物的群落组成,也可以对酒曲酿造过程中起主导作用的微生物进行针对性分析。
γ-氨基丁酸(γ-aminobutyric acid,GABA)是谢村黄酒中的一种重要的功能性成分,是一种重要的抑制性神经递质,参与多种代谢活动,具有降血压、改善神经系统、活化肝肾及防止动脉硬化等功能[8]。γ-氨基丁酸可以通过微生物发酵产生,乳酸菌[9-11]、大肠杆菌[12-13]、曲霉[14-15]、酵母[16]等多种微生物均可以利用谷氨酸脱羧酶转化谷氨酸产生GABA。
研究酒曲中的GABA对深入发掘黄酒中功效成分,在传统黄酒的基础上进一步强化黄酒产品的功效性具有重要意义。黄酒中的微生物主要来源于酒曲的添加,因此,酒曲中产GABA微生物的筛选和研究对提高黄酒的保健性具有重要作用。
目前,关于谢村黄酒中酒曲微生物及代谢产GABA微生物筛选的研究暂无报道。为了解谢村黄酒酒曲微生物组成以及微生物产功能成分GABA的情况,同时增加黄酒研究的广泛性,扩充黄酒行业信息,本实验利用分离培养结合高通量测序技术初步探究了谢村黄酒酒曲微生物多样性,同时筛选生产GABA的微生物,为研制富含GABA的保健型谢村黄酒提供理论基础。
1 材料与方法
1.1 试验材料
酒曲样品,由陕西省秦洋长生酒业有限公司提供;细菌基因组DNA提取试剂盒,天根生化科技(北京)有限公司;真菌基因组DNA提取试剂盒,OMEGA。
1.1.1 试剂
乙腈为色谱纯、盐酸为优级纯,其他试剂为分析纯。
1.1.2 培养基及配制
牛肉膏蛋白胨培养基、MRS培养基、察氏培养基、葡萄糖马铃薯琼脂培养基,北京奥博星生物技术有限责任公司;
细菌液体发酵培养基:10 g葡萄糖、10 g酵母粉、5 g蛋白胨、2 g无水乙酸钠、0.02 g MgSO4·7H2O、0.001 g MnSO4·4H2O、0.001 g NaCl、0.001 g FeSO4·7H2O、10 gL-谷氨酸钠,加水至1 000 mL,于115 ℃灭菌30 min;
真菌液体发酵培养基:50 g葡萄糖、1 g MgSO4·7H2O、1 g KH2PO4、6 g酵母浸粉、2 g CaCl2、10 gL-谷氨酸钠,加水至1 000 mL,于115 ℃灭菌30 min。
1.1.3 仪器设备
SX-300型立式高压灭菌锅,上海博讯实业有限公司;奥林巴斯CX22型显微镜,上海普赫兴电科技有限公司;BSAI24S型台式离心机,赛多利斯科学仪器有限公司;ZWT-2112B型震荡培养箱,上海智诚分析仪器制造有限公司;TA-40英国Techne型PCR扩增仪,上海恒久医疗器械有限公司;TANOAEPS30型电泳仪,上海天能科技有限公司;UV-2550紫外可见分光光度计,日本岛津国际上海有限公司;Agilent 1200型高效液相仪,安捷伦科技(中国)有限公司。
1.2 实验方法
1.2.1 传统培养方法分析酒曲中微生物多样性
1.2.1.1 酒曲微生物分离纯化
粉碎酒曲样品,取10 g样品于90 mL无菌水中,37 ℃,140 r/min条件下振荡培养30 min。取上清液梯度稀释为10-2~10-6倍,分别涂布于不同的培养基上,置于培养箱中培养。挑取形状不同的单菌落于相应的培养基上划线纯化,多次纯化后得到单一微生物。所获得真菌于葡萄糖马铃薯琼脂培养基斜面4 ℃保藏,细菌于50%(体积分数)甘油4 ℃保藏。
1.2.1.2 酒曲微生物鉴定
通过形态学观察将分离得到的细菌在牛肉膏蛋白胨培养基上进行平板划线,37 ℃培养24 h,观察菌落形态特征,通过革兰氏染色,利用显微镜观察菌体形态特征。将分离得到的真菌接种至培养基,28 ℃条件下培养观察菌落形态特征,利用显微镜观察菌体形态特征。
分子生物学鉴定:细菌用水煮法提取单菌落基因组,采用通用引物27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-GGTTACCTTGTTACGACTT-3’)对基因组进行扩增。PCR扩增反应条件:94 ℃预变性5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 90 s,33个循环;72 ℃延伸10 min,4 ℃保存。真菌采用CTAB法提取单菌落基因组,采用通用引物ITS1( 5’-TCCGTAGGTGAACCTGCGG-3’)和ITS4(5’-TCCGTAGGTGAACCTGCGG-3’)对基因组进行扩增。PCR扩增反应条件:95℃预变性5 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 45 s,33个循环;72 ℃延伸10 min,4 ℃保存。PCR产物电泳检测后送至生工生物工程(上海)股份有限公司测序,测序结果在NCBI(National Center for Biotechnology Information)中GenBank进行BL-AST(basic local alignment search tool)比对,与已知序列确定同源关系。
1.2.2 高通量测序分析酒曲中微生物多样性
1.2.2.1 基因组DNA提取
采用细菌基因组DNA提取试剂盒对样品细菌基因组DNA进行提取,采用真菌基因组DNA提取试剂盒对样品真菌基因组DNA进行提取。
1.2.2.2 PCR扩增与高通量测序
利用Qubit 2.0 DNA检测试剂盒对基因组DNA进行精确定量,以确定PCR反应中应加入的DNA的量。细菌采用引物341F(5′-CCT ACG GGA GGC AGC AG-3′)与805R(5′-GAC TAC CAG GGT ATC TAA TC-3′)扩增细菌16sV3-V4区,真菌采用引物ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2R(5′-GC TGCGTTCTTCATCGATGC-3′)扩增真菌ITS区。扩增得到的片段经纯化回收处理后由生工生物工程(上海)股份有限公司进行高通量测序。
1.2.2.3 序列处理与数据分析
通过barcode区分样品序列,并对各样本序列做质量控制。去除非特异性扩增序列及嵌合体,得到各样本有效数据。根据 97%的序列相似度对有效序列进行同源比对,并对操作分类单元(Operational Taxonomic Units,OTUs)进行聚类,在OTU聚类结果的基础上,获取OTU聚类中的代表性序列,选择丰度最高的序列作为OTU的代表性序列,获取物种在各个分类水平上的群落结果。计算香农指数(Shannon Index)、Chao1指数及文库覆盖率(Coverage)。
1.2.3 酒曲中产GABA菌株的筛选
1.2.3.1 菌株活化及发酵培养
细菌的活化及发酵培养:取保藏的细菌菌株进行活化传代培养,从活化的固体培养基上挑取适量菌体,接入到相应的种子培养基中,30 ℃振荡培养(160 r/min)24 h。然后以2%(质量分数)的接种量接种至细菌发酵培养基中,30 ℃静置或振荡培养(160 r/min)3 d。
真菌的活化及发酵培养:取保藏的真菌菌株进行活化传代培养,活化后接种至固体斜面,待长满后,制备孢子液,调节浓度为107CFU/mL。以2%(质量分数)的接种量接种至真菌发酵培养基中,160 r/min,30 ℃发酵5 d。
1.2.3.2 薄层层析定性测定GABA
取适量发酵液以8 000 r/min离心20 min,取上清待测。以1 mg/mL GABA标准液,1 mg/mLL-Glu标准液为对照,使用毛细管点样,点样间距2 cm,点样后迅速用吹风机吹干,以防止样品扩散。展层剂为V(正丁醇)∶V(冰醋酸)∶V(水)=4∶1∶3,显色剂为0.4%茚三酮水饱和正丁醇试剂,置于80 ℃烘箱显色15 min。
1.2.3.3 高效液相定量测定GABA
实验参考QB/T 4356—2012,黄酒中游离氨基酸的测定参考高效液相色谱法[17]。
色谱条件:色谱柱C18色谱柱(150 mm×4.6 mm,5 μm);流量1 mL/min;进样体积10 μL;柱温40 ℃;检测波长254 nm。梯度洗脱程序见表1。
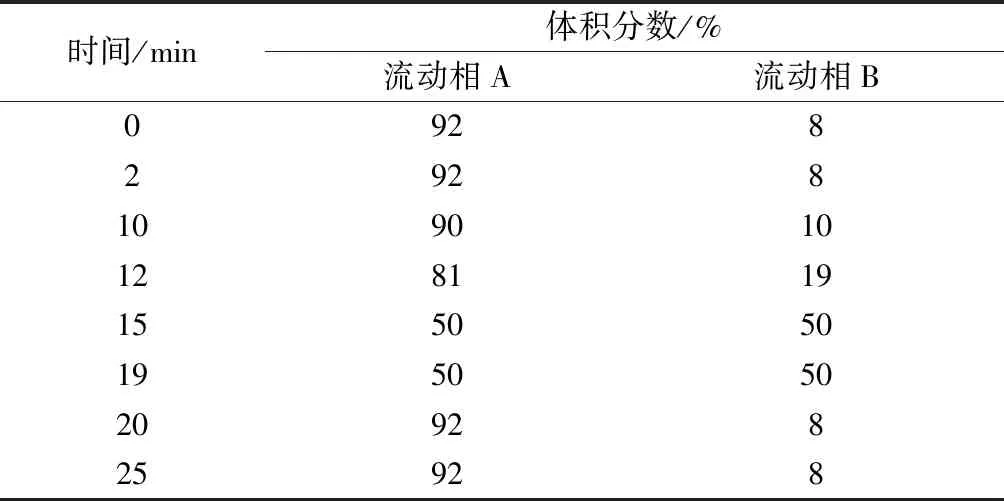
表1 梯度洗脱程序Table 1 Gradient elution procedure of HPLC
2 结果与分析
2.1 酒曲中微生物分离鉴定
2.1.1 细菌分离结果
利用传统分离培养方法从酒曲中分离出10株细菌,其中包括2株乳酸菌。部分细菌菌落及显微镜图片见图1。对细菌菌株进行16S rRNA基因扩增和测序,测序结果在NCBI上用BLAST进行同源性分析,寻找模式菌株16S区基因序列,利用MEGA5构建系统发育进化树,见图2。通过16S rRNA基因系统发育分析得知,酒曲中细菌主要为芽孢杆菌属(Bacillus),以及少量肠球菌属(Enterococcus)。鉴定结果见表2。
a-N1菌落图;b-N41菌落图;c-M29菌落图;d-N1显微图;e-N41显微图;f-M29显微图图1 部分细菌菌落及显微镜检图Fig.1 Partial bacterial colonies and micrograph
表2 酒曲中分离细菌的比对及统计结果Table 2 Comparison and statistical results of isolated bacteria in Wheat Qu
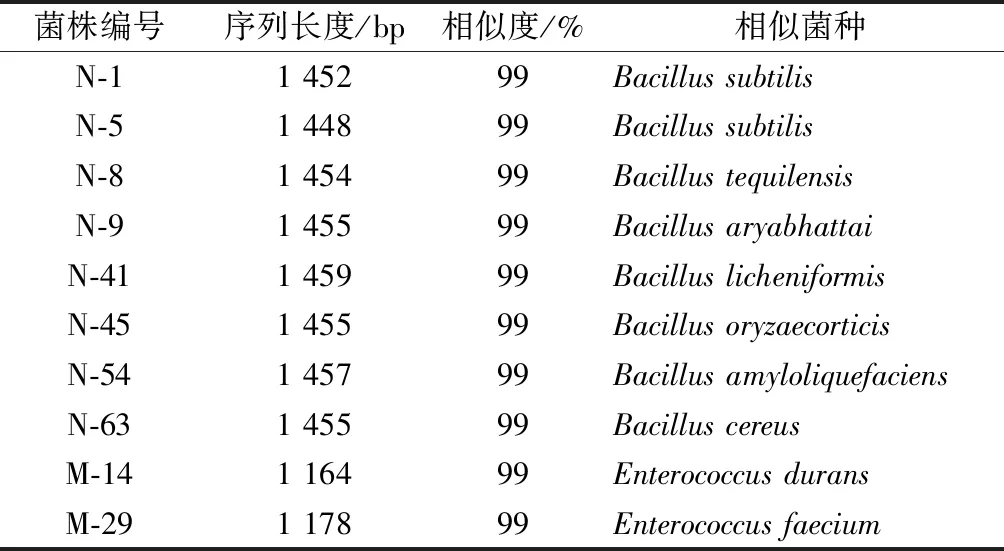
菌株编号序列长度/bp相似度/%相似菌种N-11 45299Bacillus subtilisN-51 44899Bacillus subtilisN-81 45499Bacillus tequilensisN-91 45599Bacillus aryabhattaiN-411 45999Bacillus licheniformisN-451 45599Bacillus oryzaecorticisN-541 45799Bacillus amyloliquefaciensN-631 45599Bacillus cereusM-141 16499Enterococcus duransM-291 17899Enterococcus faecium

图2 细菌系统发育树Fig.2 Phylogenetic relationship of 16SrRNA sequences of bacterial
2.1.2 真菌分离结果
利用分离培养方法从酒曲中共分离出17株真菌,其中有1株酵母菌,部分真菌菌落及镜检图片见图3。分别进行ITS基因扩增和测序,测序结果在NCBI上用BLAST进行比对分析,系统发育树见图4。

a-Z6菌落图;b-P17菌落图;c-Z9菌落图;d-Z6显微图;e-P17显微图;f-Z9显微图图3 部分真菌菌落及显微镜检图Fig.3 Partial fungi colonies and micrograph

图4 真菌系统发育树Fig.4 Phylogenetic relationship of ITS sequences of fungi
通过ITS基因系统发育分析得知,酒曲中真菌有横梗霉属(Lichtheimia)、枝孢菌属(Cladosporium)、曲霉属(Aspergillus)、木霉属(Trichoderma)、根毛霉属(Rhizomucor)、青霉属(Penicillium)、曲霉属(Aspergillus)、毛霉属(Mucor)、复膜孢酵母属(Saccharomycopsis)。鉴定结果见表3。

表3 酒曲中分离真菌的比对及统计结果Table 3 Comparison and statistical results of isolated fungi in Wheat Qu
2.2 酒曲中微生物高通量测序
2.2.1 多样性分析
群落生态学中研究微生物多样性,可以通过单样品的多样性分析(Alpha多样性)反映微生物群落的丰度和多样性。本实验采用稀释曲线(rarefaction curve)及多样性指数(diversity index)分析样本的多样性。本试验对细菌(C1)和真菌(D1)样本所有有效序列数计算后的Shannon指数稀释曲线见图5。

图5 Shannon指数稀释曲线Fig.5 The rarefaction curve of shannon index
对样本有效序列数计算后的多样性指数分析见表4。本实验样本中真菌的chao1指数远大于细菌。说明谢村黄酒酒曲中真菌物种丰富度远高于细菌。试验样本中真菌的Shannon指数与细菌基本一致,同时从Shannon指数稀释曲线可以看出,随着抽样序列数的增多,细菌(C1)和真菌(D1)的Shannon指数趋于稳定。说明其物种的均一性基本相同。实验样本中真菌与细菌的文库覆盖率均较高,说明本次测序结果基本代表样本的真实情况。

表4 多样性指数分析Table 4 The analysis of diversity index
2.2.2 样本群落结构分析
谢村黄酒酒曲属水平群落结构分析见图6。细菌(C1)在属水平上可划分为48个菌属和其他未分类种群,主要包含克罗彭斯特菌属(Kroppenstedtia)、芽孢杆菌属(Bacillus)、乳杆菌属(Lactobacillus)、海洋杆菌属(Oceanobacillus)、嗜酸链霉菌属(Streptacidiphilus)、小球菌属(Pediococcus)、魏斯氏菌属(Weissella)、链霉菌属(Streptomyces)等。其中优势菌属为克罗彭斯特菌属(相对丰度比例为41.6%)、芽孢杆菌属(相对丰度比例为9.23%)、乳杆菌属(相对丰度比例为8.65%)、海洋杆菌属(相对丰度比例为5.51%)。

图6 属水平群落丰度分析Fig.6 The community abundance analysis of the genus level
真菌(D1)在属水平上可划分为18个菌属和其他未分类种群,主要包含耐干霉菌属(Xeromyces)、横梗霉属(Lichtheimia)、根毛霉属(Rhizomucor)、淀粉霉属(Amylomyces)、复膜孢酵母属(Saccharomycopsis)、根霉属(Rhizopus)、毛霉属(Mucor)、曲霉属(Aspergillus)等。其中优势菌属为耐干霉菌属(40.18%)、横梗霉属(22.59%)、根毛霉属(15.35%)、淀粉霉属(11.18%)、复膜孢酵母属(8.47%)。
2.3 酒曲中产GABA菌株筛选结果
将分离纯化得到的菌株经液体发酵后进行适当处理,采用薄层层析法对产GABA菌株进行定性检测。结果发现,有6株能够利用L-谷氨酸钠转化生成产GABA的菌株。挑选能够产GABA的菌株,采用异硫氰酸苯酯柱前衍生高效液相定量检测,通过对比GABA标准品图谱,发现这些样品在相同的时间出现峰值。经计算,菌株合成GABA的量见表5。其中菌株N1的产量最高,达到0.78 g/L。图7、图8为衍生物液相色谱图和标准品液相色谱图,图9为样品N1液相色谱图。
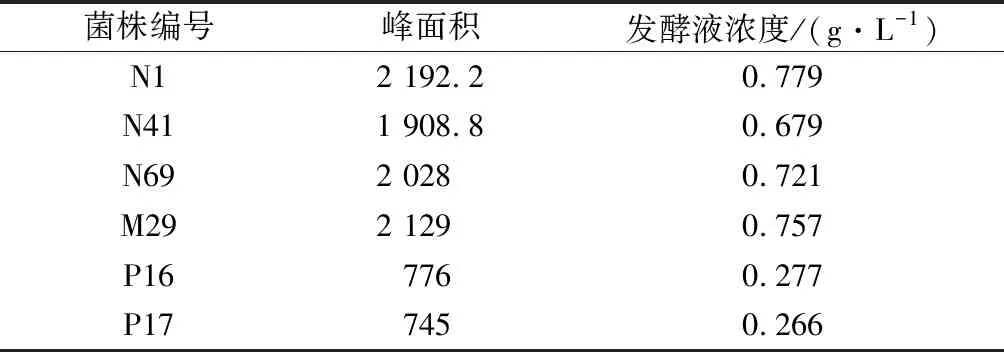
表5 菌株转化GABA产量Table 5 Strain transforming GABA production

图7 衍生物液相色谱图Fig.7 Chromatogram of derivative

图8 GABA标准品液相色谱图Fig.8 Chromatogram of standard GABA sample

图9 菌株N1发酵液液相色谱图Fig.9 Chromatogram of fermentation of N1
3 结果与讨论
利用传统分离培养方法分离出的细菌主要为芽孢杆菌属与肠杆菌属,真菌主要有横梗霉属、枝孢菌属、曲霉属、木霉属、根毛霉属、青霉属、毛霉属及复膜孢酵母属。高通量测序结果表明,酒曲中细菌的优势菌属为克罗彭斯特菌属(41.6%)、芽孢杆菌属(9.23%)、乳杆菌属(8.65%)、海洋杆菌属(5.51%),真菌优势菌属有耐干霉菌属(40.18%)、横梗霉属(22.59%)、根毛霉属(15.35%)、淀粉霉属(11.18%)、复膜孢酵母属(8.47%),以及少量根霉属、毛霉属、曲霉属。真菌的传统分离结果与高通量测序结果较为相符,均检测到横梗霉属、根毛霉属等,但细菌仅分离纯化出芽孢杆菌属,其他菌属的细菌未分离到。因此,分析酒曲微生物的群落结构时,采用2种及多种分析方法能得到更加全面、客观的结果。
通过文献[4,18-20]检索发现,谢村黄酒优势细菌属与南方黄酒相比差异较大,如Kroppenstedtia主要在白酒发酵中检测较多,在黄酒酒曲中未见报道,这可能与酒厂同时进行白酒生产相关,海洋杆菌属在酒曲有较大比例,可能主要来源于水中。而优势真菌属之间差异相对较小。由此可以发现,不同制曲原料及制曲环境对酒曲中微生物多样性至关重要。
为了解酒曲中微生物代谢产生GABA的能力,实验对所纯化的微生物进行液态发酵,采用薄层层析法结合高相液相,对发酵液中GABA浓度进行测定,结果发现芽孢杆菌属、肠球菌属、青霉属、根毛霉属菌株有转化谷氨酸产生GABA的能力。其中芽孢杆菌属N1转化能力最强,发酵液中GABA浓度达0.78 g/L。芽孢杆菌属是酒曲中重要的一类微生物,在黄酒酿造中具有重要作用[21]。菌体在生长过程中能够产生多种酶类,如淀粉酶[22]、蛋白酶、纤维素酶、凝乳酶[23]等,在分解酒曲原料的同时能够产生一些香味物质[4]。因此,芽孢杆菌在黄酒酿造中具有应用潜力,后期研究可以尝试通过强化安全性高的芽孢杆菌来提高酒曲中GABA的含量,以期制备一款富含GABA的谢村黄酒。
酒曲发酵过程中微生物种类繁多,且微生物的生长在动态变化,本研究仅对单一时期的微生物进行了分析,而对于了解谢村黄酒酒曲微生物群落及不同时期微生物的变化情况不够全面和充分。同时,由于对于可培养微生物的分离鉴定不够完善和忽视了不同时期微生物之间的相互作用对微生物产GABA的促进或抑制作用,对于谢村黄酒酒曲中微生物转化产GABA的能力了解的也较为片面。因此在后期的研究中,需对这些问题进行深入研究。
