南极磷虾产低温淀粉酶菌株的筛选、鉴定及酶学性质研究
2019-11-07王文娟刘志东宁喜斌
王文娟,刘志东,宁喜斌,3,4,5*
1(上海海洋大学 食品学院,上海,201306) 2(中国水产科学研究院 东海水产研究所,上海,200090) 3(上海水产品加工及贮藏工程技术研究中心,上海,201306) 4(农业部水产品贮藏保鲜质量安全风险评估试验室(上海),上海,201306) 5(国家淡水水产品加工技术研发分中心(上海),上海,201306)
淀粉酶是水解淀粉和糖原的酶类总称,在动物、植物和微生物中分布广泛,是产量最大、用途最广的酶制剂品种之一[1-3]。目前,淀粉酶已经广泛应用于食品工业、纺织业、造纸业、医药与临床分析等行业[4-5],还有一些潜在的应用包括淀粉加工、废水的处理、生物乙醇的生产、低聚糖混合物的制造等[6]。
然而,当前国内外用于工业生产的淀粉酶大多数是中温淀粉酶或者高温淀粉酶,其最适温度为50 ℃左右。这些酶在温度下降以后,酶活力急剧下降甚至丧失,导致无法在低温下发挥作用。低温淀粉酶的最适作用温度低于30 ℃,与中、高温淀粉酶相比,能在温度很低的情况下保持很大的活性,很大程度地减少了发酵处理的时间,节约了能源。1970年以后,国内、外掀起了对低温淀粉酶的研究热潮[7-8]。
低温淀粉酶来源广泛,在动物、植物、微生物中都有发现,主要来源还是低温微生物。一般低温微生物来源于自然界中的极端环境,如南北极、海底沉积物、冰川、海水、高山、深山洞等。低温淀粉酶在国外研究较早,FELLER等从南极筛选到一株产低温淀粉酶的河豚毒素交替单胞菌(AlteromorlashaloplanetisA23)[9-11],并且在结构和功能方面对AlteromonashaloplanetisA23分泌的低温淀粉酶进行了研究。在0~30 ℃,该菌的淀粉酶活力比来自恒温动物的淀粉酶活力高7倍。20世纪90年代以后,欧美及日本等国家在分子适冷机制、酶分子定向进化、氨基酸序列分析、淀粉酶基因工程菌开发以及应用等方面开展了大量工作。目前已经研究了多种耐冷淀粉酶[12-13],耐冷菌产生的适冷淀粉酶研究最多。国内目前对低温淀粉酶的报道不多,用于工业生产的更是屈指可数。周新尚等[14]从大连海泥和海水中筛选出一株产低温淀粉酶的荧光假单胞菌(Pseudomonasfluorescens),酶活较低,为6.25 U/mL。冯旭明等[15]从大黑山(大连)污泥中筛选出一株低温淀粉酶高产菌株——微小杆菌属(Exiguobacteriumsp.),酶最适反应温度为25 ℃,酶的热稳定性比较差。国内低温淀粉酶的研究还比较浅显,主要集中在菌株的筛选、鉴定、酶学性质和基因等研究[15-17],对其应用和生产还需进一步研究。南极处于地球的最南端,常年被冰雪覆盖,温度处于0 ℃以下,其海洋系统、陆地系统和冰雪环境是低温微生物的重要宝库。南极磷虾作为开发南极海洋生物资源的最主要品种,其能适应南极恶劣的极端环境并大量繁殖,这与其体内微生物的低温适应性机制是分不开的,是低温酶的极好材料。
本试验是从南极原位海水带回的冷冻南极磷虾虾肉中筛选得到低温淀粉酶的高产菌株,对其酶学性质进行了研究。同时,通过在酶的反应体系中添加一定量的Na+和Ca2+,初步提高了低温淀粉酶的热稳定性,解决了低温淀粉酶的热稳定性差这一问题,将为低温淀粉酶的工业生产提供了依据。
1 材料与方法
1.1 试验材料
1.1.1 样品来源
本试验所用的冷冻南极磷虾由中国水产科学研究院东海水产研究所于2014年在南极打捞出并以原位海水冷冻后由雪龙号运回,本实验室取回后置于-80 ℃保存,菌株由冷冻南极磷虾虾肉分离筛选并纯化保存。
1.1.2 主要仪器
CX41RF显微镜,东京奥林匹斯公司;UV-1800PC紫外可见分光光度计,上海美谱达仪器有限公司;高速台式离心机,上海安亭科学仪器厂;高压蒸汽灭菌锅,上海申安医疗器械厂;HWS-24双列四孔恒温水浴锅,上海慧泰仪器制造有限公司;LRH-250CL低温生化培养箱、THZ-300 恒温培养摇床,上海一恒科技有限公司;超净工作台,苏净集团安泰公司;PTC-200PCR仪、GelDocXR凝胶成像仪,Bio-Rad公司。
1.1.3 试剂
蛋白胨、酵母粉、可溶性淀粉、NaCl、CaCl2等均为国产分析试剂;革兰氏染色液试剂盒、DNA提取试剂盒、PCR扩增试剂盒,生工生物工程(上海)有限公司。
1.1.4 培养基和培养条件
初筛培养基(g/L):蛋白胨5,酵母粉1,NaCl 19.45,CaCl21.8,Na2S2O3·5H2O 3.24,琼脂15,可溶性淀粉2,pH 7.0,121 ℃,0.1 MPa灭菌20 min。
复筛培养基(g/L):蛋白胨5,酵母粉1,NaCl 19.45,CaCl21.8,Na2S2O3·5H2O 3.24,可溶性淀粉2,pH 7.0,121 ℃,0.1 MPa灭菌20 min。
种子培养基(g/L):蛋白胨5,酵母粉1,NaCl 19.45,CaCl21.8,Na2S2O3·5H2O 3.24,pH 7.0,121 ℃,0.1 MPa灭菌20 min。
发酵培养基:同复筛培养基。
1.2 试验方法
1.2.1 产淀粉酶菌株的初筛
将冷冻南极磷虾用酒精棉擦拭表面后放于无菌取样袋中,并置于超净工作台自然解冻。取解冻的南极磷虾于无菌研钵中研磨均匀,并称取2 g研碎的南极磷虾样品,加入20 mL已高压蒸汽灭菌的无菌蒸馏水,然后剧烈振荡10 min后取上清液于已灭菌的生理盐水中进行梯度稀释,依次得到10-2、10-3、10-4、10-5梯度的稀释液,每个梯度做3个平行,各取不同梯度的稀释液100 μL于初筛平板培养基上均匀涂布,在低温生化培养箱中于25 ℃倒置培养72 h喷洒碘液在平板上,观察菌落周围的透明圈大小。选取菌落周围透明圈大的菌株进一步四区划线纯化,并接种于斜面保藏。
1.2.2 产淀粉酶菌株的复筛
将初筛得到的菌种接种到装液量为100 mL/250 mL的复筛培养基中复筛,在恒温摇床中以25 ℃,120 r/min培养48 h后作为发酵液待测酶活。
酶活的测定:采用3,5-二硝基水杨酸(DNS)法测酶活(以葡萄糖做标准曲线)
取发酵液1.5 mL在4 ℃,10 000 r/min条件下离心10 min,取上清液做粗酶液待测酶活力。取1 mL稀释酶液在25 ℃下水浴保温5 min后滴加1 mL 20 g/L的淀粉溶液,将混合液在25 ℃下水浴保温10 min,然后滴加2 mL DNS试剂,在沸水中保温5 min,冷却至室温后定容至25 mL,置于540 nm处比色[18]。
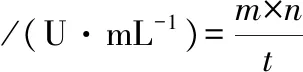
(1)
式中:m,葡萄糖质量,mg;n,酶液稀释倍数;t,反应时间,min。
酶活定义:在一定反应条件下,1 min反应生成1 mg葡萄糖的酶量定义为1个酶活单位。
1.2.3 菌株鉴定
1.2.3.1 形态学观察
将产酶菌株在初筛培养基上进行四区划线分离纯化,于低温生化培养箱中25 ℃培养48 h后,观察菌落形态。挑取单菌落做革兰氏染色试验,并观察其菌体形态。
1.2.3.2 生理生化鉴定
根据参考文献[19,20]进行生理生化试验,主要包括氧化酶试验、水解淀粉试验、反硝化、脂酶、脓青素、明胶液化、果糖、葡萄糖利用等。
1.2.3.3 16S rRNA基因序列测序和分析
将试验菌株接种于发酵培养基中于25 ℃下培养18 h,按照细菌总DNA提取试剂盒的说明书操作,提取细菌总DNA为模板DNA。扩增16S rRNA基因所用的引物为细菌16S rRNA通用引物:27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-TACCTTGTTACGACTT-3′)。
PCR反应体系(50 μL)包括:5 μL 2×TaqPCR Mix 2,20 μL Sterilized ddH2O,1 μL DNA模板,2 μL 10 μmol/L的上下游引物各。
PCR扩增条件为:94 ℃,预变性5 min;94 ℃,变性1 min;57 ℃,退火1 min; 72 ℃,延伸10 min,按上述条件循环30次后4 ℃保存。取5 μL PCR产物进行1.5%的琼脂糖凝胶电泳,用凝胶成像仪观察清晰明亮的条带,剩余的PCR产物送到上海生工生物技术工程有限公司基因测序,获得的序列提交GenBank数据库,进行BLAST基因序列比对。通过Mega 5.2用邻接法构建系统发育树[21]。
1.2.4 酶学性质
1.2.4.1 菌株A5-2的生长曲线和产酶曲线的测定
取125 mL/250 mL菌液于发酵培养基中,在25 ℃,120 r/min条件下每隔6 h测定一次淀粉酶活性和OD600,每个样品做3个平行,绘制菌株的生长曲线和产酶曲线。
1.2.4.2 反应温度对酶活的影响
分别测定粗酶液在4、15、20、25、30、40、50、60、70和80 ℃不同温度下的酶活性,以确定其最适反应温度[8]。
1.2.4.3 反应pH值对酶活的影响
分别测定粗酶液在pH值3.0、4.0、5.0、6.0、7.0、8.0、9.0和10.0的柠檬酸缓冲液中的酶活性,以确定其最适反应pH[22]。
1.2.4.4 金属离子对酶活力的影响
在酶的反应体系中分别加入10 μL 0.01 mol/L的K+、Na+、Ca2+、Mg2+、Cu2+、Fe2+、Mn2+7种金属离子,以不加金属离子为对照组,测量各组的酶活力。
1.2.4.5 酶的热稳定性
将1 mL酶液分别在20、30、40、50、60和70 ℃,6个温度条件下依次水浴保温10、20、30、40、50 min,然后冷却到室温,定容到25 mL,测酶活。各保温时间下所测得的酶活与不保温所测得的酶活(记为100%)相比计算相对酶活,绘制酶的热稳定性曲线[23]。
1.2.4.6 Ca2+和Na2+对酶热稳定性的影响
在酶的反应体系中分别加入10 μL 0.01 mol/L的Na+、Ca2+、10 μL 0.01 mol/L的Na+和Ca2+混合物(Na+、Ca2+各5 μL),并以不加金属离子为对照组,依次在50 ℃下水浴保温,与不放在水浴中保温的酶活相比,每10 min测一次相对酶活力[24-25]。
2 结果与分析
2.1 淀粉酶产生菌的筛选结果
通过初筛,共筛选出11株产淀粉酶菌株,再经复筛选出1株淀粉酶高产菌株,编号为A5-2,酶活力值为163.73 U/mL。
2.2 菌种鉴定
2.2.1 形态学结果
菌株A5-2在2 216E琼脂平板上25 ℃培养48 h后,菌落呈橙黄色,不透明,圆形隆起,边缘整齐,无褶皱。革兰氏染色为阴性,菌体呈球杆状。
2.2.2 菌株生理生化鉴定
对菌株A5-2进行生理生化特性研究,结果如表1所示。

表1 菌株A5-2的生理生化特征Table 1 Physiological and biochemical characteristics of strain A5-2
注:+为阳性,-为阴性
2.2.3 16S rRNA鉴定结果
菌株A5-2的16S rRNA基因的PCR产物进行1.5%琼脂糖凝胶电泳后,电泳条带如图1所示,1 500 bp处条带清晰。

M-Marker(dl2000),1-菌株A5-2图1 菌株A5-2的PCR特异性条带Fig.1 The electrophoresis map of PCR product of strain A5-2
菌株A5-2的16S rRNA基因序列拼接后提交GenBank数据库,进行BLAST序列比对。通过Mega 5.2用邻接法构建的系统发育树如图2所示。

图2 A5-2的16S rRNA基因序列系统发育树Fig.2 Phylogenetic tree of the A5-2 on partial 16S rRNA gene sequences
由图2可知,A5-2与假单胞菌(Pseudomonassp.)的16S rRNA基因序列自然聚类。A5-2与乳酸假单胞菌PseudomonaslactisDSM 29167聚集在同一支,且同源性为100%,判定属于同一种。根据A5-2的形态特征、生理生化鉴定结果,以及A5-2的16S rRNA基因序列的系统发育树,将A5-2鉴定为乳酸假单胞菌(Pseudomonaslactis),命名为PseudomonaslactisA5-2。该种是假单胞菌属(Pseudomonassp.)中新发现的种,2 017年6月第1次由NEUBECK等[26]从牛原料乳中分离得到。
2.3 A5-2淀粉酶的酶学性质
2.3.1 葡萄糖标准曲线的制作
根据标准方法,绘制的葡萄糖标准曲线,线性回归方程为y=0.483 6x+0.010 8,线性相关性R2=0.999 2,说明线性非常好。
2.3.2 A5-2的生长曲线和产酶曲线
菌液在发酵培养基中于25 ℃,120 r/min恒温摇床中培养,每6 h测1次酶活和生物量,结果如图3。

图3 A5-2的生长曲线和产酶曲线Fig.3 The growth curve and enzyme production curve of A5-2
由图3的生物量曲线可知,菌株A5-2从培养6 h开始,菌体数量增长迅速,但24 h后增长缓慢并趋于稳定,90 h后菌体开始走向衰亡。而产酶活性出现在菌株培养12 h后,产酶活性随着菌株的快速增长而渐渐增强,菌株生长缓慢并趋于稳定后,产酶活性也基本趋于稳定并有缓慢增长,菌体开始衰亡以后,产酶活性也逐渐下降。菌株生长曲线的趋势和产酶曲线的趋势,大致保持相同,说明菌株所产的酶可能只存在于发酵上清液中,随着菌体的自溶,并没有其他酶产生[27]。相比ZHANG等[28]从南极分离的产低温淀粉酶耐冷菌(Nocardiopsissp.)7 326在20 ℃下需培养120 h产酶才达到最高,该菌株产酶周期短,在工业应用中具有很大的优势。
2.3.3 温度对酶活的影响
按照上述试验方法,在不同的温度中测淀粉酶的酶活,以酶活为纵坐标,温度为横坐标,作温度-酶活关系曲线图,如图4所示。
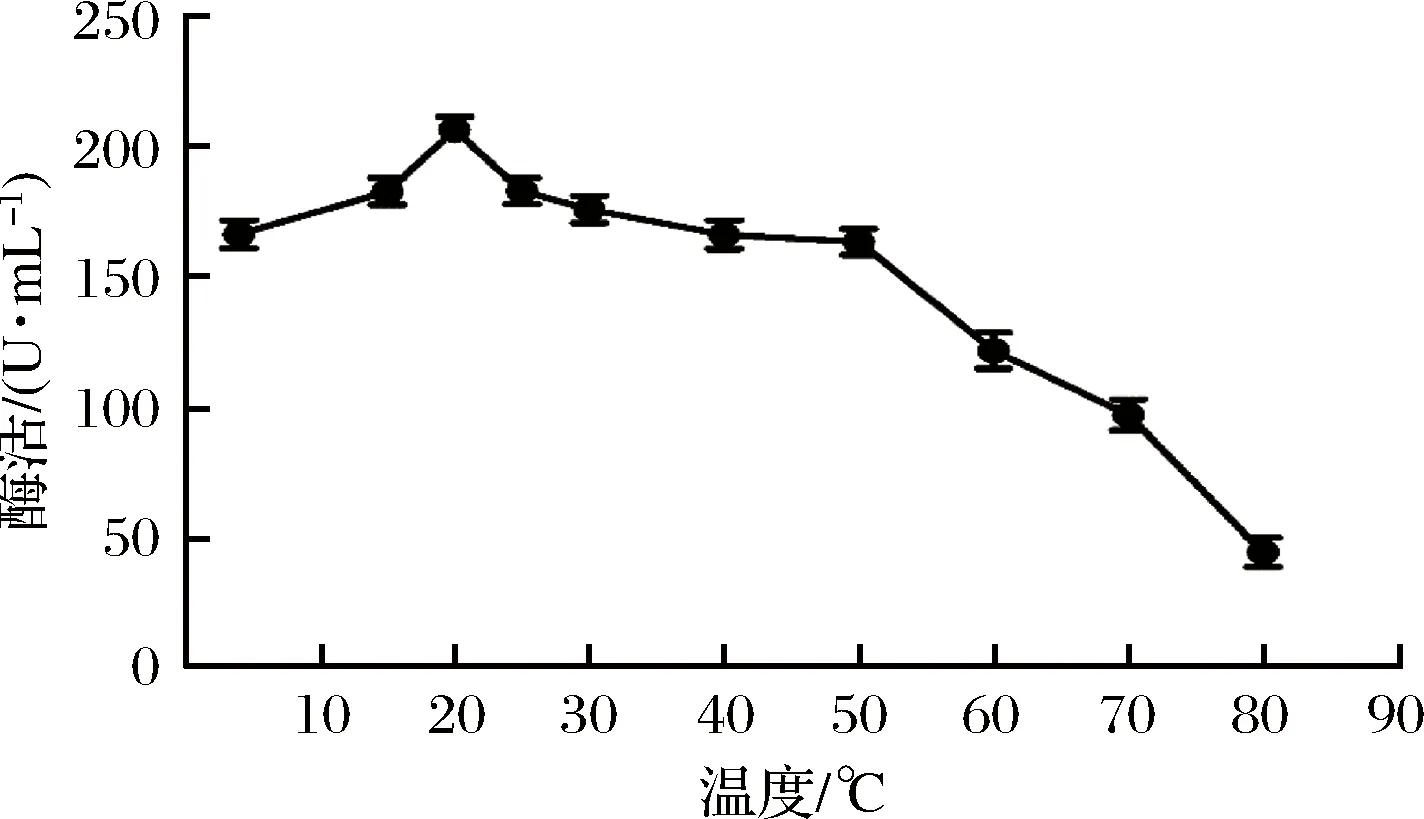
图4 反应温度对酶活的影响Fig.4 Effect of operating temperature on enzyme activity
由图4可知,当反应温度在4~20 ℃范围内,酶活逐渐升高,且酶活都在最高酶活的75%以上。温度高于20 ℃,酶活开始下降,尤其是50 ℃以后,酶活急剧下降,在80 ℃,酶活仅保留21%。所以,20 ℃是该淀粉酶的最适反应温度,菌株A5-2所产淀粉酶属于典型的低温淀粉酶,该酶的最适反应温度比WANG等[29]从南极海冰中筛选出的假交替单胞菌(Alteromonasbaumann)所产低温淀粉酶的最适反应温度(30 ℃)更低,在工业应用上可以节省很多能源,缩短发酵周期。
2.3.4 反应pH值对酶活的影响
粗酶液在不同pH值的柠檬酸盐缓冲液下,酶活力大小如图7所示。
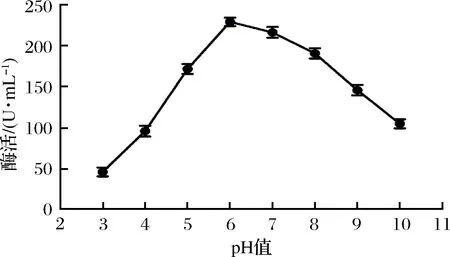
图5 反应pH对酶活的影响Fig.5 Effect of operating pH on enzyme activity
由图5可以看出,当pH在3.0~6.0时,随着pH值的增大,淀粉酶活力随之升高,当pH大于6.0时,淀粉酶活力急剧下降,表明该淀粉酶的最适pH值为6.0,属于弱酸性酶。
2.3.5 金属离子对酶活力的影响
本试验以不加金属离子的酶反应体系作对照,测定不同的金属离子对酶活力的影响,结果如图6所示。Fe3+、Cu2+和Mn2+对酶有不同程度的抑制作用,K+、Mg2+、Ca2+和Na+对酶有不同程度的激活作用,其中Cu2+对酶的抑制作用最强,抑制了80%的酶活性。Na+对酶的激活效果最强,酶活约为空白对照的1.7倍。可能是Cu2+、Fe3+和Mn2+等离子可以与蛋白的作用区域结合,从而抑制酶的活性。这与其他微生物来源的低温淀粉酶特性一致[30]。

图6 金属离子对酶活的影响Fig.6 Effect of metal ions on enzyme activity
2.3.6 酶的热稳定性
以不保温所测得的酶活为对照组,其他温度下所测得的酶活与其相比计算得到相对酶活,用相对酶活绘出酶的热稳定性曲线,10 min测一次,共测50 min,计5次(图7)。
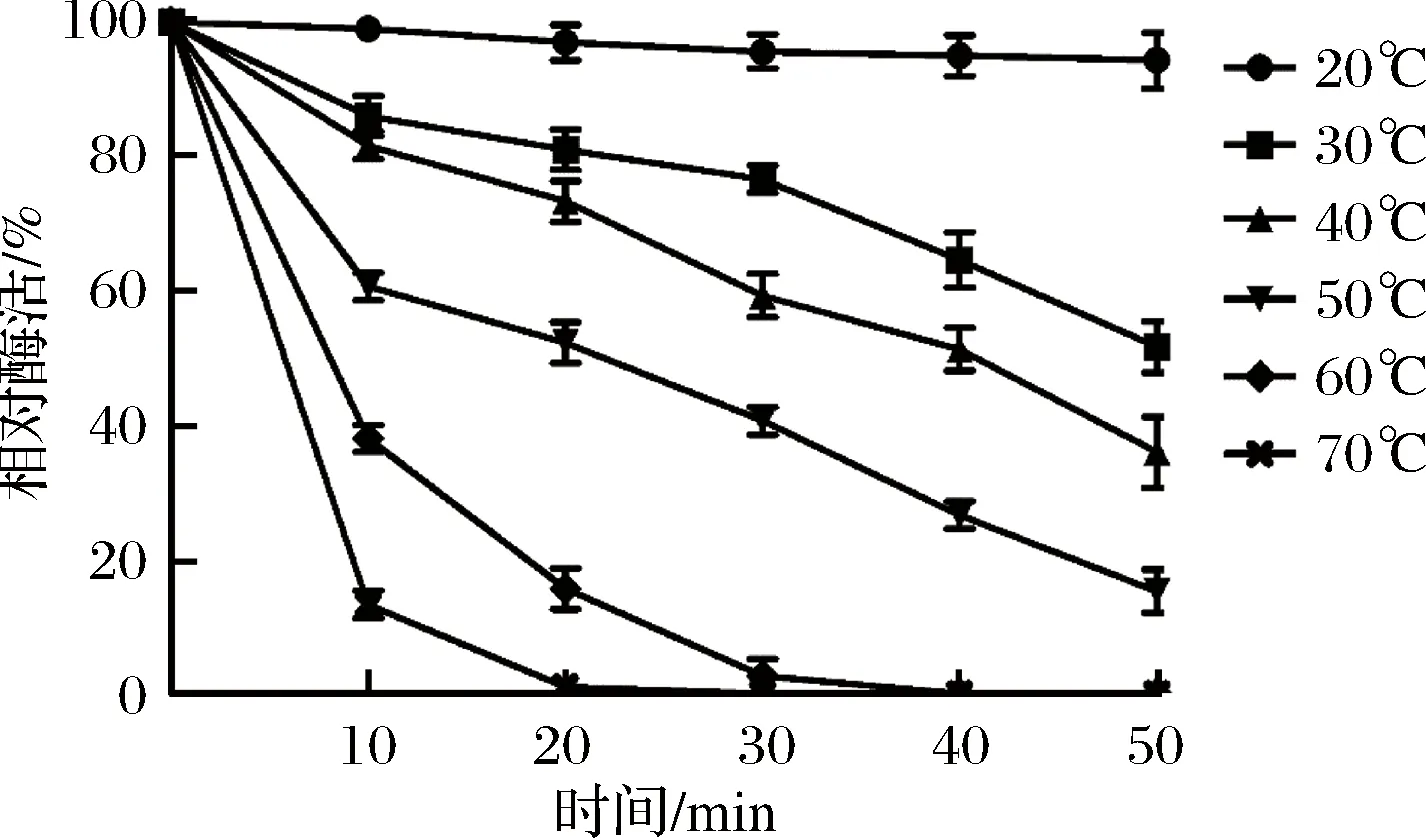
图7 酶的热稳定性Fig.7 Thermal stability of the enzyme
由图7可知,该酶在20 ℃保温50 min依然保持95%以上的酶活性,稳定性极好,在30 ℃下保温20 min,保留80%的酶活性,保温50 min,保留了50%的酶活性。50 ℃保温20 min,酶活丧失50%,60 ℃保温20 min,酶活保留18%,70 ℃保温10 min后酶活几乎为0。范红霞等[31]从南极土壤分离的南极微球菌(Micrococcusantarcticus)产的低温淀粉酶在60 ℃温浴20 min后酶活完全丧失。本试验所产的低温淀粉酶的热稳定性相对较好,但也符合低温酶稳定性差的性质,酶的热稳定性有待进一步的提高。
2.3.7 Ca2+和Na2+对酶热稳定性的影响
本试验以未加金属离子的酶液反应体系作为对照组,测定在反应体系中加入Na+、Ca2+以及Na+和Ca2+的混合物对酶热稳定性的影响,结果如图8所示。

图8 金属离子对酶的热稳定性的影响Fig.8 Effect of metal ions on the thermal stability of enzyme
由图8与图7对比可知,在酶液体系加入Na+以后,在50 ℃保温35 min,酶活保留50%,相比于不加Na+的酶液体系保温20 min,酶活保留50%,延长了15 min的半衰期,加入Ca2+以后,酶进入半衰期的时间为40 min,同时加入Na+和Ca2+,酶的半衰期延长至80 min,是不加金属离子的4倍,可能是加了Na+和Ca2+改变了酶的二级结构,从而提高了酶的热稳定性。
3 结论
本试验从冷冻南极磷虾虾肉中筛选出1株产低温淀粉酶的菌株,经形态特征、生理生化和16S rRNA鉴定为乳酸假单胞菌,命名为PseudomonaslactisA5-2,该种是假单胞菌属(Pseudomonassp.)中的新发现的种,2017年6月第1次由NEUBECK等[27]从牛原料乳中分离得到。
PseudomonaslactisA5-2产淀粉酶的酶活力为218.53 U/mL,该淀粉酶的酶学性质表明,最适反应温度为20 ℃,最适反应pH值为6.0,属于典型的弱酸性低温淀粉酶。K+、Na+、Mg2+和Ca2+对酶有不同程度的激活作用,其中Na+对酶的激活效果最强,Cu2+、Fe3+和Mn2+对酶有不同程度的抑制作用。该酶在30 ℃以下能保持较长时间的稳定,在50 ℃保温20 min,酶活力仅保留50%,在酶的反应体系中分别加入Na+、Ca2+和Na+、Ca2+混合物后,酶进入半衰期的时间分别为保温35、40和80 min,同时加入Na+和Ca2+后,酶的半衰期是不加金属离子的4倍,可能是Na+和Ca2+改变了酶的二级结构从而提高的酶的热稳定性。
本试验研究的低温淀粉酶能很好地适应低温和偏酸性的环境,并初步提高了酶的热稳定性,为以后该酶的分离纯化以及工业生产和应用提供了依据[32-34]。
