鸭油对D-gal诱导小鼠氧化应激的改善作用
2019-11-07龙霞黄先智丁晓雯
龙霞,黄先智,丁晓雯*
1(西南大学 食品科学学院,重庆市农产品加工重点实验室,重庆,400716) 2(西南大学 科技处,重庆,400715)
活性氧(reactive oxygen species,ROS)是以羟自由基、超氧阴离子、单线态氧等为主的高活性含氧原子或基团[1],其源于吸烟、污染、紫外照射等外源因素[2]或线粒体呼吸链[3]、过氧化氢酶体系[4]、烟酰胺腺嘌呤二核苷酸体系[5]等内源因素。正常情况下,机体有酶类如超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化氢酶(glutathione peroxidase,GPx)、过氧化氢酶、硫氧化蛋白还原酶等和非酶如谷胱甘肽、Ve、金属硫蛋白(metallothionein,MT)、硫氧还蛋白(thioredoxin,Trx)等抗氧化系统使ROS的产生和消除维持平衡[1]。但当体内氧化与抗氧化作用失衡时,机体会累积过多的ROS,积累的ROS会攻击脂质、蛋白质、DNA等生物大分子,使之发生氧化损伤,从而导致机体出现氧化应激。研究发现,诸如癌症[6]、糖尿病[7]、心血管病[8]、神经退行性疾病等慢性病均与氧化应激有关,改善机体氧化应激已成为缓解这些慢性病的有效途径。目前,已证实有许多物质能改善氧化应激,如黄酮类、多酚类、多糖类、磷脂、不饱和脂肪酸等。
鸭油是从鸭的屠宰副产物(如腹部脂肪组织、肝脏、皮下组织)中经提取、精炼而成的脂类,其不饱和脂肪酸含量可达70.30%,以油酸、亚油酸、亚麻酸为主[9-12]。现有研究表明油酸、亚油酸[13]、亚麻酸[14]均可改善机体的氧化应激,含有这些成分的鹅油能使小鼠的总抗氧化能力提高73.95%[15],使卵巢切除大鼠的总抗氧化能力提高19.36%[16]。目前,关于鸭油的研究主要集中于摄食与鸭油脂肪酸构成的关系,还没有相关研究报道含有较高不饱和脂肪酸的鸭油是否能在体内改善氧化应激。本实验室的前期研究发现,鸭油在体外具有DPPH·清除能力、铁还原能力、氧自由基吸收能力,能抵制脂质、DNA的氧化应激。
本实验通过给小鼠注射D-半乳糖(D-galactose,D-gal)建立氧化应激模型,然后喂饲一定剂量的鸭油,一段时间后,测定小鼠血浆的总抗氧化能力、抗氧化相关酶(SOD、GPx)、抗氧化物质(MT、Trx)、脂质氧化产物8-异前列腺素(8-iso-prostaglandin F2α,8-iso-PGF2α)、蛋白质氧化产物蛋白质羰基(protein carbonyl,PCO)、3-硝基酪氨酸(3-nitrotyrosin,3-NT)、晚期蛋白氧化产物(advanced oxidation protein products,AOPP)、DNA氧化产物8-羟基脱氧鸟苷(8-hydroxydeoxyguanosine,8-OHdG)、5-羟基胞嘧啶(5-hydroxymethylcytosine,5-hmC)及DNA修复酶8-氧鸟嘌呤DNA糖苷酶(8-oxoguanine DNA glycosylase 1,OGG1)、8-羟基鸟嘌呤核苷酸酶1(8-oxoguanine nucleoside triphosphatase,MTH1)活性,研究鸭油对已经发生氧化应激作用小鼠体内脂肪、蛋白质、DNA是否具有改善作用以及作用的初步机理,为鸭油的深入开发利用提供理论依据。
1 材料与方法
1.1 动物、材料与试剂
雄性4周龄SPF级昆明种小鼠80只,重庆医科大学实验动物中心提供,许可证号:SCXK (渝)2018-0003。分笼适应性饲养1周,自由摄食、饮水。饲养环境温度(23±2)℃,相对湿度40%~60%,12 h明暗轮换。
D-半乳糖、还原型谷胱甘肽(reduced glutathione,GSH),上海阿拉丁生化科技股份有限公司;羧甲基纤维素钠(食品级,纯度>99%),杭州普修生物科技有限公司;酪蛋白酸钠,上海麦克林生物科技有限公司;叔丁基对苯二酚(tertiary butylhydroquinone,TBHQ),纯度98%,南京道斯夫生物科技有限公司;总抗氧化能力、总超氧化物歧化酶、谷胱甘肽过氧化氢酶、硫氧还蛋白、金属硫蛋白、8-异前列腺素、蛋白质羰基、3-硝基酪氨酸、晚期蛋白氧化产物、8-羟基脱氧鸟苷、5-羟甲基胞嘧啶、8-羟基鸟嘌呤DNA糖苷酶、8-羟基鸟核苷酸酶试剂盒,上海优选生物科技有限公司。
鸭油:实验室自制。鸭油富含不饱和脂肪酸,在提取、精炼过程中易被氧化,因此从鸭油的提取开始加入抗氧化剂。根据本实验室前期研究,加入TBHQ(添加量为鸭油质量的0.015%)作为鸭油抗氧化剂的效果最好。
不同浓度的鸭油乳液的配制:用含2.5%乳化剂(65%酪蛋白酸钠、6%羧甲基纤维素钠、29%吐温-80)的蒸馏水将制备的鸭油配成质量浓度分别为62.5、125、250 mg/mL的鸭油乳液[17]。
1.2 仪器与设备
Symergy H1酶标仪,美国伯腾仪器有限公司;5811 DK离心机,Eppendorf AG; DHP-9082电热恒温培养箱,上海文欣科学仪器有限公司;FM200高剪切分散乳化机,上海弗鲁克林机械制造有限公司;85-2恒温磁力搅拌器,金坛市华欧试验仪器厂;XW-80A微型旋涡混合仪,上海沪西仪器厂有限公司;肝素钠采血管,江苏宇力医疗器械有限公司;JA2003A电子天平,上海精天电子仪器有限公司;DW-HL438超低温冰箱,合肥美菱股份有限公司。
1.3 试验方法
1.3.1 动物分组及饲养
小鼠适应性饲养7 d后随机分为正常组、D-gal对照组、GSH组、溶剂对照组、鸭油低、中、高剂量组、纯鸭油组,每组10 只。正常组连续腹腔注射生理盐水21 d(注射量为0.1 mL/10 g),21 d后灌胃生理盐水;其余各组连续21 d腹腔注射1 000 mg/(kg·BW)的D-gal(用生理盐水将D-gal配制成100 mg/mL的溶液,灌胃量为0.1 mL/10 g),21 d后,模型组灌胃生理盐水(0.1 mL/10 g);阳性组灌胃200 mg/(kg·BW) GSH;溶剂对照组灌胃1.5 mg/(kg·BW) 的TBHQ(用配制鸭油的溶剂配制,其量与鸭油中的一致);鸭油低、中、高剂量组分别灌胃625、1 250、2 500 mg/(kg·BW)鸭油乳液;纯油组用不含TBHQ的2 500 mg/mL的鸭油灌胃,连续45 d。
1.3.2 实验样本的收集与氧化应激指标的检测
末次灌胃后禁食不禁水12 h,眼球取血,将血液于3 000 r/min 4 ℃条件下离心10 min,取上层血浆于-80 ℃保存备用。
按照试剂盒说明书的步骤检测总抗氧化能力、总超氧化物歧化酶、胱甘肽过氧化氢酶、硫氧还蛋白、金属硫蛋白、8-异前列腺素、蛋白质羰基、3-硝基酪氨酸、晚期蛋白氧化产物、8-羟基脱氧鸟苷、5-羟甲基胞嘧啶、8-羟基鸟嘌呤DNA糖苷酶1、8-羟基鸟核苷酸酶1。
1.4 数据统计与分析
2 结果与分析
2.1 鸭油对小鼠血浆中总氧化能力及抗氧化酶活力的影响
酶系统和非酶类系统都是机体的抗氧化系统,构成机体总的抗氧化水平,可用总抗氧化能力T-AOC评价,T-AOC越高,机体总抗氧化能力越强[18]。酶系统中的SOD能催化超氧阴离子生成氧和过氧化氢,维持机体内ROS稳态[19]。GPx能降解ROS,保护细胞免于氧化损伤[20-21]。SOD、GPx是评价机体抗氧化性的常见指标,这2种酶的活性越高,表明机体的抗氧化能力越强。不同实验组小鼠血浆的T-AOC、T-SOD、GPx活性的结果见表1。
由表1可知,与正常组相比,D-gal对照组小鼠的T-AOC、T-SOD、GPx分别下降29.79%、25.58%、31.20%,且均显著低于正常组,表明注射D-gal后会降低小鼠的抗氧化能力、抗氧化酶活性,说明造模成功。与D-gal对照组相比,GSH组小鼠的T-AOC、T-SOD、GPx较模型组分别升高36.89%、39.49%、45.24%,与正常组差异不显著,表明GSH能较好提高已发生氧化应激小鼠的总抗氧化能力及抗氧化酶活性,且能恢复至正常水平;溶剂对照组的T-AOC、GPx虽然比D-gal对照组有所升高,但差异不显著,表明溶剂不能提高小鼠的抗氧化酶活性。低、中、高剂量鸭油组、纯鸭油组分别使T-AOC提高7.07%、16.78%、23.08%、19.07%,其中高剂量鸭油、纯鸭油的T-AOC显著高于D-gal对照组,但仍显著低于正常组和GSH组,表明鸭油对T-AOC的影响有剂量-效应关系,且达到一定剂量后能显著提高小鼠总抗氧化能力,但是在实验剂量的范围内,未能使之恢复到正常水平。与D-gal对照组比,低、中、高剂量鸭油、纯鸭油能使小鼠血浆中的T-SOD活性分别提高11.87%、29.12%、30.93%、23.76%,且差异显著,表明灌胃鸭油后能提高已发生氧化应激小鼠的T-SOD活性;其中高剂量的T-SOD活性与正常组差异不显著,表明给已发生氧化应激小鼠灌胃高剂量鸭油后,能使其T-SOD活性恢复至正常水平。与D-gal对照组比,低、中、高剂量组鸭油、纯鸭油能使小鼠血浆的GPx活性分别提高20.36%、23.23%、24.14%、23.76%,其中低剂量组的GPx与D-gal对照组差异不显著,其余各组均显著高于D-gal对照组,但显著低于GSH组和正常组,表明鸭油能提高氧化应激小鼠血浆的GPx活性,但尚未恢复至正常水平。高剂量组小鼠血浆的T-AOC、T-SOD、GPx均高于纯鸭油组,但差异不显著,表明鸭油中加入的TBHQ可能没有提高鸭油的抗氧化性的作用。
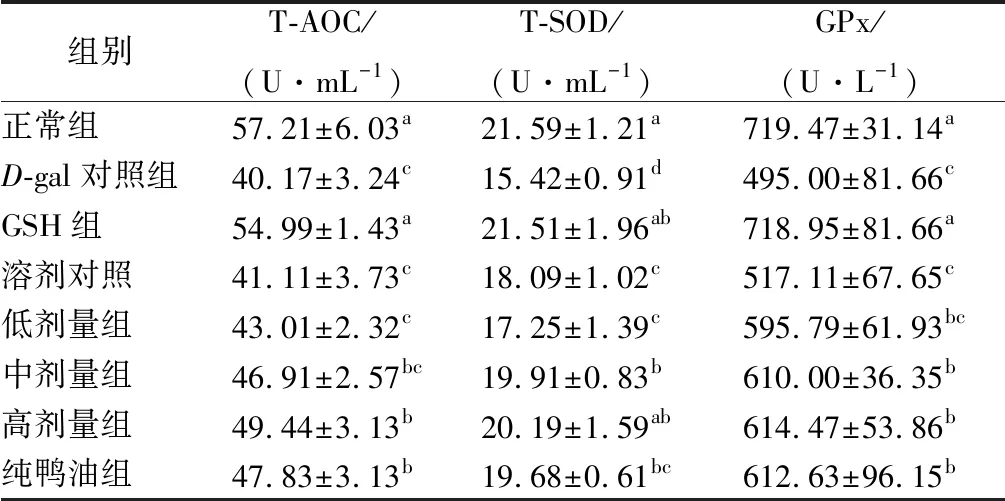
表1 不同实验组小鼠血浆的T-AOC、T-SOD、GPx活性(n=10)Table 1 Total antioxidant capacity, T-SOD and GPx activity in plasma of different groups of mice
注:同列肩字母不同,表示同一指标间差异显著,P<0.05;同列有相同肩字母,表示同一指标差异不显著,P>0.05。下同。
2.2 鸭油对小鼠血浆中抗氧化物质的影响
金属硫蛋白(MT)是低分子质量蛋白质,可抑制氧化应激保护细胞免受氧化损伤[22]。硫氧还蛋白(Trx)是机体内硫氧还蛋白氧化还原系统的重要组成物,过多的ROS会抑制硫氧还蛋白还原酶的活性,使Trx含量减少[23-24]。不同组小鼠血浆中的抗氧化物质MT、Trx含量见图1。
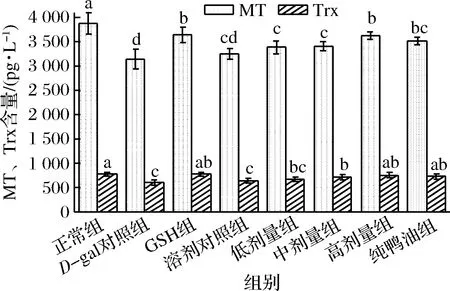
图1 不同实验组小鼠血浆中MT、Trx的含量(n=10)Fig.1 Contents of MT and Trx in plasma of different groups of mice注:同一指标不同组之间字母不同,表示差异显著(P<0.05);有相同字母,表示差异不显著(P>0.05),下同。
由图1可知,与正常组相比,D-gal对照组小鼠的MT、Trx含量分别降低了18.89%、21.82%,且差异显著,表明注射D-gal后会使小鼠血浆中的抗氧化物质含量降低。与D-gal对照组相比,GSH组小鼠血浆的MT、Trx含量分别升高19.97%、27.00%,显著高于D-gal对照组,其中Trx含量与正常组差异不显著,表明灌胃GSH后,能使已发生氧化应激小鼠血浆的抗氧化物质含量恢复至正常水平;溶剂对照组小鼠血浆的MT、Trx含量虽高于D-gal对照组,但差异不显著,表明溶剂不能提高已发生氧化应激小鼠血浆的抗氧化物质含量。与D-gal对照组相比,低、中、高剂量组鸭油、纯鸭油组小鼠血浆的MT含量分别升高7.87%、8.51%、17.70%、11.97%,均显著高于D-gal对照组,但显著低于正常组,表明灌胃鸭油后,虽能提高已发生氧化应激小鼠血浆的MT含量,但尚未恢复至正常水平。与D-gal对照组相比,低、中、高剂量组鸭油、纯鸭油组小鼠血浆的Trx含量分别升高9.91%、17.80%、24.13%、20.15%,其中低剂量组与D-gal对照组差异不显著,中剂量显著高于D-gal对照组,但显著低于正常组,高剂量、纯油组与正常组差异不显著,表明鸭油可以提高已发生氧化应激小鼠血浆的Trx含量,且有剂量效应关系,达到一定剂量后能使Trx含量恢复至正常水平。高剂量的MT、Trx含量均高于纯鸭油组,但差异不显著,表明向鸭油中加入的TBHQ可能不会增强鸭油提高小鼠血浆中抗氧化物质含量的能力。
2.3 鸭油对小鼠血浆脂质氧化产物含量的影响
ROS损伤细胞膜脂质花生四希酸,使其发生脂质过氧化而形成稳定的终末产物8-异前列腺素(8-iso-PGF2α)[25]。8-iso-PGF2α已被建议作为氧化应激的新指标,并且是目前用于量化氧化应激的最准确和可靠的方法[26-27],其含量越高,表示机体的脂质氧化损伤越严重。不同组小鼠血浆中的8-iso-PGF2α见图2。
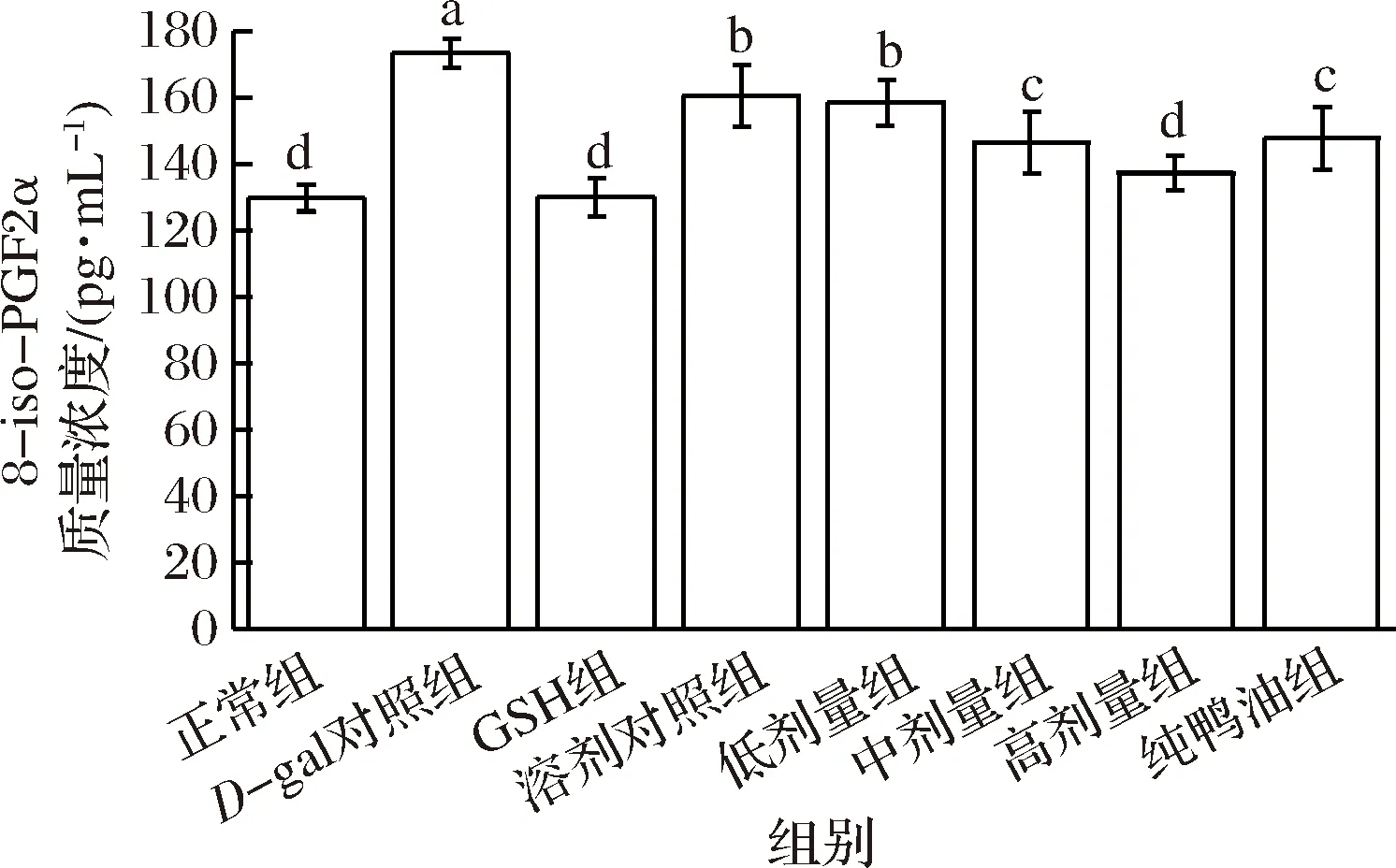
图2 不同实验组小鼠血浆中8-iso-PGF2α的含量(n=10)Fig.2 The content of 8-iso-PGF2α in plasma of different groups of mice
从图2可知,与正常组相比,D-gal对照组小鼠的8-iso-PGF2α含量升高了33.64%,且差异显著,表明注射D-gal后,小鼠血浆中的脂质氧化产物显著升高。与D-gal对照组相比,GSH组的8-iso-PGF2α含量下降25.03%,与正常组的差异不显著,表明灌胃GSH后能有效改善已发生氧化应激小鼠的脂质氧化,并恢复至正常;溶剂对照组的8-iso-PGF2α含量下降7.41%,显著低于D-gal对照组,表明溶剂具有一定改善已发生氧化应激小鼠脂质氧化的能力;低、中、高剂量鸭油组、纯鸭油组小鼠血浆的8-iso-PGF2α含量分别下降8.62%、15.55%、20.88%、14.80%,均显著低于D-gal对照组,其中高剂量组与正常组差异不显著,低、中、高之间差异显著,表明鸭油能改善已发生氧化应激小鼠的脂质氧化损伤,且有一定剂量效应关系,达到一定剂量后能使8-iso-PGF2α含量恢复至正常水平。高剂量组的8-iso-PGF2α含量显著低于纯鸭油组,表明加入鸭油的TBHQ可能会增强鸭油的抗脂质氧化能力。
2.4 鸭油对小鼠血浆蛋白质氧化产物含量的影响
ROS攻击蛋白质分子的脯氨酸、精氨酸、赖氨酸等侧链氨基酸,均可氧化产生相应的蛋白质羰基衍生物[28]。蛋白质羰基(PCO)的形成是蛋白质被氧化的重要标志,因此通过测定其含量可判断蛋白质是否发生氧化损伤[29]。3-硝基酪氨酸(3-NT)是蛋白酪氨酸残基发生硝化而生成的产物,晚期氧化蛋白产物(AOPP)是次氯酸引起的血浆白蛋白氧化产物,两者均为蛋白质氧化损伤的标志物[30-31]。不同组小鼠血浆中蛋白质氧化损害的标志物含量见表2。
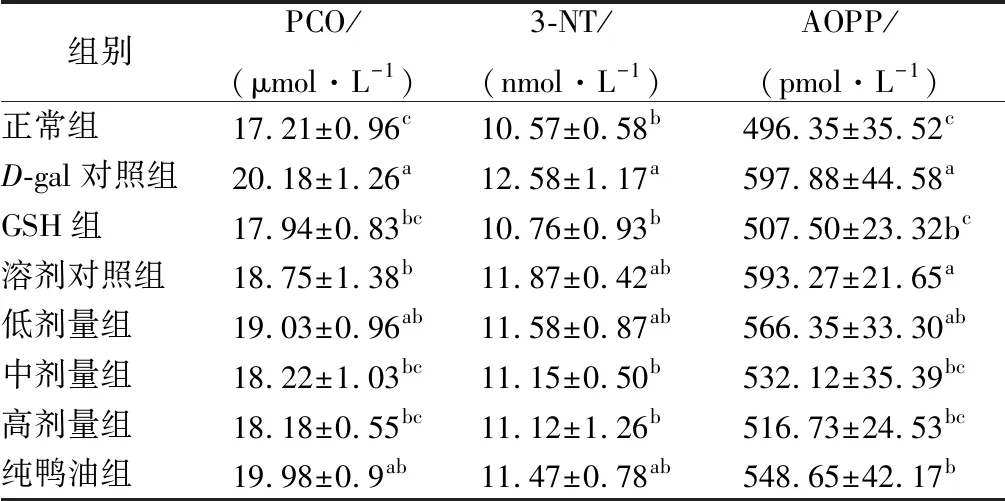
表2 不同实验组小鼠血浆中蛋白质氧化产物含量(n=10)Table 2 Plasma protein oxidation content in different groups of mice
由表2可知,与正常组相比,D-gal对照组小鼠血浆的PCO、3-NT、AOPP含量分别升高了17.26%、19.02%、20.46%,均显著高于正常组,表明长期注射D-半乳糖可导致小鼠的蛋白质发生氧化损伤。与D-gal对照组相比,阳性组小鼠血浆的PCO、3-NT、AOPP含量分别降低了11.10%、14.47%、15.12%,含量与正常组差异不显著,表明灌胃GSH后,能使小鼠的蛋白质氧化损伤产物减少,且恢复至正常水平;溶剂对照组的PCO、3-NT、AOPP含量分别下降7.09%、5.64%、0.77%,其中PCO含量显著低于D-gal对照组,3-NT、AOPP含量与D-gal对照组差异不显著,表明溶剂可能会改善已发生氧化应激小鼠的蛋白质氧化损伤;低、中、高剂量组鸭油、纯鸭油组的PCO含量分别下降5.70%、9.71%、9.91%、1.00%,除纯鸭油组、低剂量鸭油组,其余各组均显著低于D-gal对照组,其中中、高剂量组与正常组差异不显著,表明灌胃鸭油后能降低已发生氧化应激小鼠血浆的PCO含量,且中、高剂量能恢复至正常水平;低、中、高剂量组鸭油、纯鸭油组的3-NT含量分别下降7.95%、11.37%、11.61%、8.82%,其中低剂量组、纯鸭油组的3-NT含量虽低于D-gal对照组,但差异不显著,中、高剂量组与正常组差异不显著,表明灌胃鸭油后能降低已发生氧化应激小鼠血浆的3-NT含量,且中、高剂量能恢复至正常水平;低、中、高剂量组鸭油、纯鸭油组的AOPP含量分别下降5.27%、11.00%、13.57%、8.23%,除低剂量组外,其余各组的AOPP含量均显著低于D-gal对照组,中、高剂量与正常组差异不显著,表明灌胃鸭油后能降低已发生氧化应激小鼠血浆的AOPP含量,且中、高剂量能恢复至正常水平。高剂量组的PCO、3-NT、AOPP含量虽低于纯鸭油组,但差异均不显著,表明鸭油中加入的TBHQ可能不会增强鸭油改善蛋白质氧化损伤的能力。
2.5 鸭油对小鼠DNA氧化的影响
8-羟基脱氧鸟苷(8-OHdG)是ROS攻击DNA分子中鸟嘌呤碱基的第8位碳原子产生的氧化性加合物[32],是评价DNA氧化损伤的标志物[33]。5-羟基胞嘧啶(5-hmC)是ROS攻击DNA产生的另一种碱基修饰物,其含量也可反映DNA损伤程度[34-35]。若不能及时清除和修复被氧化的碱基,可能会基因突变,诱导肿瘤的发生。机体内,8-OHdG的修复主要依赖于8-氧鸟嘌呤DNA糖苷酶1(OGG1)及8-羟基鸟嘌呤核苷酸酶1(MTH1)[36-37],机体过多的ROS会抑制DNA糖化酶OGG1[38]。测定DNA修复酶活性可了解DNA的碱基修复情况。不同组小鼠血浆的8-OHdG、5-hmC含量,OGG1、MTH1活性见表3。
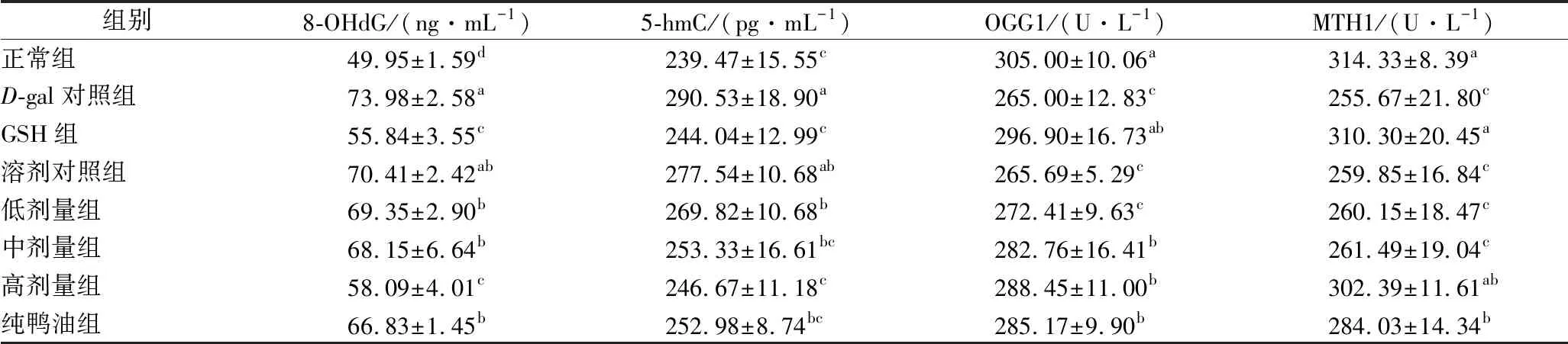
表3 不同实验组小鼠血浆中DNA氧化相关指标(n=10)Table 3 Plasma DNA oxidation-related indexes in different groups of mice
由表3可知,与正常组相比,D-gal对照组小鼠血浆的8-OHdG、5-hmC含量分别升高28.09%、21.32%,OGG1、MTH1活性分别下降13.11%、18.66%,差异均显著。与D-gal对照组相比,GSH组小鼠血浆的8-OHdG、5-hmC含量分别下降24.52%、16.00%,OGG1、MTH1活性分别升高12.04%、21.37%,具有显著性差异,表明灌胃GSH后,小鼠的DNA氧化损伤程度减轻;溶剂对照组的8-OHdG、5-hmC分别下降4.83%、4.47%,OGG1、MTH1活性分别上升0.26%、1.63%,均与D-gal对照组差异不显著,表明溶剂可能没有改善已发生氧化应激小鼠的DNA氧化损伤的作用;低、中、高剂量组鸭油、纯鸭油组的8-OHdG含量分别下降6.26%、7.88%、21.49%、9.66%,均显著低于D-gal对照组,显著高于正常组,表明灌胃鸭油虽能降低已发生氧化应激小鼠的8-OHdG含量,但未恢复至正常水平;低、中、高剂量鸭油、纯鸭油组的5-hmC含量分别下降7.13%、12.80%、15.10%、12.92%,均显著低于D-gal对照组,除低剂量外,其余各组与正常组差异不显著,表明灌胃鸭油能降低已发生氧化应激小鼠的5-hmC含量,且中、高剂量、纯鸭油均能恢复至正常水平;低、中、高剂量鸭油、纯鸭油组的OGG1活性分别上升2.80%、6.70%、8.85%、7.61%,除低剂量外,均显著高于D-gal对照组,各组均显著低于正常组,表明灌胃鸭油能升高已发生氧化应激小鼠的OGG1活性,但尚未恢复至正常水平;低、中、高剂量鸭油、纯鸭油组的MTH1活性分别上升1.75%、2.28%、18.29%、11.09%,其中低、中剂量与D-gal对照组差异不显著,高剂量显著高于D-gal对照组,与正常组差异不显著,表明灌胃鸭油能升高已发生氧化应激小鼠的MTH1活性,且高剂量能恢复至正常水平。高剂量的8-OHdG显著低于纯鸭油组,5-hmC含量与纯鸭油组差异不显著,OGG1、MTH1活性虽高于纯鸭油组,但差异不显著,表明鸭油中加入的TBHQ可能没有增强鸭油的抗DNA氧化损伤能力。
3 结论与讨论
本研究采用对小鼠连续腹腔注射D-gal的方法,建立氧化应激模型。给小鼠连续注射一段时间D-gal后,大量堆积的D-gal会和烟酰胺腺嘌呤二核苷酸在醛糖还原酶作用下生成半乳糖醇,后者在半乳糖脱氢酶和半乳糖氧化酶作用下产生超氧阴离子、过氧化氢、羟自由基,造成氧化应激[39-40]。根据“国食药监保化[2012]107号”文中《关于印发抗氧化功能评价方法等9个保健功能评价方法的通知》[41]抗氧化酶活性、过氧化脂质含量、蛋白质羰基含量、还原性谷胱甘肽含量4项指标中3项指标阳性,可判定氧化应激模型成功建立。本研究测定结果中,与正常相比,模型组小鼠血浆的抗氧化酶SOD、GPx活性显著降低,8-iso-PG2α、PCO含量显著升高,表明氧化应激模型建立成功。
目前,还未有人研究鸭油在体内是否能改善氧化应激,但有相关文献研究与鸭油脂肪酸组成类似的鹅油、鱼油[42]、磷虾油[43]的改善作用,如张佰帅等[15]发现鹅油能提高小鼠血浆和肝脏的T-AOC、CAT、SOD、GPx活性,抑制MDA生成,认为其机理可能是鹅油中的单不饱和脂肪酸纳入组织后,抑制血栓素的释放,增加抗氧化酶活性,进而提高小鼠的抗氧化能力;韩海娜等[44]研究发现以鹅油甘油二酯微胶囊能显著提升小鼠血浆和肝脏T-AOC、SOD、GPx活性,降低MDA含量,具有一定的抗氧化作用。本实验研究发现,给氧化应激损伤的小鼠注射不同剂量的鸭油后,小鼠血浆的总抗氧化能力提高,抗氧化酶活性增强,抗氧化物质含量上升,脂质氧化产物、蛋白质氧化产物、DNA氧化产物含量下降,DNA修复酶活性上升。相较于其余鸭油组,高剂量鸭油改善氧化应激的效果最好。
鸭油因其不饱和脂肪酸含量较高,易氧化,因此在提取过程中加入了0.015%的TBHQ缓解其氧化。TBHQ的摄入可能会对氧化应激指标有一定影响[45],因此在评价鸭油对小鼠氧化应激的影响时,为排除其影响,在设置的溶剂对照组中加入了TBHQ,加入量为鸭油中所含有的。实验结果中,加有TBHQ的溶剂对照组的总抗氧化能力、抗氧化物酶活性、抗氧化物质含量虽高于模型组,但差异不显著;蛋白质氧化产物(PCO除外)、DNA氧化产物的含量均低于模型组,但差异不显著,可能是因为TBHQ含量过低。
综上所述,鸭油可通过提高小鼠血浆的总抗氧化能力、抗氧化酶活性、抗氧化物质含量、抑制脂质氧化、蛋白质氧化、DNA氧化、提高DNA修复酶活性,改善D-gal诱导的氧化应激。高剂量组的效果比其余各组鸭油好,且各项指标趋于正常,但关于鸭油改善小鼠氧化应激的机理还需进一步研究。
