开菲尔粒发酵过程酵母菌多样性和动态规律
2019-11-07马龙邢军李安张瑞
马龙,邢军,李安,张瑞
(1.新疆特殊环境物种保护与调控生物学实验室新疆特殊环境物种多样性应用与调控重点实验室干旱区植物逆境生物学实验室新疆师范大学生命科学学院,乌鲁木齐830054;2.新疆大学生命科学与技术学院,乌鲁木齐830046)
0 引言
开菲尔粒是富含乳酸菌、酵母菌和醋酸菌的复杂微生物集合体[1]。开菲尔粒经过发酵产生有独特香气的酒精性功能饮料开菲尔[2]。在发酵的过程中,发酵乳中酵母菌的含量微小但是有很重要的作用,它们将糖与蛋白质等物质转化为乳酸、酒精等风味物质[3]。开菲尔粒中的酵母菌可与乳酸菌相互作用产生丰富的氨基酸和醇类物质[4]。乳酸菌分解乳糖产生葡萄糖和半乳糖,促使酵母菌生长而引起乙醇发酵,并产生CO2,酵母菌的生长繁殖为乳酸菌和醋酸菌的生长起促进作用[5]。开菲尔粒的这种特殊的菌群结构给予发酵乳特殊的风味物质,酵母菌的多样性为发酵乳提供独特的风味物质发酵源[6]。酵母菌在有氧和无氧环境下都能生存,是单细胞真菌,属兼性厌氧菌,以芽殖或裂殖方式进行繁殖。酵母菌在酿造、医药、啤酒及发酵乳制品中起着重要作用[7]。
开菲尔在发酵过程中含有很多种酵母菌,酵母菌具有很高的营养价值,特别是含有较多蛋白质,很多B族维生素、核酸和矿物质,同时也能产生一些保健功能活性物质。然而在酸奶中酵母菌的存在却是不利的,往往被认作酸奶中的污染菌,是酸奶变质的主要原因[8]。但在一些商业化的乳制品中,特定的酵母能够为产品带来期望的香气和风味[9]。近年来,不断发现酵母菌作为附属发酵剂对乳制品发酵和成熟过程中的风味影响、抑制有害菌的生长及对人体的潜在益生功能[10]。然而乳酸菌和酵母菌稳定的互生关系比较复杂,既有促进作用也有抑制作用,对于不同产品中它们如何相互作用,会产生哪些影响及共生机理目前还不十分清楚[11-12]。因此,研究酵母菌在整个发酵过程中的种群变化和丰度大小,有利于深入了解酵母菌与乳酸菌、醋酸菌等的生长和新陈代谢之间的相互影响。
1 微生物多样性提取
使用m obio土壤微生物DNA强力提取试剂盒Power Soil®DNA Isolation K it。扩增引物:真菌ITS1区域引物:(5'-CTTGGTCATTTAGAGGAAGTAA-3')(5'-GCTGCGTTCTTCATCGATGC-3')。
仪器名称、生产厂家和型号:微型离心机TIANGEN 1795、卧式冷藏冷冻转换柜海尔BC/BD-629HK、4°C冰箱 海尔HYC-360、振荡器SIG 560E 96 well、PCR 仪 AB 9902、24孔 离 心 机 EPPENDORF 5424E Q 766751。
试剂名称及用量:基因组DNA 40-60 ng、*Vn F(10μm)1.5μL、*Vn R(10μm)1.5μL、Q 5 High-Fidelity DNA Polymerase 0.2μl、High GC Enhancer 10μL、Bμffer 10μL、dNTP 1μL、ddH2O、补至总体系50μL。反应条件:95℃5 m in、95℃1 m in、50℃1min、72℃1 m in、72℃7 m in、4℃保存。
高通量测序委托北京百迈客生物科技有限公司。微生物多样性是基于Illumina Hi Seq测序平台,利用双末端测序(Paired-End)的方法,构建小片段文库进行测序。通过对Reads拼接过滤,OTUs(Operational Ta Jonomic Units)聚类,并进行物种注释及丰度分析,可以揭示样品的物种构成和显著物种差异分析等等。

图1 发酵样品PCR产物图
2 结果分析
稀释性曲线(Rarefaction Curve)从样本中随机抽取一定数量的序列,统计这些序列所代表的物种数目,并以序列数与物种数来构建曲线,用于验证测序数据量是否足以反映样品中的物种多样性,并间接反映样品中物种的丰富程度。稀释曲线可以作为对各样本测序量是否充分的判断,曲线急剧上升表明测序量不足,需要增加序列条数;反之,则表明样品序列充分,可以进行数据分析。
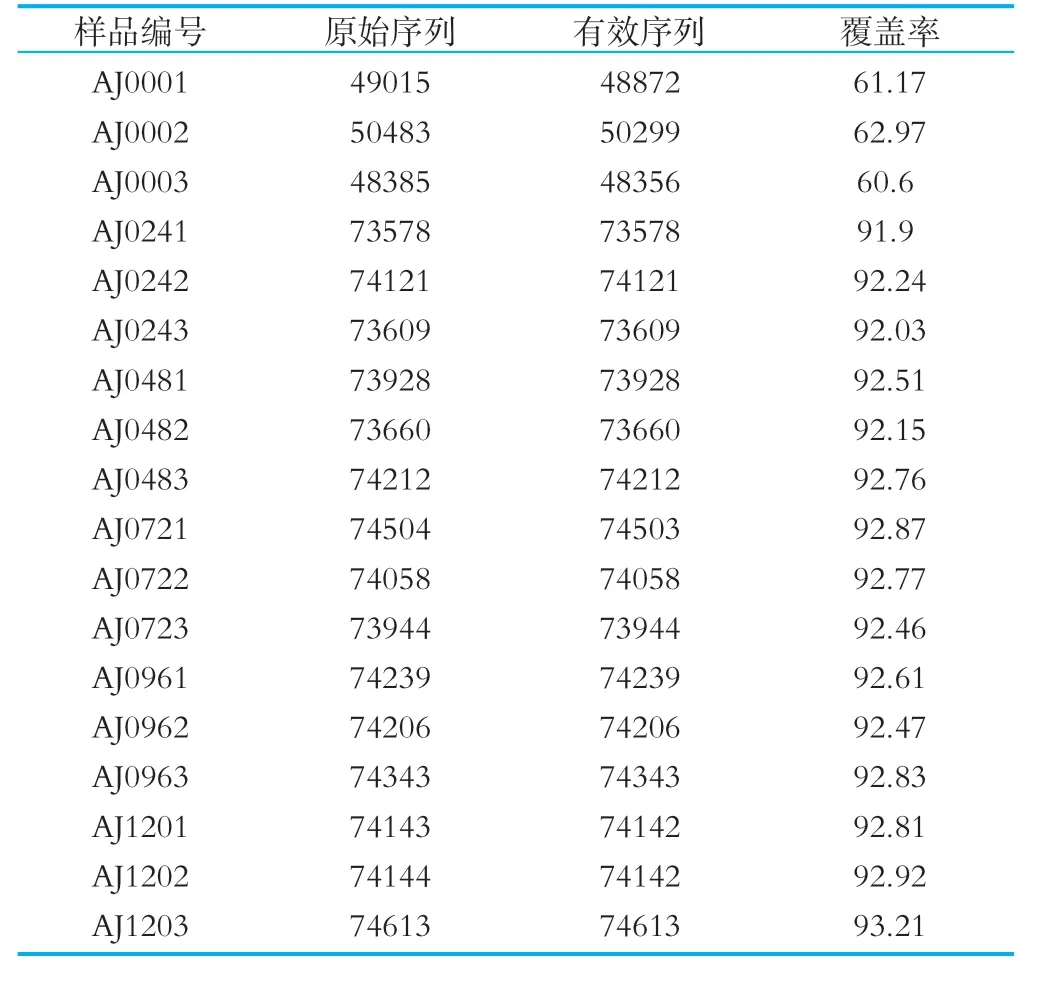
表1 发酵样品序列信息
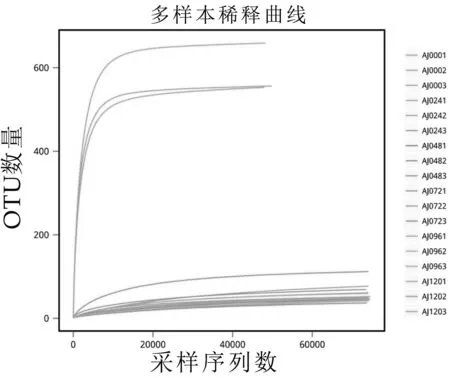
图2 发酵样品稀释曲线
由图2可知,随着测序条数的加大,曲线趋于平缓,表示此环境中的物种并不会随测序数量的增加而显著增多,样品测序科学合理。
2.1 PCoA结果分析
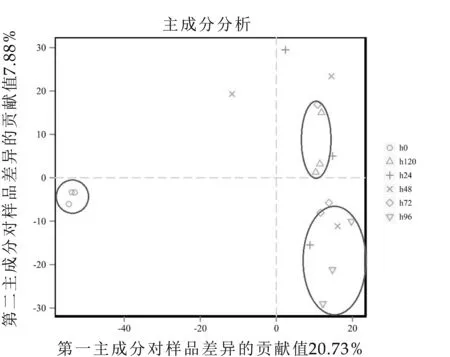
图3 发酵样品PCoA分析图
由图3可知,样品在0 h样本间比较集中,发酵24 h后,样品间都分布在两个区域。24 h、48 h、72 h的样品,自身较分散,分布在不同坐标,多样性丰富。96 h和120 h的样品自身集中,与其他时间段样品间距离较小,自身样品稳定。样品间重复性较好没有太大差异。
2.2 各分类水平的分类学组成分析

图4 发酵样品门水平物种图
2.3 门水平的群落分类学组成分析
真菌菌门优势菌门主要包括4个菌门,分别是子囊菌门(Ascomycota)、被孢霉门(Mortierellomycota)、担子霉门(Basidiobolomycota)、球囊菌门(Glomeromycota)、壶菌门(Chytridiomycota)和未分类(Unclassified)。其中相对丰度最大的优势菌门为子囊菌门,高达69.38%,其相对丰度变化在不同发酵时间前后期依次为99.14%,99.78%,99.90%,99.95%,99.91%。其次被孢霉门相对丰度为6.91%,相对丰度变化依次为0.02%,0.06%,0.02%,0.00%,0.01%。由此可知,随着发酵时间的增加子囊菌门的相对丰度总体呈现出逐渐上升的趋势,担子菌门的相对丰度总体呈现出逐渐下降的趋势。其他3个菌门相对丰度较低,分别为担子霉门0.02%、球囊菌门0.74%和壶菌门0.46%。

表2 发酵样品物种占比表 %
2.4 属水平上的群落构成分析
占比在0.1%以上的真菌菌属约30种。0.5%为Alternaria(20.77%)、ortierella(6.86%)、ladosporium(2.69%)、spergillus(1.71%)、lectosphaerella(1.70%)、ycosphaerella(1.37%)、andida(0.86%)、usarium(0.98%)、haetomium(0.91%)、uehomyces(0.93%)、idymella(0.58%),链格孢属为相对优势菌属,相对丰度变化在不同发酵时间前后期依次为20.77%,0.01%,0.01%,0.01%,0.01%,0.01%,其相对丰度在发酵溶液中逐渐降低。

图5 发酵样品门水平物种图

表3 发酵样品物种占比表 %
对于每个时间段样品的酵母菌进行门、属等水平的归类整理,未知的不做谈论。在已知的样品酵母菌中,酵母菌群落有差异。在发酵的前期,样品中含有多种酵母菌,分别是子囊菌门(Ascomycota)、被孢霉门(Mortierellomycota)、担子霉门(Basidiobolomycota)、球囊菌门(Glomeromycota)、壶菌门(Chytridiomycota)等5门的酵母菌。在属水平下,有链格孢属、毛壳菌属、被孢霉属、枝孢属、曲霉属、球腔菌属、假丝酵母属,镰刀菌属等30种酵母菌。
2.5 多样性指数
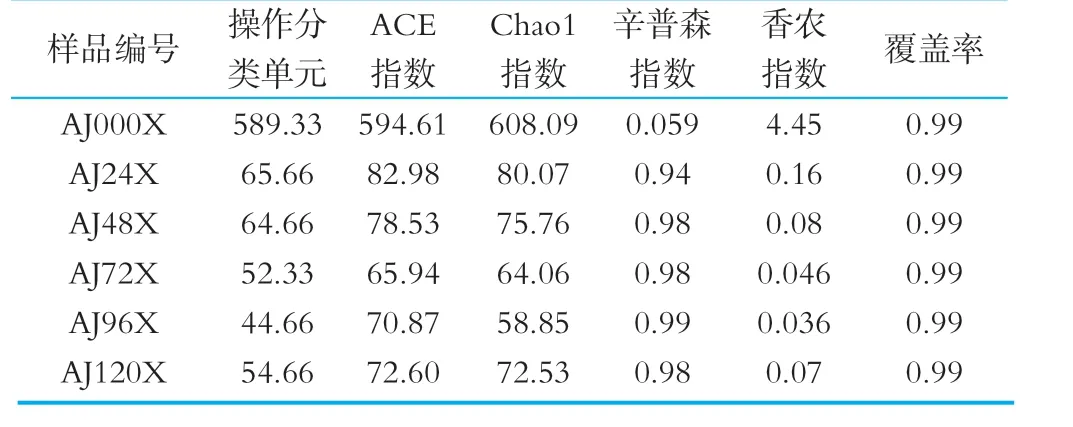
表4 发酵样品样品多样性指数
多样性指数用于研究环境中微生物的多样性,Shannon指数和Sim pson指数综合衡量物种的多样性,Shannon指数数值越高,Sim pson指数越低说明物种多样性更丰富。样品AJ000X的Shannon指数为0.0059,Sim pson指数为4.4516。说明样品中酵母菌OTU多样性很低,这些样品在刚发酵时活化时间为24 h,活化前可能存放时间较长,或者因为太干凝固导致样品真菌多样性较低。在发酵24 h后,样品中酵母菌进一步活化,24 h Shannon指数为0.9493,Sim pson指数为0.1612,表明酵母菌多样性开始增加。原因是其他类型的酵母菌开始繁殖。Chao1指数和ACE指数主要用于衡量样本中的物种种类丰富度。Chao1指数主要利用只含有1条序列的OTU数目(singleton)和只含有2条序列的OTU数目(doubleton)来判断群落的物种丰富度,它对单个物种的变化更为敏感,它的数值越大,表示物种种类越多;ACE指数是通过singleton和稀有物种(出现≤10次)来估算还有多少没被发现的物种,当测序中singleton的比例越大,ACE值越大,样本的真实物种种类越多。样品0 h的Chao1指数和ACE指数均最高,表明这个样品中酵母菌OTU种类较多;而样品24 h、48 h、72 h的Chao1指数降低,ACE指数也随着降低,表明样品中酵母菌OTU种类慢慢变少。酵母菌数目在72 h最低,随着发酵时间的增大,酵母菌的数目从24 h后一直在减少。说明在发酵的前期有大量的酵母菌分解乳糖,为乳酸菌的发酵提供能量和材料。在发酵的后期,酵母菌菌落数目减少。Sim pson指数值很低,说明群落多样性越低,Shannon值越来越小,说明群落多样性变低。
2.6 丰度热图分析
由图6可以看出,新疆阿勒泰发酵剂开菲尔粒中0 h酵母菌的种类和数量都特别多,门水平上面包含子囊菌门、担子菌门、球囊菌门等。属水平上面假丝酵母属、镰刀菌属、拟青霉属、绿僵菌属、漆斑菌属、锥毛壳属、毛壳菌属、腐质霉属、掷孢酵母、角担子菌属、红酵母属、被孢霉属、附球菌属等十七种属的真菌。

图6 发酵样品丰度热图
在发酵24 h后,菌群发生了变化。出现了红酵母属、掷孢子酵母属、镰刀菌属、腐质霉属、尾孢属、假丝酵母、链孢霉属。在48 h出现了掷孢酵母属、克鲁维酵母菌属、覆膜孢酵母属、毛霉属、红酵母属、镰刀菌属、毛壳属、腐质菌属、金担子菌属、球腔菌属、假丝酵母、附球菌属。在72 h出现了毛壳菌属、被毛孢属、镰刀菌属、金担子、曲霉属、霉菌属、红酵母属、德巴里酵母菌、克鲁维酵母菌、葡萄球菌属、(附球)菌属。
3 结论
本实验室将采集与新疆阿勒泰地区的发酵剂开菲尔粒和牛乳为原料,进行发酵培养。分时段检测在不同时间段,发酵乳中酵母菌的变化规律。18个样品的真菌ITS1区测序,得到1440062对Reads',过滤后共产生1259185条C lean tags,每个样品至少产生48385条C lean tags。平均产生69955条C lean tags。在这些样品中,以0 h的样品的多样性最为明显,在发酵初期,有三个门的酵母菌,子囊菌门、担子菌门、球囊菌门等。属水平:假丝酵母属、镰刀菌属、拟青霉属、绿僵菌属、漆斑菌属、锥毛壳属、毛壳菌属、腐质霉属、掷孢酵母、角担子菌属、红酵母属、被孢霉属、附球菌属等十七种属。其中,优势菌门是子囊菌门,链格孢属属为优势菌属。
4 讨论
高通量测序技术近几年在食品分析方面用途宽广,但是分析乳制品中真菌多样性的报道较少,本研究的乳制品中真菌菌群复杂性虽然没有肠道,土壤等多,但是乳制品中的菌群直接决定发酵乳的品质和风味,不仅关系到乳制品的制作同时对乳制品的运输保存也有影响。刘建利等研究面引子中酵母菌,结果表明样品中共有12个属16种酵母菌,用高通量测序研究新疆传统馕面团发酵酵母菌,研究发现10个属14个种[13-15]。本研究对开菲尔发酵液发酵过程的真菌群落多样性和丰富度进行分析与评价,其中在前期样品中丰富度和多样性最大,在后期样品中较低,前后期之间存在差异。通过对发酵过程的现象观察发现,在发酵过程中溶液表面的真菌数量逐渐减少,且在发酵前期溶液的澄清度差别不明显,到发酵后期溶液的澄清度有明显差异,前期溶液浓稠暗淡,后期溶液较清。后期溶液丰富度和多样性的趋势变化可能是因为在发酵前期溶液中的溶解氧被逐渐消耗使好氧菌数量减少,在发酵后期上层菌群逐渐沉降,使发酵后期溶液中的菌群丰富度和多样性差异逐渐减小[16-20]。
开菲尔发酵液样品进行分类学鉴定时发现真菌群落主要包括5个门,其中子囊菌门(74.21%)为优势菌门。张颖[21]研究证明,豆酱自然发酵的不同阶段优势真菌是子囊菌门,同时在李恒等[22-23]研究的泡菜母水中子囊菌门(99.93%)也是优势菌门,说明子囊菌门在发酵过程中起着极大的共性作用。因此,结合测序结果与观察结果推测发酵液表面的青灰色真菌可能是韦斯特壳属和青霉属,后期将对这2个种属及占比在2%以上的曲霉属、链格孢属进行分离纯化。
开菲尔发酵液中有着丰富的微生物资源,具有生物学多样性。本实验仅利用高通量测序技术分析开菲尔发酵液中真菌菌群结构、丰富度与多样性的动态变化,比较客观地反映出开菲尔发酵液中的真菌区系[24-27]。考虑到开菲尔发酵液的成分属于多菌种混合发酵,酵母菌发酵液也含有风味性成分,发酵过程中真菌结构、丰富度与多样性的变化势必会对开菲尔发酵液中的风味成分产生影响,因此后期将对传统开菲尔发酵液发酵过程中菌种变化与风味物质之间的联系深入研究。
