多学科团队诊治直肠癌伴腹股沟淋巴结转移一例
2019-11-07肖乾任华沈俐王六红唐喆蔡文徐栋袁瑛张苏展丁克峰
肖乾 任华 沈俐 王六红 唐喆 蔡文 徐栋 袁瑛 张苏展 丁克峰
如何有效组合全身化疗和局部治疗手段如手术、放疗及射频消融治疗制定个体化策略是晚期直肠癌治疗的难点。本例患者初诊为直肠癌合并腹股沟淋巴结转移,治疗过程中出现肝脏转移,经多学科团队协作诊治后达到无瘤生存,本文就此例患者的诊治过程进行汇报。
一、病例资料
1. 主诉:
患者,男性,65岁,因“腹胀伴排便困难2月”于2018年4月12日收治入浙江大学医学院附属第二医院消化内科。
2. 入院评估:
一般情况:体质指数(BMI)20.39 kg/m²,营养风险评分0分,日常活动能力(ADL)评级I级,东部肿瘤协作组(ECOG)评分0分,体表面积(BSA):1.60 m²。
体格检查:PS评分0分,血压130/89 mmHg(1 mmHg=0.133 kPa),皮肤巩膜无黄染,右侧腹股沟可及肿大淋巴结,大小约1.5 cm×1.5 cm,固定,质地硬,无明显压痛,心肺无殊,腹平软,未及明显肿块,无压痛及反跳痛,肝脾下界未触及。
肛门指诊:肛门外观无殊,距肛约2 cm直肠右侧壁可触及肿物,质地较硬,表面凹凸不平,活动度差,退指指套染血。
3. 入院检查:
血尿粪3大常规、肝肾功能、凝血谱、肿瘤标志物等检查发现以下异常:癌胚抗原(CEA)5.21 ng/mL,癌抗原(CA19-9)134.4 U/mL,前列腺特异性抗原7.82 ng/mL,游离型前列腺特异性抗原1.16 ng/mL。
电子结肠镜检查(图1):距肛1~2 cm可见一半球状隆起,表面绒毛状,大小1.2 cm,周围可见较多静脉曲张隆起;另距肛30 cm见一枚1 cm左右亚蒂隆起型息肉,予以摘除。活检病理提示为:(距肛1 cm)管状腺瘤癌变,中分化腺癌;(距肛30 cm):管状腺瘤伴低级别上皮内瘤变(图2)。
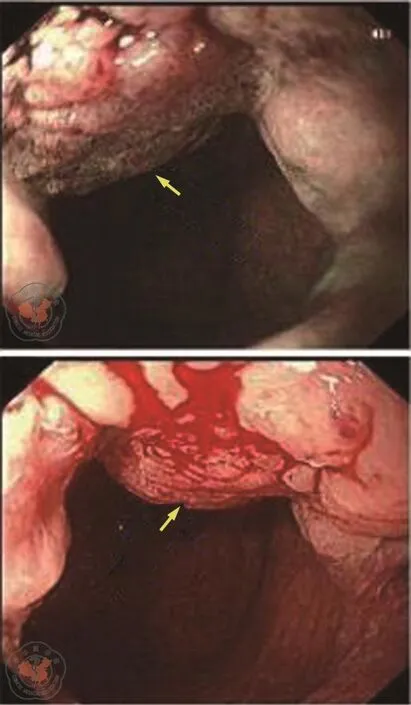
图1 初诊电子结肠镜检查。图示为直肠距肛2 cm糜烂出血肿物(箭头所指)
右侧腹股沟淋巴结切除活检病理:转移性腺癌,结合免疫组化符合大肠癌转移。免疫组化结果:CK7(+),CK20(+),CDX2(+),Villin(+),Muc-1(+),Muc-2(-),Muc-5AC(-),Muc-6(-),NapsinA(-),TTF-1(-)。
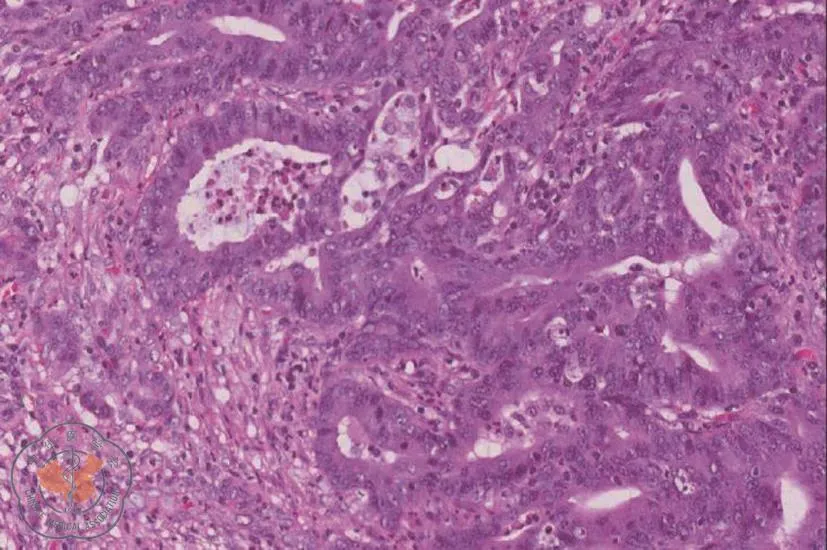
图2 肠镜下活检组织病理。图示为直肠中分化腺癌(100×)
影像学评估:
直肠磁共振成像(MRI)(图3):
影像所见:DIS:肿瘤位于直肠下段,腹膜反折下,肿瘤长度15 mm,肿瘤下级距肛下缘10 mm。A(肛管):肿瘤穿透肛管内括约肌,累及右侧外括约肌。N(淋巴结):右侧腹股沟见1枚肿大淋巴结,短径13 mm。直肠系膜区见2枚5 mm小淋巴结,环形强化。C(CRM,环周切缘):直肠系膜筋膜(右侧肛提肌上筋膜)见侵犯。E(EMVI,壁外血管侵犯):未见壁外血管侵犯。
影像诊断:直肠下段癌(T4bN1M1),肿瘤距肛下缘10 mm,侵犯右侧外括约肌及肛提肌,右侧腹股沟见1枚肿大淋巴结,环周切缘(+),未见壁外血管侵犯。
全腹部CT增强扫描:肝Ⅵ段细小低密度结节,考虑小囊肿,请随访;升结肠及部分横结肠肠壁水肿,请结合临床;前列腺增生;盆腔少量积液。
胸部CT增强扫描:右肺尖小增殖灶。两肺下叶及左肺上叶舌段少许纤维灶。两侧胸膜增厚。
诊断:直肠癌伴右腹股沟淋巴结转移(cT4bN1M1)。
二、第一阶段MDT讨论荟萃及诊治经过:讨论时间:2018年4月26日
MDT讨论目的:明确诊断和临床分期,讨论治疗方案。
1. 王六红副主任医师(放射科):阅读患者直肠MRI DISTANCE检查、全腹增强CT和胸部CT综合评估如下:直肠下段癌,肿瘤距肛下缘10 mm,侵犯右侧外括约肌及肛提肌,系膜内见2枚直径约5 mm环形强化淋巴结,环周切缘(+)。右侧腹股沟见1枚肿大淋巴结。全腹增强CT可见肝Ⅵ段细小低密度结节,考虑小囊肿,升结肠及部分横结肠肠壁水肿。肺部CT未见明显转移灶。影像学评估:cT4bN1M1。
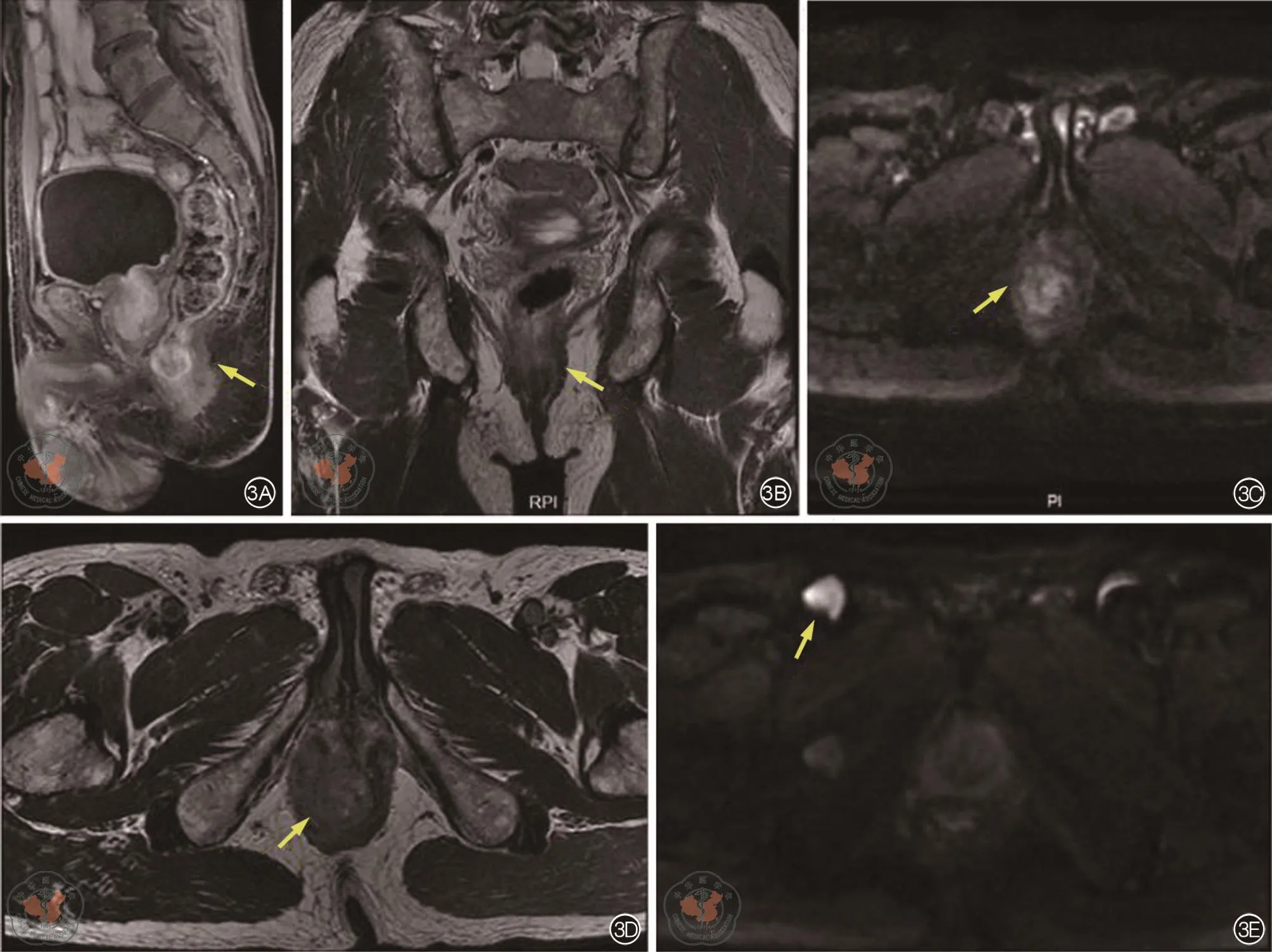
图3 初诊直肠癌增强MRI复查。所示图片箭头分别为3A:T1WI增强矢状位、3B:T2WI冠状位、3C:DWI水平位、3D:T2WI水平位直肠下段肿物及3E:DWI水平位腹股沟肿大淋巴结
2. 任华主任医师(大肠外科):患者目前明确诊断直肠癌伴右侧腹股沟淋巴结转移,直肠癌及右侧腹股沟淋巴结病理活检明确,肿瘤TNM分期为cT4bN1M1。直肠癌原发灶距肛仅1~2 cm,直接手术需行腹会阴联合直肠癌根治术;右侧肿大淋巴结虽已活检切除,但仍需行右腹股沟淋巴结清扫术。患者目前便血症状不明显,无穿孔及梗阻征象,建议先行直肠及右腹股沟区局部放疗和全身化疗,降低局部复发率,争取肿瘤退缩,放疗后6~8周再进行手术治疗。
3. 袁瑛主任医师(肿瘤内科):患者直肠癌伴右侧腹股沟淋巴结转移诊断明确,分期为cT4bN1M1,外科评估原发灶及转移灶均可手术切除,故治疗目标应为手术根治。参照NCCN指南及ESMO指南直肠癌肝转移治疗方案,推荐先行术前直肠同步放化疗。患者一般状态良好,无明显化疗禁忌证,放疗同时加用单药卡培他滨或双药XELOX方案化疗。
4. 沈俐副主任医师(放疗科):患者直肠癌病理诊断明确,直肠MRI评估提示直肠肿块侵犯右侧肛提肌,直肠系膜内见2枚明显环形强化淋巴结,肿瘤局部分期为cT4bN1,直肠肿瘤局部无出血、穿孔及梗阻等急诊手术指征,按照NCCN指南,直肠肿瘤局部有术前同步放化疗指征。患者右侧腹股沟切除淋巴结活检证实为腺癌转移(M1),除常规照射直肠瘤床区外,盆腔腹股沟淋巴引流区亦需进行放疗。建议放疗同时加用双药化疗方案(XELOX),增加局部缓解率。放疗后6~8周评估疗效,再拟定下一步治疗方案。
5. 丁克峰主任医师(大肠外科)总结:结合团队专家意见,患者目前诊断直肠癌伴右侧腹股沟淋巴结转移明确,临床分期为cT4bN1M1,肿瘤位置较低,侵犯括约肌,伴有右腹股沟区淋巴结转移,可行腹会阴联合直肠癌根治术及右腹股沟淋巴结清扫术完全切除肿瘤及转移淋巴结,因此治疗目的为根治性治疗。直肠肿瘤局部无出血、穿孔及梗阻等急诊手术指征,先行直肠瘤床区及盆腔腹股沟淋巴引流区新辅助放疗,同时加用XELOX方案新辅助化疗,降低肿瘤分期及术后局部复发率,放疗后6~8周评估疗效,再决定进一步手术方式。
三、第一阶段后续治疗

图4 局部放化疗后直肠癌增强MRI复查。所示图片箭头分别为4A:T1WI增强矢状位、4B:T2WI冠状位、4C:DWI水平位、4D:T2WI水平位直肠下段肿物及4E:DWI水平位腹股沟肿大淋巴结。对应前片,箭头所指直肠肿瘤及腹股沟淋巴结均明显退缩
患者于2018年5月24日、2018年6月16日行XELOX方案化疗2次(卡培他滨片1.5 g BID D1~14+奥沙利铂200 mg D1)并于2018年5月30日开始行直肠瘤床区及盆腔腹股沟淋巴引流区放疗6MV-X线DT57.5 Gy/25 F调强放疗,按PGTV D95给量,PTV DT45 Gy/25 F,于2018年7月1日结束放疗,后因Ⅲ度血液学毒性未继续行化疗。
治疗后复查(1):2018年8月(放疗结束后7周)回院复查:
查体:PS评分0分,双侧腹股沟未及肿大淋巴结;肛门指诊:肛门外观无殊,距肛约2 cm右前壁可触及僵硬直肠壁,占肠腔半圈,表面光滑,未及明显肿块,指套无染血。肛门镜:直肠右前壁局灶黏膜散在出血点,未见明显肿物。
直肠MRI(图4):直肠下段癌放疗后,较前片(2018年4月19日)肿瘤明显退缩,局部可疑少许残留。
电子结肠镜检查(图5):直肠黏膜下段充血水肿,表面光滑,散在出血点,未见明显肿瘤。
腹股沟淋巴结B超:双侧腹股沟未见明显肿大淋巴结。
全腹部CT:直肠癌放疗后,局部肠壁增厚,请结合临床;肝Ⅵ段、Ⅷ段低密度影,较前片(2018年4月16日)大致相仿,考虑不典型血管瘤可能,建议随访。网膜轻度增厚;
肝脏MRI(图6):肝Ⅷ段近膈顶处见小类圆形结节灶,大小约6 mm,增强后病灶强化不明显,建议短期随访;肝Ⅵ段斑点状稍长T1长T2信号灶,增强后动脉期强化不明显,门脉期及延迟期呈等密度,考虑小血管瘤;肝Ⅵ段长T1长T2信号影,无强化,考虑小囊肿。
胸部CT:与前片(2018年4月15日)大致相仿。
肿瘤标志物:癌胚抗原(CEA)较前降低3.8 ng/mL、癌抗原(CA19-9)较前降低76.9 U/mL。
四、第二阶段MDT讨论荟萃及诊治经过:讨论时间:2018年8月23日
MDT讨论——同步放化疗效果评估及下一步治疗方案。
1. 王六红副主任医师(放射科):患者直肠MRI显示患者肠道原发病灶明显退缩,肌层局部弥散受限,局部见小结节状DWI稍高信号影,不除外肿瘤残余;肠系膜内、腹股沟区未见明显肿大淋巴结。仔细对比前片,2018年8月15日肝脏MRI可见肝Ⅷ段近膈顶处新发低密度影,不除外转移,需密切随访。

图5 放疗后电子结肠镜检查。肠腔内散在出血点,无明显肿瘤证据,箭头所示为白色瘢痕组织
2. 任华主任医师(大肠外科):患者经局部放疗联合两药同步化疗后直肠肿瘤较前明显退缩,腹股沟区未见明显肿大淋巴结,疗效评价PR。患者化疗耐受性较差,Ⅲ度血液学毒性,需要粒细胞集落刺激因子升白细胞治疗,继续化疗对患者体力状态影响较大。目前患者一般情况良好,可以耐受手术,治疗目标仍应为手术根治,建议行“腹会阴联合直肠癌根治术+腹股沟淋巴结清扫术”,术后即使为病理完全缓解(pCR),也是值得手术的。
3. 沈俐副主任医师(放疗科):患者低位直肠癌诊断明确,放疗前肿瘤分期cT4N1M1,经直肠野及右腹股沟区放疗联合双药同步化疗两周期。现放疗结束后7周,原发灶对同步放化疗敏感性良好,虽未达到临床完全缓解(cCR)标准,但MRI提示直肠肿瘤明显退缩,肿瘤标志物明显下降。建议继续观察至放疗后12周,同时辅以新辅助化疗,待肿瘤进一步退缩,密切随访影像评估肝脏及直肠病灶。建议行直肠肿块多点穿刺活检,评估肿瘤局部有无病灶残留。
4. 张苏展教授(大肠外科)总结:该患者为低位直肠癌,初诊临床分期为cT4N2M1,经同步放化疗后,直肠肿瘤退缩明显,但肿瘤局部仍有可疑残留,且肿瘤标志物未全部恢复正常水平,目前疗效评估尚达不到cCR标准,疗效评价为PR,肿瘤临床分期ycT0-2N0M0。建议行直肠肿物多点穿刺活检,评估是否有肿瘤残余。患者目前为放疗后7周,考虑原发灶仍有继续退缩可能,且肝脏MRI所示低密度病灶不能除外转移癌,暂不建议行手术治疗,继续XELOX方案两药化疗,观察至放疗后12周,再次评估疗效。
第二阶段后续治疗:
2018年8月24日XELOX方案化疗一次,化疗期间再次出现Ⅱ~Ⅲ度血液学毒性;2018年9月16日因右大腿带状疱疹皮肤科住院治疗两周,停止化疗。治疗后复查(2):2018年10月(放疗结束15周)回院复查。
查体:PS评分1分,双侧腹股沟未及肿大淋巴结;肛门指诊:距肛约2 cm右侧壁可及近半圈质硬肠壁,黏膜光滑,未及明显肿块,指套无染血。
直肠超声造影及穿刺活检:距肛门约2 cm处直肠右前壁可见一低回声结节,厚度约0.5 cm,CDFI示内血流信号较丰富,病灶各期均呈低增强。穿刺活检:肿块处活检2针,取样长度1.5 cm,取出2条约1.0 cm组织。
穿刺病理(图7):(肠壁肿块穿刺标本)平滑肌组织。
直肠MRI:盆底及肛管略水肿,T2信号略微增高,未见明确肿瘤,局部见小结节状DWI稍高信号影。盆腔及腹股沟见小淋巴结。较前片(2018年8月15日)大致相仿。
肝脏MRI(图8):肝Ⅷ段近膈顶处异常信号结节,较2018年8月19日增大,考虑转移瘤可能大;肝Ⅶ段小血管瘤;肝Ⅵ段小囊肿。
胸部CT:两肺多发慢性炎症伴纤维灶考虑,两侧胸膜稍增厚毛糙,较2018年8月14日检查基本相仿。
肿瘤标志物:癌胚抗原(CEA)较前降低3.6 ng/mL、癌抗原(CA19-9)较前明显升高至176.3 U/mL。
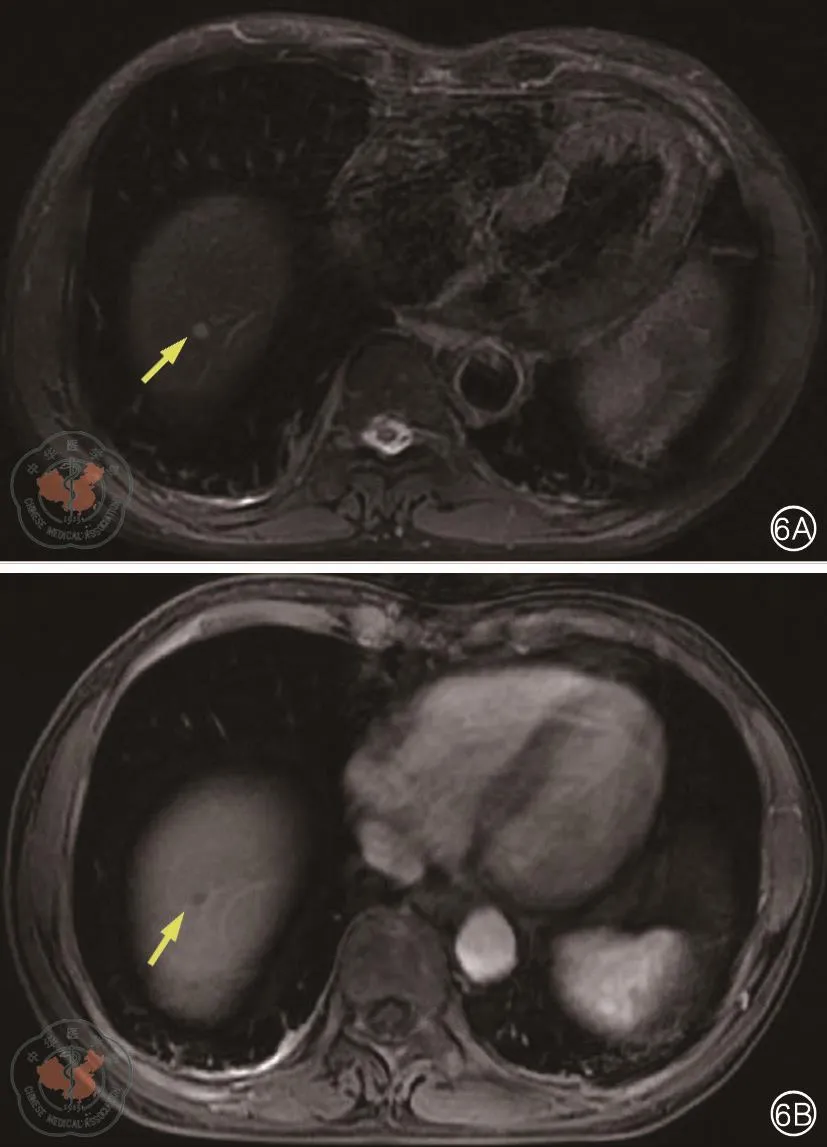
图6 肝脏增强MRI。6A:T2WI,6B:T1WI增强;箭头所示为新发小病灶,边缘强化不明显

图7 直肠穿刺病理活检。经肛直肠超声引导下穿刺瘢痕组织,未见明显癌细胞(10×)
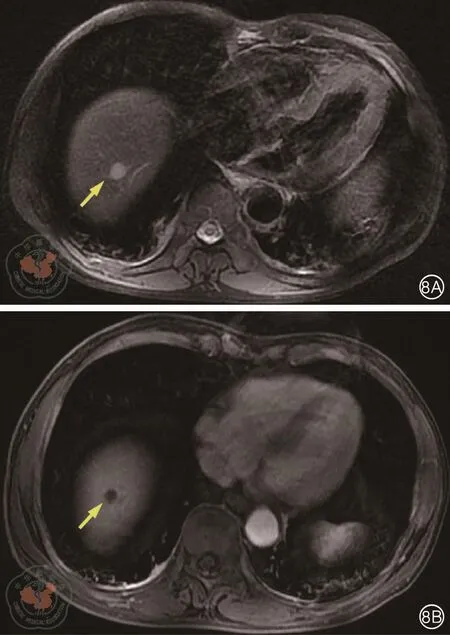
图8 肝脏增强MRI检查。8A:T2WI,8B:T1WI增强;箭头所示病灶较前增大,边缘强化
六、第三阶段MDT讨论荟萃及诊治经过:讨论时间:2018年10月18日
MDT讨论——再次评估直肠原发病灶及肝脏病灶,拟定下一步治疗方案。
1. 王六红副主任医师(放射科):患者原发灶MRI较前相仿,未见明显肿瘤,但T2信号略微增高,局部见小结节状DWI稍高信号影,不能完全除外肿瘤残余。腹股沟未见明显肿大淋巴结。2018年10月14日肝脏MRI提示8月份新发的肝Ⅷ段近膈顶处结节灶,增强后病灶边缘强化,较2018年8月19日增大,考虑直肠癌肝脏转移。肝Ⅶ段及肝Ⅵ段病灶仍考虑为血管瘤和小囊肿。
2. 沈俐副主任医师(放疗科):患者放疗已结束15周,肛门指诊和腹股沟查体未及明显病灶、电子结直肠镜下直肠黏膜光滑、穿刺活检病理未见明显肿瘤证据,但直肠MRI检查仍不能完全除外肿瘤残余,且肿瘤标志物CA19-9较前显著升高。按照cCR判断的标准,直肠影像学评估阴性标准可疑达标,所有升高肿瘤标志物恢复至正常的标准明显未达到,但由于患者肝脏转移灶进展,可能导致肿瘤标志物CA19-9升高,因此不能完全按照现有的五条标准来彻底否认直肠局部肿瘤的cCR状态。建议肝脏肿瘤局部治疗后,动态监测肿瘤标志物水平,可帮助进一步确认直肠肿瘤局部是否已cCR。
3. 任华主任医师(大肠外科):患者初诊为低位直肠癌cT4bN1M1,经局部放疗联合化疗两次结束后7周直肠肿瘤较前明显退缩,疗效评价PR;经MDT讨论后建议继续观察待肿瘤退缩,观察期间再次予以XELOX方案化疗一次,目前为放疗结束15周,直肠肿瘤局部不排除cCR可能,但肝脏转移明显进展。患者化疗耐受性差,每周期化疗后均出现Ⅱ~Ⅲ度血液学毒性,并因为全身免疫力低下导致带状疱疹而中断肿瘤治疗,继续全身化疗可能会进一步加重毒副作用。肝脏转移瘤为单发的肿块,局部治疗手段可以根治,达到NED(no evidence of disease)状态,因此建议手术或者射频消融治疗肝转移瘤。直肠肿瘤局部暂不处理,观察肝转移瘤术后CA19-9是否完全恢复正常,明确直肠肿瘤局部是否临床完全缓解。
4. 袁瑛主任医师(肿瘤内科):患者低位直肠癌初诊cT4N1M1,前期经放疗同步XELOX方案化疗2个周期,再序贯XELOX化疗1个周期,直肠原发病灶和右腹股沟淋巴结接近cCR但是新发肝脏单个转移灶。前期化疗中骨髓抑制明显,并出现带状疱疹。鉴于以上情况以及本人意愿对化疗较为抗拒,虽然前期不太规律的XELOX化疗中出现肝新发转移灶并不能判断为原发性耐药,建议对肝转移灶局部手术或射频治疗。
5. 唐喆副主任医师(肝胆胰外科):患者肝脏转移灶位于肝Ⅷ段近膈顶处,单发,大小约6 mm×6 mm,经腹部US可以准确定位。推荐手术切除或者射频消融治疗,均可达到局部根治目的。射频治疗创伤恢复快,对该患者直肠肿瘤后续治疗干扰小,因此建议该患者行射频消融治疗,术后1个月复查肝脏MRI及肿瘤标志物。
6. 张苏展教授(大肠外科)总结:患者低位直肠癌,局部放疗联合XELOX方案全身化疗后直肠肿瘤明显退缩,直肠肿瘤MRI评估未见明显肿瘤,穿刺未见明显肿瘤证据,但CA19-9持续升高,肿瘤局部未完全达到cCR标准。CA19-9升高不排除肝脏Ⅷ段新发转移瘤所致,可能局部已经cCR,建议肝脏转移瘤局部根治后,术后复查CA19-9。如果CA19-9未恢复至正常水平,考虑直肠肿瘤局部仍有活性;若CA19-9恢复正常,则不排除直肠肿瘤局部已临床完全缓解。肝脏转移灶为单发可切除病灶,考虑患者一般情况,对于肝转移病灶采取创伤尽可能小的局部处理方式,建议射频治疗。
七、 第三阶段后续治疗及随访
经与患者及家属充分沟通,患方选择肝脏病损射频消融术,原发灶及腹股沟淋巴结转移灶随访观察。2018年10月31日患者在全麻下行经皮联合腔镜肝转移瘤射频消融术。手术经过:B超探查肝Ⅷ段表面一枚大小约1.5 cm×1.5 cm低回声结节,予B超引导下用伞状射频导管穿刺,定位满意后展开射频消融针,消融2次,每次5 min。B超探查发现肿块被高回声覆盖。置入腹腔镜探查,腹腔内未见腹膜等肿瘤播散灶,空腔脏器无损伤,肝Ⅷ段肿瘤表面呈凝固样坏死,予射频消融针直视下穿刺肿瘤表面部分,消融3次,每次4 min。
2018年11月16日癌胚抗原(CEA)3.6 ng/mL、癌抗原(CA19-9)76 U/mL。2018年12月7日癌胚抗原(CEA)3.4 ng/mL、癌抗原(CA19-9)41.1 U/mL。2018年12月14日肝脏MRI复查:(图9)肝Ⅷ段转移瘤射频术后,肿瘤未见明显存活,肝Ⅵ段小囊肿。2018年12月19日全身葡萄糖代谢显像:(图10)肝脏近膈顶稍低密度结节影,糖代谢不高,考虑治疗后改变;直肠肠壁未见明显增厚,糖代谢不高,提示局部未见明显活跃肿瘤组织;右腹股沟区皮下糖代谢稍增高,考虑术后反应。再次MDT讨论后建议密切随访。
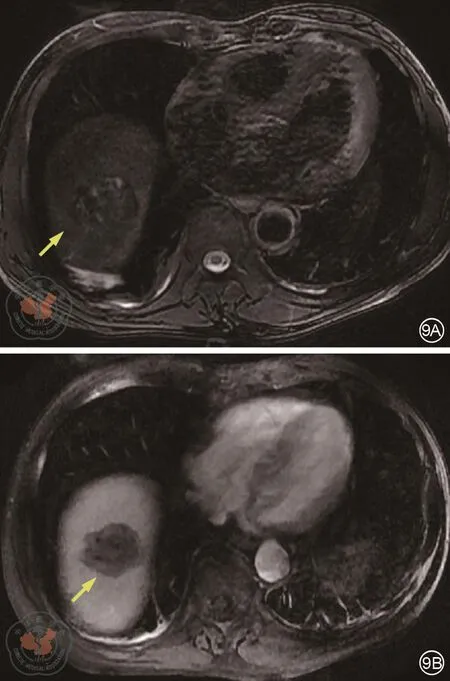
图9 肝脏肿瘤射频消融治疗后肝脏增强MRI检查。9A:T2WI,9B:T1WI,箭头所示为射频消融后肿瘤,无明显影像学存活证据
八、回顾及点评
本次MDT讨论患者初诊为直肠腺癌伴右腹股沟淋巴结转移(cT4bN1M1)。该患者直肠原发灶无明显便血、穿孔及梗阻症状,腹股沟淋巴结转移灶明确。当时根据美国癌症联合委员会(AJCC)第七版,腹股沟淋巴结转移归为M1期。
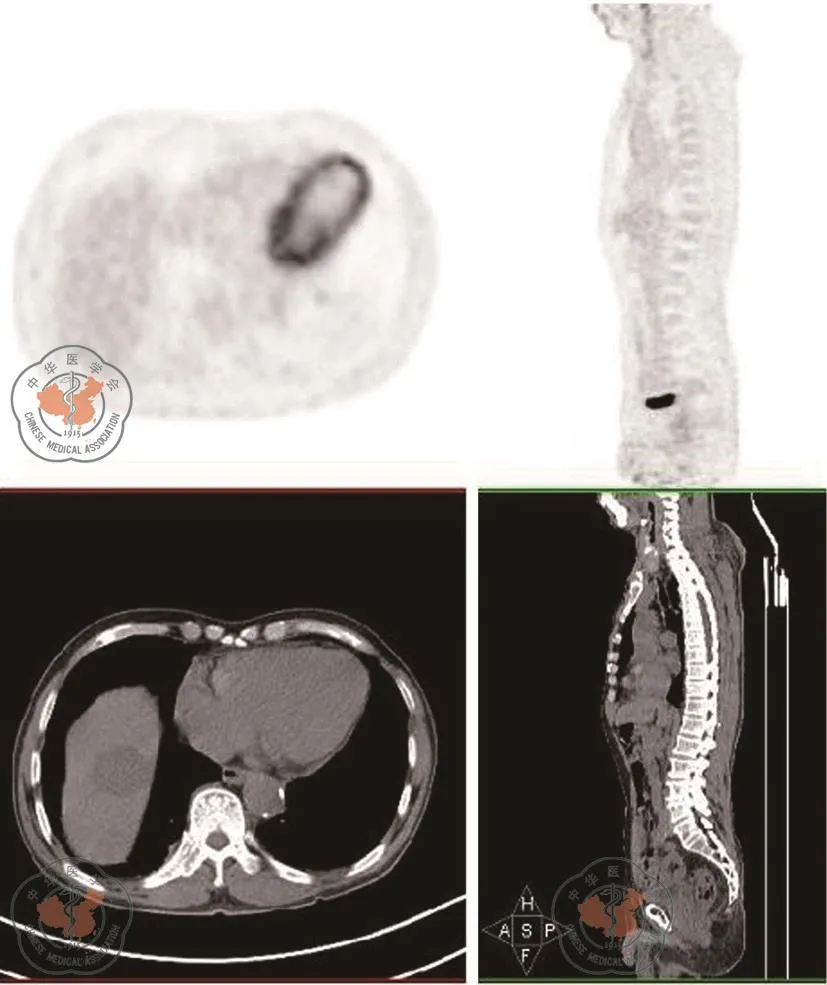
图10 PET-CT检查。肝脏近膈顶稍低密度结节影,糖代谢不高;直肠肠壁未见明显增厚,糖代谢不高
初次MDT讨论,低位直肠腺癌,T分期T3以上,伴有淋巴结转移,环周切缘阳性,遵循NCCN指南有术前新辅助放化疗指征。中低位直肠癌术前放化疗,一为降低肿瘤分期,提高保肛几率,二为降低局部复发率。就此患者而言,肿瘤距肛仅2 cm,放化疗后亦很难有保肛机会,因此主要目的在于降低局部复发率。在经过直肠瘤区及右腹股沟淋巴引流区放疗同步XELOX方案化疗结束7周后,直肠原发灶明显退缩,但肿瘤局部仍有可疑残留,且肿瘤标志物未恢复正常水平,疗效评估为PR,分期为ycT0-2N0M0。第二次MDT讨论的焦点在于是否应对直肠肿瘤进行根治手术,考虑到退缩效果在放疗结束后12周达到最大[1-2],且肝Ⅷ段新发低密度占位不除外转移癌,因此暂缓手术治疗,继续XELOX方案化疗,等待肿瘤退缩,随访肝Ⅷ段病灶性质。在患者接受第三次XELOX方案化疗后,患者出现了带状疱疹而暂停了全身治疗。放疗后第15周随访后进行了第三次MDT,此时直肠肿瘤MRI评估未见明显肿瘤,穿刺未见肿瘤细胞,但CA19-9持续升高,肝Ⅷ段病灶明显增大,因此讨论聚焦于直肠局部肿瘤的疗效评价[3-4]及肝转移治疗。除肿瘤标志物未恢复正常外,其他四项指标包括MRI、直肠指诊、肠镜、穿刺病理均为阴性,但CA19-9升高不排除肝脏Ⅷ段新发转移瘤所致,因此不排除直肠局部已经cCR。患者肝脏转移灶为单发可切除病灶,考虑到前期治疗对化疗的耐受性以及本人意愿对化疗较为抗拒,虽然前期不太规律的XELOX化疗中出现肝新发转移灶并不能判断为原发性耐药,建议对肝转移灶局部手术或射频治疗。患者肝转移病灶接受射频消融术后CA19-9逐渐下降至正常水平,术后影像学评估肝转移灶未见明显存活,PET-CT进一步确认了患者的无瘤状态。那么,患者直肠局部是否还需要进行根治性手术[5]?还是采取Watch and wait的策略[6]?根治性手术在明显降低患者生活质量的同时,能否带来总生存获益?Watch and wait是否需要完成足够的辅助化疗,怎样的随访间期和随访方式最合适[3,7]?这些都是我们需要进一步思考的问题。
(收稿日期019-05-18)
