QuEChERS-超高效液相色谱-串联四极杆飞行时间质谱法同时测定果蔬中19种植物生长调节剂残留
2019-11-06姚恬恬柳英霞万益群
姚恬恬, 刘 翻, 金 鑫, 柳英霞, 万益群,, 郭 岚*,
(1.南昌大学化学学院,江西南昌 330031 2.南昌大学分析测试中心,江西南昌 330047)
植物生长调节剂(Plant Growth Regulators,PGRs)是一类用于调节植物生长发育的农药[1],它们可以增强作物的抗逆性,缩短蔬菜、水果的成熟期,提高产量及改善品质,被广泛应用于现代农业生产。但植物生长调节剂与其他农药一样也具有一定的毒性[2],如2,4-二氯苯氧乙酸(2,4-D)具有急性神经毒性,对皮肤和眼睛有刺激作用,对肝肾有损害[3];多效唑对雄性生殖器官有损伤,有可能是致癌物质[4 - 5];丁酰肼的水解产物二甲基联氨是一种潜在的致癌物等[6]。近年来,滥用及不当使用植物生长调节剂的现象时有发生,已影响到农产品的食用安全,对人民健康造成威胁。因此,开展果蔬中植物生长调节剂残留的快速检测新技术研究,对保证食品安全、促进国民健康及社会经济发展都有十分重要的现实意义。
我国关于植物生长调节剂的多残留检测技术和有关限量标准的基础研究还处于发展初期,多残留同时检测的国家标准尚未建立[7 - 8]。由于食品基质复杂,而植物生长调节剂种类繁多,化学结构和性质各异,且残留水平较低,因此需要采用更有效地样品前处理技术和更为灵敏的检测方法来进行植物生长调节剂多残留分析检测。目前,植物生长调节剂残留的检测方法有酶联免疫法(ELISA)[9]、毛细管电泳法(CE)[10]、离子色谱法(IC)[11]、气相色谱-质谱法(GC-MS)[12]、高效液相色谱法(HPLC)[13]、液相色谱-串联质谱法(LC-MS/MS)[14 - 18]和液相色谱-串联飞行时间质谱法(LC-Q -TOF-MS/MS)[19 - 20]。这些方法各具特色,ELISA法只能测定单一化合物,且假阳性高;CE法的灵敏度虽高,但重现性较差;GC-MS法分析植物生长调节剂,往往需要衍生,操作比较繁琐,周期长;IC和HPLC法的灵敏度较低;LC-MS/MS法灵敏度高,专属性好,是目前植物生长调节剂的主要分析方法。LC-Q-TOF/MS/MS法作为高分辨质谱技术的代表,在质量数精度、全质量数据采集、数据可溯源性和数据库检索等方面有着低分辨质谱无可比拟的优势,已越来越多地应用于多农残检测领域[21 - 22],但目前文献报道涉及植物生长调节剂残留分析的种类较少,难以满足食品安全监测工作的需要。
QuEChERS方法具有快速、简便、经济、高效、稳定和可靠等特点,自2003年引入以来,被广泛用作多残留分析中的样品制备技术[23 - 24]。本文采用QuEChERS法结合UPLC-Q-TOF-MS/MS技术,优化了样品前处理方法以及色谱-质谱分析条件,考察了基质效应,建立了果蔬中19种植物生长调节剂残留的UPLC-Q-TOF-MS/MS分析方法。
1 实验部分
1.1 主要仪器与试剂
Triple TOFTM5600+四极杆飞行时间质谱仪(美国,AB SCIEX公司);UPLC 30A高效液相色谱仪(日本,岛津公司);TGL-16G高速离心机(上海安亭科学仪器厂);MS3涡旋混匀器(德国,IKA公司);DSY-V氮吹浓缩仪(北京东方精华苑);JJ-2组织捣碎匀浆机(常州国华仪器有限公司);PULSE-Analytic超纯水装置(英国,ELGA公司)。
19种植物生长调节剂标准品:赤霉酸、脱落酸、吲哚丙酸、对氯苯氧乙酸、噻苯隆、4-碘苯氧基乙酸、调果酸、2,4-D、萘乙酸、氯吡脲、抗倒胺、环丙酸酰胺、吲哚乙酸、6-苄氨基嘌呤、吲哚丁酸、抗倒酯、多效唑、烯效唑、抑芽唑(纯度≥99.0%,德国Dr.Ehrenstorfer公司)。标准溶液的配制:分别准确称取10 mg各标准品于10 mL棕色容量瓶中,用甲醇溶解并定容,摇匀,配制成1 mg/mL 的单标准储备液,4 ℃保存。根据需要配制系列质量浓度的混合标准工作溶液。乙腈、甲醇(色谱纯,德国默克公司);甲酸(色谱纯,美国TEDIA公司);NH4Ac(色谱纯,美国ACS公司);HAc、NaCl、无水MgSO4均为分析纯(上海国药集团化学试剂有限公司);吸附剂:C18、石墨化炭黑(GCB)和N-丙基乙二胺(PSA)均购自上海安谱公司。水为超纯水(18.2 MΩ·cm)。
1.2 样品前处理
将果蔬样品去皮后匀浆,准确称取10 g匀浆后的样品于50 mL聚丙烯离心管中,加入20 mL HAc-乙腈溶液(1∶99,V/V),同时加入4 g无水MgSO4和1 g NaCl,3 000 r/min涡旋3 min,以4 000 r/min离心10 min。取10 mL上清液于50 mL离心管中,加入150 mg无水MgSO4和700 mg C18+25 mg GCB+50 mg PSA组合净化剂,以3 000 r/min涡旋3 min,再以4 000 r/min离心10 min。取5 mL上清液于玻璃试管中,于40 ℃水浴中氮吹浓缩至近干,残余物用1 mL甲醇超声溶解后,过0.22 μm滤膜,供UPLC-Q-TOF-MS/MS分析。
1.3 色谱分离条件
色谱柱:Shim-pack GIST C18柱(75×2.1 mm,2.0 μm);流动相:A相为水(含5 mmol/L NH4Ac和0.1%甲酸),B相为甲醇。梯度洗脱程序:0 min,5%B;3 min,60%B;16 min,70%B;16.1 min,80%B,保持2 min。流速:0.2 mL/min;柱温:35 ℃;进样量:5 μL。
1.4 质谱条件
离子源:ESI和APCI复合源;正负离子扫描方式;气帘气(CUR)30 psi;雾化气(GAS 1)50 psi;辅助气(GAS 2)50 psi;离子源温度550 ℃。一级质谱:扫描范围100~450 Da;数据采集时间100 ms;去簇电压(DP)80 V;碰撞能(CE)10 V。二级质谱:扫描范围40~450 Da。19种植物生长调节剂的定性、定量离子、喷雾电压(ISVF)、去簇电压(DP)和碰撞能(CE)详见表1。

表1 19种植物生长调节剂的质谱优化参数和保留时间
(续表1)

No.PGRsRetentiontime(min)Ion modePrecursor ionTheoretical(m/z)Found(m/z)Relativedeviation(10-6)Productions(m/z)ISVF(V)DP(V)CE(V)44-Chlorophenoxyacetic acid6.91-185.0011185.00110.2126.9979*4 50016205Thidiazuron7.13-219.0346219.03491.499.9992*70.98414 500142064-Iodophenoxyacetic acid7.62-276.9367276.93690.8218.9354∗126.90654 50019307Cloprop7.87-199.0167199.0165-0.8126.9983*4 500162082,4-Dichlorophenoxyacetic acid8.00-218.9621218.96220.4160.9600*4 50015259Naphthylacetic acid8.04-185.0608185.0607-0.5141.0730*4 500121510Forchlorfenuron8.63-246.0440246.0439-0.4127.0095*91.03154 500151511Inabenfide9.86-337.0749337.0748-0.5231.0381122.0275*4 5002411512Cyclanilide11.78-271.9887271.98901.5229.0039159.9762*4 500213013Indole-3-acetic acid6.25+176.0706176.0705-0.4130.0783*5 5008018146-Benzyladenine6.56+226.1087226.10901.391.0634*65.04445 50010033153-Indolebutyric acid7.39+204.1019204.1017-0.8186.1111*168.08335 500852216Trinexapac-ethyl8.84+253.1071253.10710.2207.086969.0403*5 500902017Paclobutrazol10.40+294.1368294.13690.4125.027570.0471*5 500853318Uniconazole13.03+292.1211292.12120.3125.027170.0466*5 5001152619Triapenthenol13.41+264.2070264.20720.8109.111570.0471*5 5008035
*quantitative product ion.
2 结果与讨论
2.1 色谱分离条件的选择
分别以甲醇-5 mmol/L NH4Ac水溶液、甲醇-0.1%甲酸水溶液和甲醇-5 mmol/L NH4Ac-0.1%甲酸水溶液为流动相,考察三者对19种待测物峰形、离子化效率及分离度的影响。结果表明,以甲醇-5 mmol/L NH4Ac-0.1%甲酸水溶液为流动相,采用梯度洗脱,19种植物生长调节剂灵敏度较高,且分离度和峰形都比较好。19种植物生长调节剂的MRM色谱图见图1。
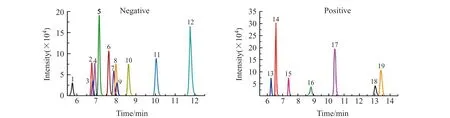
图1 19种植物生长调节剂MRM色谱图Fig.1 MRM chromatograms of the 19 PGRs mixed standard solution1.Gibberellic acid(0.25 mg/L);2.Abscisic acid(0.25 mg/L);3.3-Indolepropionic acid(1.25 mg/L);4.4-Chlorophenoxyacetic acid(0.25 mg/L);5.Thidiazuron(0.05 mg/L);6.4-Iodophenoxyacetic acid(0.25 mg/L);7.Cloprop(0.2 mg/L);8.2,4-Dichlorophenoxyacetic acid(0.25 mg/L);9.Naphthylacetic acid(1.25 mg/L);10.Forchlorfenuron(0.05 mg/L);11.Inabenfide(0.05 mg/L);12.Cyclanilide(0.2 mg/L);13.Indole-3-acetic acid(0.25 mg/L);14.6-Benzyladenine(0.2 mg/L);15.3-Indolebutyric acid(0.25 mg/L);16.Trinexapac-ethyl(0.25 mg/L);17.Paclobutrazol(0.25 mg/L);18.Uniconazole(1.25 mg/L);19.Triapenthenol(0.25 mg/L).Note:1-12 were in negative mode,13-19 were in positive mode.
2.2 质谱条件的优化
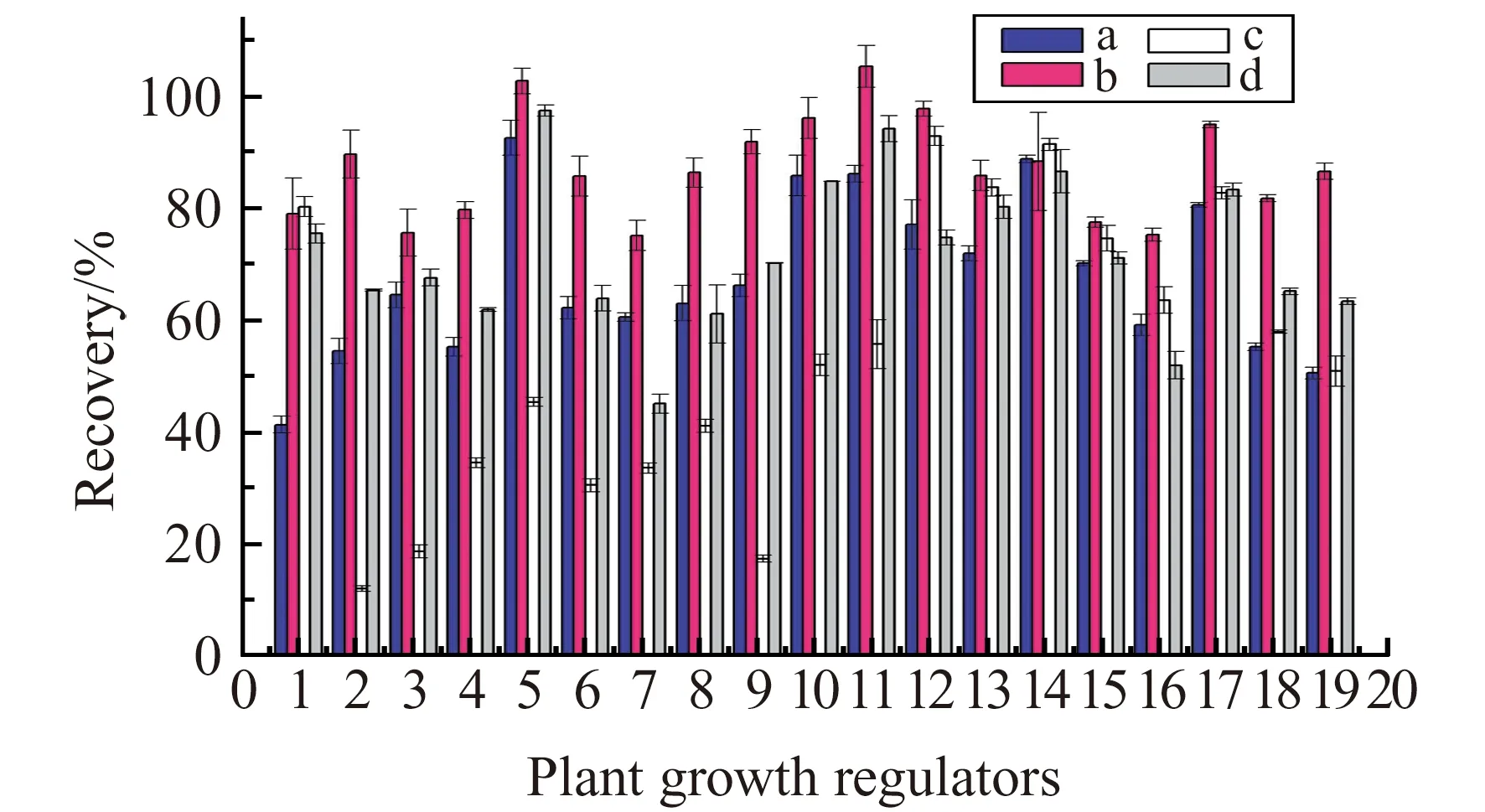
图2 不同提取溶剂对19种植物生长调节剂的提取效率(n=3)Fig.2 Extraction efficientcy of the 19 PGRs with different extraction solvents(n=3)a.acetonitrile;b.acetic acid-acetonitrile(1∶99,V/V);c.methanol-acetonitrile(1∶1,V/V);d.acetic acid-methanol-acetonitrile(1∶50:49,V/V).1-19:the numbers are consistent with Fig.1.
分别在正、负离子模式下进行全扫描,扫描范围m/z40~400,得到19种植物生长调节剂的一级质谱图。对比正、负离子两种模式下的响应强度,为19种化合物分别确定其合适的离子模式,以达到最高的电离效率。选择准分子离子为母离子,在10~120 V的范围内分别优化其去簇电压(DP),以获得最强的母离子信号。在此基础上对各个物质进行二级质谱扫描,得到碎片离子信息,选择丰度相对较高和相对分子质量较大的碎片离子作为定量离子和定性离子,优化碰撞能(CE),建立多反应监测(MRM)模式。优化后的Q-TOF-MS/MS参数如表1所示。
2.3 提取溶剂的选择
比较了乙腈、HAc-乙腈溶液(1∶99,V/V)、甲醇-乙腈溶液(1∶1,V/V)、HAc-甲醇-乙腈溶液(1∶50∶49,V/V)4种提取溶剂对19种植物生长调节剂的提取效果,结果见图2。实验结果表明,采用HAc-乙腈(1∶99,V/V)为提取溶剂,19种植物生长调节剂的回收率在75%~105%之间,优于其他3种提取溶剂。而且对于吲哚乙酸、吲哚丁酸、吲哚丙酸、调果酸、赤霉酸等酸性物质,添加了1%HAc的提取溶剂的提取效率明显提高。这是由于酸性条件下抑制了羧基的电离,从而增加了酸性物质在有机溶剂中的溶解度。另外,实验还发现使用乙腈作为提取溶剂时,共提物明显比用甲醇作提取溶剂的少,因此本实验最终选择HAc-乙腈(1∶99,V/V)为提取溶剂。
2.4 净化条件的优化

图3 19种植物生长调节剂在不同净化剂组合中的回收率(n=3)Fig.3 Recoveries of the 19 PGRs with different purification agent combinations(n=3) 1-19:the numbers are consistent with Fig.1.
与传统的固相萃取方法不同,QuEChERS法采用适当的吸附剂,通过非极性相互作用、极性相互作用、离子相互作用等选择性保留基质中杂质组分,从而达到净化的效果。果蔬基质的共提物主要包括色素、糖类和有机酸等,常用C18、PSA和GCB进行净化[25]。在3种吸附剂中,PSA是一种弱阴离子交换剂,能有效消除提取物中脂肪酸和有机酸的干扰,但对分子结构中含羧基的化合物也有一定的吸附作用;GCB可有效去除色素;C18对非极性物质有很强的吸附作用。实验结果表明,GCB对色素的净化效果最好,其次是PSA,但两者对一些目标化合物有吸附作用,平均加标回收率分别为61.8%和80.6%;而C18能明显减少提取物中基质,而且几乎不吸附目标化合物,平均回收率为105%,但去除色素效果并不明显。因此实验以C18为主要净化剂,加入适量的GCB和PSA,以提高净化效果,同时对目标化合物吸附量最少。选择40 μg/L的加标浓度,考察了(a)800 mg C18+25 mg GCB、(b)700 mg C18+25 mg GCB+50 mg PSA和(c)500 mg C18+25 mg GCB+100 mg PSA 3种条件下的净化效果和加标回收率,结果见图3。其中采用700 mg C18+25 mg GCB+50 mg PSA为净化剂时,19种目标化合物的回收率在75%~118%之间,而且去除色素等基质的效果较好,因此最终选择组合(b)为本实验的净化剂。
2.5 基质效应、线性范围、检出限和定量限
在质谱分析技术中,基质效应是一个常见干扰因子,指样品共提物的基质会影响目标物的离子化,造成目标物在质谱上的响应发生增强或抑制的现象。对其进行合理的评价,并采取适当的方法减少或消除,可以提高测定准确度。文献报道多采用基质匹配校准方法[26 - 27]和同位素内标定量方法[28],而前者更为经济。本文采用相对响应值法(基质效应=空白基质标准响应值/纯溶剂标准响应值)评价了19种植物生长调节剂在不同果蔬中的基质效应,同时还比较了目标物在基质和纯溶剂中保留时间的差异,见表2。实验结果显示,19种化合物在纯溶剂和基质中的保留时间偏差小于2%,基质效应系数超过0.80~1.20范围的目标物数目在橙、葡萄、黄瓜中分别为9、9和1,表明果蔬中的基质效应不可忽略。本实验最终采用空白基质配制标准工作溶液,在优化的色谱和质谱条件下进行分析,以峰面积(Y)对浓度(c)绘制基质校准曲线,并计算其检出限和定量限,见表2。结果表明,19种化合物线性关系良好,其检出限和定量限远低于各国现行残留限量标准,可用于实际样品检测。

表2 19种植物生长调节剂的基质效应、在基质与纯溶剂中的保留时间偏差、在基质中的线性关系、检出限和定量限
(续表2)
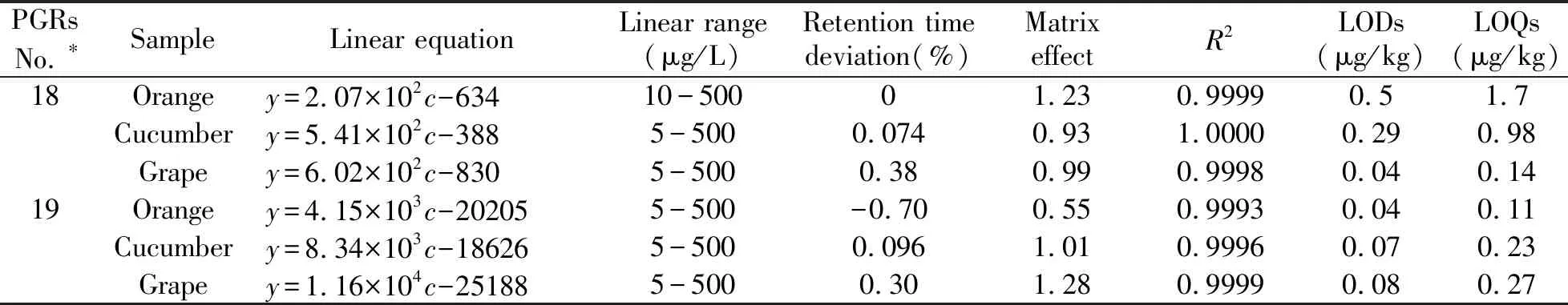
PGRs No.∗SampleLinear equationLinear range(μg/L)Retention timedeviation(%)Matrix effectR2LODs(μg/kg)LOQs(μg/kg)18Orangey=2.07×102c-63410-50001.230.99990.51.7Cucumbery=5.41×102c-3885-5000.0740.931.00000.290.98Grapey=6.02×102c-8305-5000.380.990.99980.040.1419Orangey=4.15×103c-202055-500-0.700.550.99930.040.11Cucumbery=8.34×103c-186265-5000.0961.010.99960.070.23Grapey=1.16×104c-251885-5000.301.280.99990.080.27
*:the numbers are consistent with Fig.1.
2.6 加标回收率和精密度
为了进一步评估该方法的准确度和精密度,对橙、黄瓜和葡萄分别进行了加标回收实验。每种化合物添加3个浓度水平,每个水平做6个平行样品,然后按1.2进行样品前处理,在1.3和1.4的色谱和质谱条件下,基质标准溶液外标法测定,平均回收率和相对标准偏差(RSD)见表3。19种植物生长调节剂在3个添加水平的平均回收率在70.1%~116.2%之间,RSD小于10.6%,表明方法具有良好的准确度和精密度。
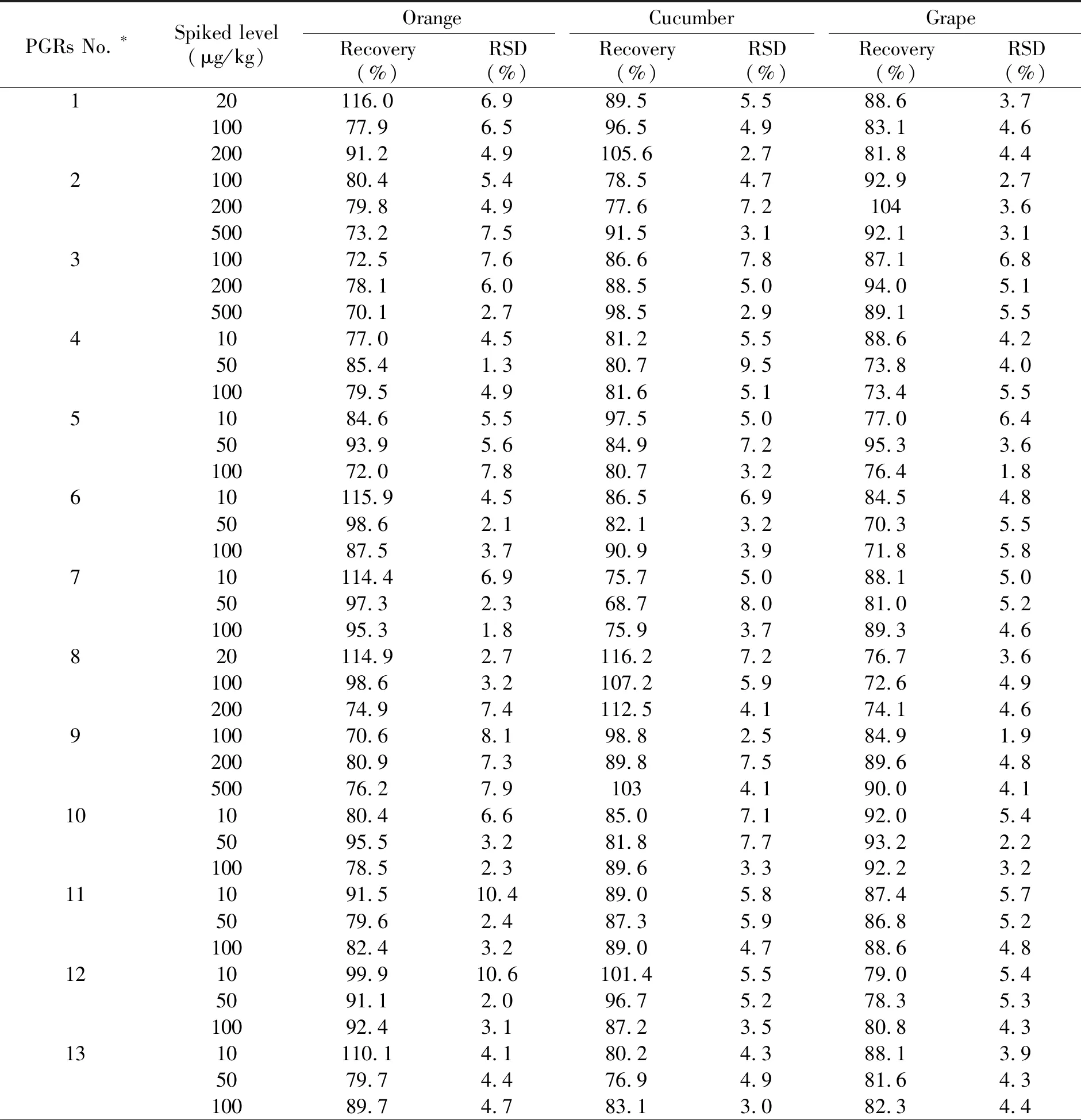
表3 橙子、黄瓜和葡萄中19种植物生长调节剂的加标回收结果(n=6)
(续表3)

PGRs No.∗Spiked level(μg/kg)OrangeCucumberGrapeRecovery(%)RSD(%)Recovery(%)RSD(%)Recovery(%)RSD(%)141073.92.473.75.071.53.15074.93.287.55.071.46.910076.13.475.12.482.85.7151092.15.689.16.496.43.45080.04.193.33.588.84.110088.41.995.53.3100.63.91610115.23.396.44.684.44.35084.35.380.02.691.43.710085.77.292.42.689.15.0171090.15.090.64.6102.13.550112.12.884.58.9109.53.510089.55.695.33.4101.24.0181081.17.895.66.395.73.850109.62.890.85.598.44.810083.62.795.22.1104.83.9191082.05.997.85.582.93.85080.93.393.53.290.03.210076.81.9113.52.7105.05.3
*:the numbers are consistent with Fig.1.
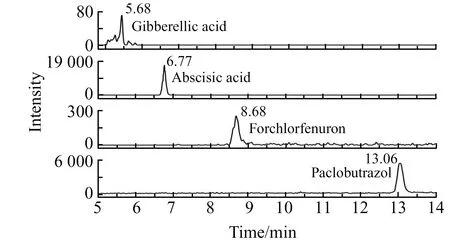
图4 葡萄样品的MRM色谱图Fig.4 MRM chromatograms of grape sample
2.7 样品的测定
应用所建立的分析方法对南昌市售的15批橙、黄瓜和葡萄样品进行分析,样品的MRM色谱图见图4。在15批样品中检测到7种植物生长调节剂:赤霉酸、噻苯隆、氯吡脲、吲哚乙酸、多效唑、烯效唑和脱落酸,其中前6种含量在0.14~13 μg/kg之间,而脱落酸在10批样品中均有检出,含量在6.7~415.4 μg/kg范围内。
3 结论
建立了果蔬样品中19种植物生长调节剂的UPLC-Q-TOF-MS/MS分析方法。样品采用QuEChERS前处理技术,经酸化乙腈提取,C18、PSA和GCB联合净化,利用保留时间和高分辨质谱获得的母离子与子离子的精确质量数对化合物进行定性;MRM模式监测,基质标准溶液外标法进行定量。本方法简单快速、灵敏度高,准确度和精密度都满足方法学指标,可用于果蔬中19种植物生长调节剂的残留分析。
