超高效液相色谱-飞行时间质谱法鉴定鹅源性成分特征肽及其应用研究
2019-11-06李碧芳王韦达刘奕雄杜业刚
李碧芳, 王韦达, 刘奕雄, 李 意,程 诚, 陈 序, 杜业刚*
(1.深圳市计量质量检测研究院,国家营养食品质量监督检验中心(广东),广东深圳 518109;2.郑州大学公共卫生学院,河南郑州 450001)
肉类含人体所需的蛋白质、脂肪和维生素等营养成分,是人们必需的主要副食品之一。从波及欧盟多国的“马肉风波”到国内的“老鼠肉、狐狸肉和水貂肉冒充羊肉”等事件[1],不仅严重损害了消费者的权益,同时也带来了诸多食品安全隐患,还可能涉及宗教信仰问题,引发社会的不安定因素。近年来,用于物种鉴别和食品鉴定的方法在食品工业领域和监管机构中得到越来越多的关注[2]。肉类真实性鉴别最常用的检测方法主要有聚合酶链式反应(PCR)[3 - 6]和酶联免疫吸附(ELISA)[7 - 8]技术。但这两种方法都存在一定的弊端,核酸的降解和肉品的复杂基质会影响PCR检测结果的准确性,而ELISA易发生物种间的交叉反应产生假阳性结果[9],而且无法实现多个物种的同时检测。
伴随着生物质谱技术的飞速发展,基于质谱的蛋白质组学研究日渐成熟,以肽生物标志物为基础的蛋白质组学技术为肉类物种鉴定提供了一种新思路。通过高分辨质谱对蛋白质的酶解肽段进行分离鉴定,寻找不同物种的专属特征肽,再利用高效液相色谱-串联质谱提取特征肽的离子对信息进行定性和定量,从而实现对肉类物种的真实性鉴定。这种方法具有高稳定性、高灵敏度、高准确性和高通量等其它方法无可比拟的优越性[10],已成功应用于鸡肉、鸭肉、猪肉、牛肉、羊肉和马肉等成分的鉴别[11 - 16]。相比之下,有关鹅肉成分鉴定的研究却极少[17]。本研究基于蛋白质组学,建立了鹅源性成分鉴别的高效液相色谱-串联质谱分析方法。
1 实验部分
1.1 仪器与设备
EkspertTM nanoLC 400纳升液相色谱-飞行时间质谱联用仪(TripleTOF©6600,美国AB SCIEX公司);Acquity UPLC©超高效液相色谱仪(美国,Waters公司);QTRAP©6500+三重四极杆-线性离子阱复合质谱仪(美国,AB SCIEX公司);Heraeus Fresco 21型冷冻离心机(美国,Thermo Scientific公司);3-30 K型高速冷冻离心机(德国,Sigma公司);DNP-9272型电热恒温培养箱(上海精宏实验设备有限公司);BC-1000涡旋振荡器(深圳逗点生物技术有限公司);CPA224S型分析天平(德国,Sartorius公司);低蛋白吸附离心管(1.5 mL,德国Eppendorf公司);刻度离心管(10 mL,美国Axygen Scientific公司);超滤离心管(Membrane:10,000 MWCO HY,德国Sartorius公司)。
1.2 材料与试剂
碳酸氢铵(分析纯,国药集团化学试剂有限公司);硫脲(Reagent Plus©≥99.0%,美国Sigma-Aldrich公司);3-[3-(胆酰胺丙基)二甲氨基]丙磺酸内盐(CHAPS)(Ultra Pure,VWR Life Science)、尿素(VWR Life Science)、二硫苏糖醇(DTT,Biotechnology)、碘乙酰胺(IAA,Proteomics)(美国Amresco公司);测序级修饰胰蛋白酶(Porcine,美国Promega公司);Bradford蛋白浓度测定试剂盒(生工生物工程上海股份有限公司);乙腈、水(质谱纯,德国Merck公司);甲酸(质谱纯,美国Thermo Fisher公司)。实验前处理用水均为超纯水。
鸡肉、鸭肉、鹅肉、猪肉、牛肉和羊肉样品均为市售。
1.3 样品处理
1.3.1 蛋白质提取称取1 g切碎后的肉类样品于10 mL离心管中,加入5 mL蛋白裂解液(7 mol/L 尿素,2 mol/L硫脲,4%CHAPS),涡旋振荡过夜,以14 000 r/min离心20 min,取上清液至低蛋白吸附离心管中备用。采用Bradford法测定上清液蛋白浓度。
1.3.2 蛋白质酶解根据测定的蛋白浓度,移取适量上清液到低吸附离心管中,加入尿素水溶液(8 mol/L)至200 μL,加入4 μL DTT水溶液(1 mol/L),置于37 ℃恒温反应1 h。冷却至室温后加入20 μL IAA水溶液(1 mol/L),避光反应1 h。将上述反应液转移至超滤离心管中,于8 ℃、14 000 r/min离心40 min,除去多余的IAA和盐类等小分子成分,并用碳酸氢铵溶液(100 mmol/L)洗涤超滤膜上的蛋白3次(100 μL×3)。向超滤管中加入100 μL碳酸氢铵溶液(100 mmol/L)和10 μL胰蛋白酶溶液(1∶40),轻轻摇匀,置于37 ℃恒温酶解5 h,8 ℃、14 000 r/min离心40 min,加入90 μL碳酸氢铵溶液(100 mmol/L)洗涤一次,收集滤液,待质谱分析。
1.4 NanoLC-TOF MS条件
色谱条件:Eksigent NanoLC trap C18色谱柱(0.5 mm×350 μm,3 μm),Eksigent C18色谱柱(150 mm×75 μm,3 μm)。流动相A为含0.1%甲酸水溶液-乙腈(98∶2,V/V),B为乙腈-含0.1%甲酸水溶液(98∶2,V/V)。梯度洗脱程序:0~0.5 min,95%~92%A;0.5~50 min,92%~76%A;50~65 min,76%~68%A;65~74 min,68%~50% A;74~75 min,50%~20% A;75~80 min,20% A;80~81 min,20%~95% A;81~90 min,95% A。流速:300 nL/min;进样体积:2 μL。
质谱条件:采用纳升电喷雾离子源(NanoESI),正离子扫描模式,喷雾电压2.3 kV;加热温度150 ℃;气帘气压力206.84 kPa,雾化气压力41.37 kPa;质谱数据采集使用信息依赖的工作模式(Information Dependent Analysis,IDA)同时进行动态背景扣除。一级TOF-MS单张图谱扫描时间为250 ms,扫描范围:m/z350~1 500;每次IDA循环最多采集30张电荷为2+~5+且单秒计数大于150的二级质谱,每张二级质谱的累积时间为50 ms,每次循环时间为1.8 s。
1.5 UPLC-MS/MS条件
色谱条件:Agilent Eclipse Plus C18色谱柱(100×2.1 mm,1.8 μm),柱温:35 ℃。流动相A为0.1%甲酸,流动相B为乙腈。梯度洗脱程序:0~0.5 min,95%A;0.5~4 min,95%~65% A;4~7 min,65%~50%A;7~8 min,50%~10%A;8~10 min,10%A;10~10.5 min,10%~95%A;10.5~12 min,95%A。流速:0.3 mL/min;进样体积:4 μL。
质谱条件:采用电喷雾离子源(ESI)源,正离子扫描以多反应监测(MRM)模式检测;喷雾电压:5.5 kV;离子源温度:550 ℃;气帘气压力:276 kPa;雾化气压力:379 kPa;辅助气压力:379 kPa。
2 结果与讨论
2.1 酶解时间优化
胰蛋白酶在pH为8.0、温度为37 ℃时的作用能力最强,因此酶解反应在pH相近的碳酸氢铵溶液中进行,温度控制在37±0.5 ℃左右。在上述实验条件下,酶解的时间是影响蛋白质水解程度的重要因素,实验考察了酶解2、4、6、8、15 h(过夜)后质谱记录的各特征肽段的检测浓度。结果表明,鹅肉样品的酶解时间为4 h时,各肽段的检测浓度达最高值且随后趋于平衡。为了充分水解蛋白质并缩短实验前处理时间,酶解的反应时间选为5 h。
2.2 数据分析
2.2.1 特征肽段的筛选特征肽段是指某一个蛋白质所特有的肽段序列[18],在蛋白质组学研究中可作为区分物种属性的生物标志物。特征肽段的选择一般遵循以下原则[19 - 20]:以含7~25个氨基酸长度的肽为宜;不含错切或漏切的酶切位点,对于丰度较高的肽段可接受一个漏切位点;要具有稳定的物理化学性质;质谱检测分析时具有较好的灵敏度和峰形。借助于纳升液相色谱-串联飞行时间质谱仪对酶解后的多肽溶液进行Full MS-IDA扫描,得到高准确质量数的质谱数据。将数据导入蛋白质搜索软件ProteinPilotTM,参数设置为:Sample Type:Identification;Cys Alkylation:Iodoacetamide;Digestion:Trypsin;Instrument:TripleTOF 6600;ID Focus:Biological modifications;Unused ProtScore(Conf)>0.05(10.0%);Run False Discovery Rate Analysis,并在Uniprot蛋白数据库中进行比对检索。本文详细比较了鸡肉、鸭肉、鹅肉、猪肉、牛肉和羊肉这些常见物种的多肽序列,找到60条只存在于鹅肉样品中的备选特征肽段,然后在NCBI网站上进行blast分析,去掉非特异性的肽段,最后留下7条特异性肽段。利用Skyline软件导出上述7条异性肽段的MRM离子对信息,并对离子对的碰撞能量进行优化,建立UPLC-MS/MS方法。肽段序列和MRM参数见表1。

表1 鹅肉的特征肽段及MRM离子对信息
*Quantitative ion.DP:declustering potential.CE:collision energy.
多肽碎片离子的二级质谱是鉴定特征肽段序列的重要指标,其实际检测结果和理论预测的断裂方式越吻合,此肽段的可信度越高。以鹅肉的特征肽段FFEAVYPIEAR(peptide4)为例,如图1所示,实验获得了7个与理论断裂方式相符且信号响应极强(>103)的y碎片离子和2个高信号响应(>103)的b碎片离子,证明该肽段具有很高的置信度,可用于MRM的验证分析。

图1 Peptide 4的二级质谱图(括号内m/z是理论值,括号外m/z是实测值)Fig.1 Diagram of MS2 fragmentation of peptide 4(theoretical ion m/z values were shown in parentheses and observed m/z values were shown outside parentheses)
2.2.2 特征肽段的特异性验证通过高分辨质谱和数据库检索筛选到的特征肽段,需经过质谱的MRM检测来验证其特异性。选取鸡肉、鸭肉、鹅肉、猪肉、牛肉和羊肉样品酶解后进行测定,考察各样品中特征肽段离子对的保留时间、子离子匹配度及响应强度,选择仅在鹅肉样品中存在的离子对信息,以准确说明该物种的存在性。经过实验确认,前述7条特征肽段在鸡肉、鸭肉、猪肉、牛肉和羊肉样品均未检出,而在鹅肉样品中全都有质谱信号检出,如图2所示。结果说明所筛选的7条鹅肉特征肽段具有特异性,据此所建立的液相色谱-串联质谱方法具有准确性和可靠性。
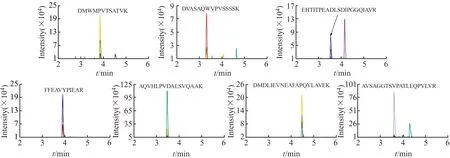
图2 鹅肉特征肽段的提取离子流色谱图Fig.2 Extracted ion chromatograms of marker peptides in goose
2.3 定量研究
本实验将鹅肉和鸭肉分别提取的多肽溶液,按照质量分数5%、10%、20%、40%、60%和90%的比例依次进行混合,通过UPLC-MS/MS的MRM模式扫描,选择无背景干扰峰且信号响应较强的离子对(表1)绘制标准曲线,考察特征肽段的信号响应与鹅肉含量的相关性。结果如表2所示,肽段peptide 6的离子对信号响应较低且线性相关性较差,不适用于定量分析,其余各特征肽段的标准曲线相关性系数均大于0.99,可用于鹅肉成分的定量分析。以10倍仪器检测信噪比确定方法的定量限,鹅肉的定量限为5%。另外,我们以合成的特征肽段配制成不同浓度的溶液,以10倍仪器检测信噪比测得各肽段定量限的绝对值在3.5~6.0 fmol之间。
将鹅肉和鸭肉按照质量分数30%、50%和70%的比例进行混合制备肉样,按照1.3的实验步骤进行前处理,以优化色谱-质谱条件分析,将测得的数据带入标准曲线进行计算,得出鹅肉的含量比例,以验证方法的准确性和稳定性。结果如表3所示,回收率在71%~121%之间,测定值与实际比例相符,精密度(RSD)小于10%,重复性较好,说明使用该方法能够可靠地测定鹅肉成分的含量。
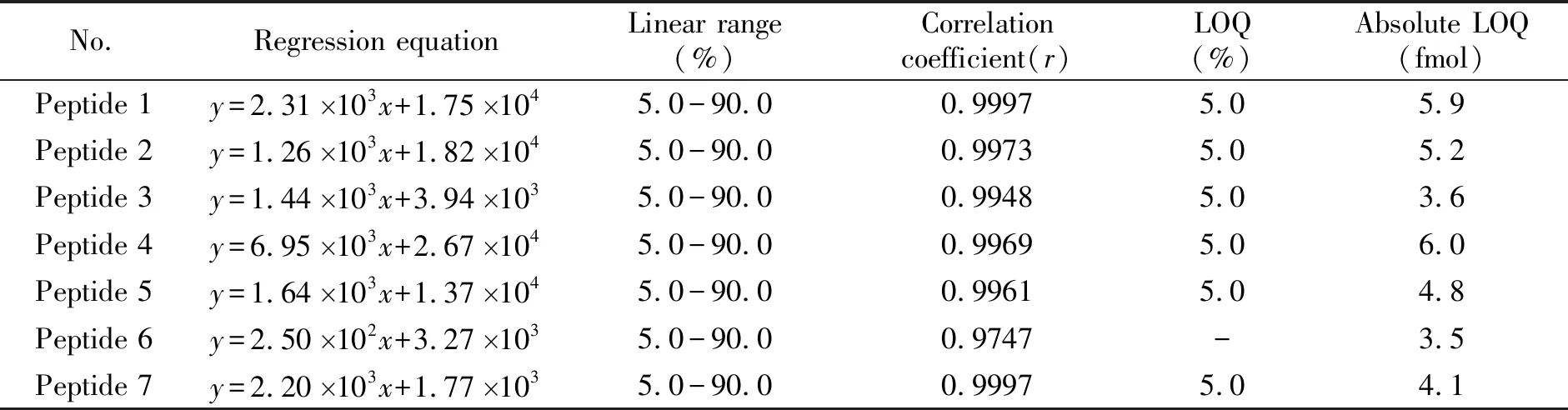
表2 鸭肉中鹅肉含量的线性关系、定量限及特征肽段定量限的绝对值
y:peak area.x:mass percentage,%.

表3 鸭肉中鹅肉含量的测定值、回收率和精密度
2.4 实际样品检测
应用建立的方法对购自不同酒店的12份鹅肉、5份鸭肉和3份鸡肉样品进行了检测,以验证方法的适用性。结果显示,7条特征肽段在本次鹅肉样品中都有检出,而在鸭肉和鸡肉样品中并未检出,进一步证明该方法具有特异性,适用于鹅源性成分的鉴定。
3 结论
本研究利用纳升高效液相色谱-串联飞行时间质谱平台,结合蛋白质检索软件筛选出鹅的备选特征肽段,利用skyline软件导出的质谱参数,建立了MRM检测方法,并对备选特征肽段进行验证,最终确证了7条鹅源性特征肽段。另外,所筛选的特征肽段中有6条肽的质谱信号与鹅肉含量呈线性相关,能够准确地定量鹅肉成分。
