microRNA-513b-5p通过抑制αB-crystallin促进晶状体细胞氧化应激和凋亡
2019-11-05张爱华
张爱华
年龄相关性白内障是一种老年多发性眼病,由晶状体功能紊乱引起,严重者可致盲,严重影响患者的生活质量。随着年龄增加,氧化应激、紫外线损伤、钙蛋白酶激活、细胞凋亡等因素已被证明与内障发病具有密切联系[1,2]。然而到目前为止,对于白内障发病机制的认识不统一,仍需进一步探索。
αB-晶状体蛋白(αB-crystallin,编码基因CRYAB)是晶状体组织中最关键的蛋白之一,其基本功能是识别并结合有聚集倾向的非天然蛋白质或蛋白质折叠过程中的中间产物,稳定靶蛋白分子的构象,防止形成不可逆的蛋白质聚集产物[3~5]。因此,αB-crystallin对细胞内蛋白质的数量和质量的稳定以及细胞内环境的稳定有着十分重要的作用,近年来发现αB-晶状体蛋白参与多种细胞生理和应激过程,表现出某种抗组织细胞损伤的保护功能,在白内障中发挥关键保护作用[6, 7]。
microRNA(miRNA)已被发现在白内障晶状体上皮细胞氧化中发挥关键作用[8]。例如miR-138通过下调人晶状体上皮细胞抗氧化应激的能力,抑制人晶状体上皮细胞增殖和修复参与年龄相关性白内障的发展[8]。另外,αB-crystallin已被证明可作为miRNA的靶基因,对肿瘤细胞发挥调控作用[9]。miR-513b-5p是一种新发现的促凋亡调控分子,在睾丸癌细胞中发挥多种关键功能[10]。通过严格的生物信息学分析,笔者推测αB-crystallin可能在晶状体组织中作为miR-513b-5p的靶基因发挥作用。本研究拟在年龄相关性白内障组织和晶状体上皮细胞中探究miR-513b-5p是否通过调控αB-crystallin对细胞凋亡和氧化应激发挥作用。
材料与方法
1.临床资料与样本:收集2016年6月~2018年3月,复旦大学附属中山医院青浦分院眼科住院行混浊晶体摘除的白内障患者15例(白内障组)。白内障组纳入标准及入组例数:除白内障外无其他眼科病变,无肿瘤发生;实际纳入男性9例,女性6例,平均年龄64.80岁。对照组(control组)纳入标准及入组例数:复旦大学中山医院因受伤行眼球摘除的健康者透明晶状体组织10份(男、女性来源各5份,平均年龄61.25岁)。白内障组与对照组年龄比较差异无统计学意义(P> 0.05),说明两组间具有可比性。两组晶状体组织特征:对照组所有晶状体均呈清亮状,无混浊,白内障组所有晶状体组织呈现明显灰白色浑浊。研究资料中所涉及的所有志愿者均已签订知情同意书。
2.细胞培养:人晶状体上皮细胞系(SRA01/04)购自美国典型培养物保藏中心(ATCC)。细胞使用DMEM培养液和10%的FBS常规培养于37℃含5% CO2的培养箱中。
3.细胞处理和细胞转染:待细胞融合率达到80%后,将细胞浓度调整为1×106,对SRA01/04细胞转染miR-513b-5p的拟似物mimic或者阴性controlmimic-NC 24h(上海碧云天生物技术有限公司)。单独使用H2O2诱导1h,或者SRA01/04细胞转染miR-513b-5p抑制剂inhibitor或阴性controlinhibitor-NC 24h的基础上继续使用400μmol/L H2O2诱导1h。联合使用拟似物mimic和αB-crystallin稳定过表达质粒cDNA3.1-αB-crystallin(c-CRYAB)共转染细胞(mimic+c-CRYAB),或者与阴性controlcDNA3.1-null(c-null)共转染细胞(上海碧云天生物技术有限公司)。
4.实时定量PCR(RT-qPCR):对各组细胞或者组织进行裂解,TRIzol法抽提细胞总RNA,M-MLV反转录试剂盒合成cDNA,miRNA反转录使用miScript反转录试剂盒合成。cDNA特定RNA产物的产量检测使用SYBR®Green Master Mix,U6(miRNA)为内参对miR-513b-5p的表达量进行标准化处理。反应体系(20μl):10μl SYBR,2.0ng模板cDNA,正反向引物浓度均为20μmol/L,体积为0.8μl,最终使用灭菌蒸馏水加至20μl。PCR过程:40个循环, 94℃,1min;54℃,1min;聚合72℃,1min;延伸 72℃,7min。引物序列见表1。miR-513b-5p的相对表达使用公式2-ΔΔCt计算。

表1 引物序列表
5.Western blot法检测:细胞加入蛋白裂解液以裂解细胞,BAC法检测蛋白浓度。配制SDS-PAGE凝胶后行蛋白电泳后将凝胶中蛋白转移至PVDF膜,5%脱脂奶粉封闭3h,分别使用相应的一抗rabbit anti-αB-crystallin(ab13497,1∶800)、anti-ROS (ab5512,1∶900)、anti-SOD (ab83108,1∶900)、anti-c-caspase3(ab214430,1∶600)anti-GAPDH(ab9485,1∶8000)进行孵育,孵育过夜后PBS洗涤3次,每次10min,随后使用辣根过氧化物酶HRP anti-rabbit IgG(1∶10000)室温孵育1h。使用ECL化学发光液进行显色。灰度值使用Image J V1.49软件进行分析。
6.细胞凋亡率检测:使用细胞凋亡 ELISA试剂盒(德国Roche Diagnostics公司)。各组细胞转入96-孔板。使用200μl裂解缓冲液对细胞进行裂解30min。细胞质溶解物转入双抗涂抹的细胞板中,加入Anti-DNA-POD和Anti-histone-biotin 孵育2h。使用酶标仪检测405nm和490nm 波长的吸光度值。
7.荧光素酶报告基因实验:使用miRNA-target gene预测网站TargetScan(http://www.targetscan.org)和miRDB(http://mirdb.org)预测miR-513b-5p与CRYAB的结合关系。进一步,笔者构建荧光素酶报告质粒对该预测的结合关系进行荧光素酶报告分析。对CRYAB的3′-UTR 区的mRNA亚克隆进入pmirGLO载体(美国Promega公司)从而构建形成pmirGLO-Luc-CRYAB-3′UTR 野生型报告基因。使用lipofectamine 2000(美国Life Technologies公司)将报告质粒转入SRA01/04细胞转染48h。Dual-Glo荧光素酶活性检测试剂盒(美国Promega公司)检测荧光素酶活性,使用海肾荧光素酶的活性进行标准化处理。

结 果
1. 白内障患者晶状体组织中miR-513b-5p 和αB-crystallin的表达变化:检测晶状体组织中miR-513b-5p和αB-crystallin的表达变化。首先利用RT-qPCR方法检测对照组和白内障组中miR-513b-5p 和αB-crystallin的表达变化。与对照组比较,白内障组中miR-513b-5p的水平上调,而αB-crystallin的mRNA水平下调,差异均有统计学意义(P<0.05,图1A、B);其次利用Western blot法检测αB-crystallin的蛋白水平变化,结果发现与对照组比较,αB-crystallin的蛋白水平下调,差异有统计学意义(P<0.05,图1C、D)。
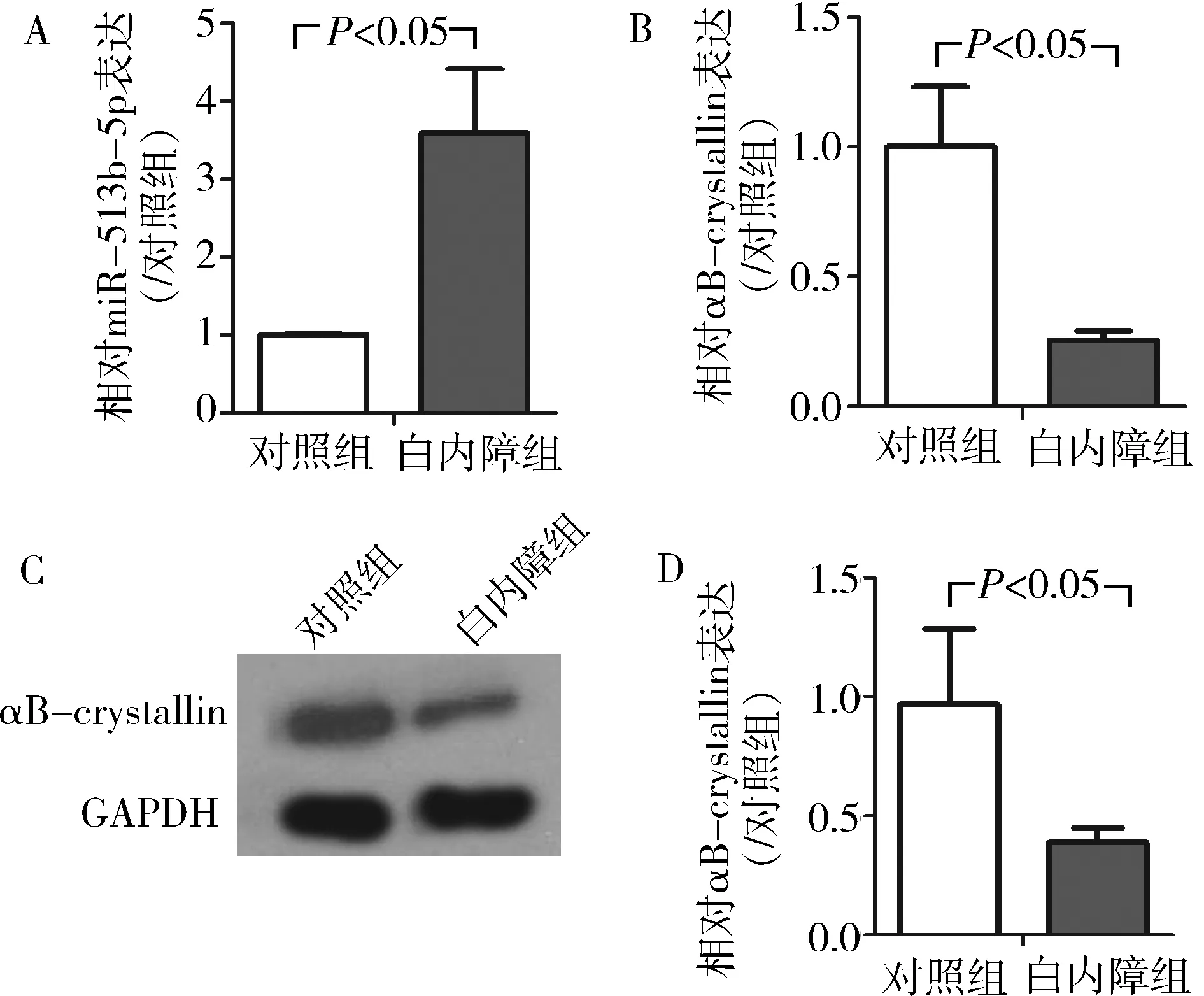
图1 白内障患者晶状体组织中miR-513b-5p和αB-crystallin的表达A.miR-513b-5p;B.αB-crystallin的mRNA水平相对表达变化;C.αB-crystallin与GAPDH的Western blot法条带;D.αB-crystallin的蛋白相对表达柱形图;n=3
2.人晶状体上皮细胞中过表达miR-513b-5p抑制αB-crystallin的表达:对人晶状体上皮细胞系(SRA01/04)稳定转染miR-513b-5p的拟似物mimic,即mimic组,该组分别与未添加mimic的阴性对照组(mimic-NC组)和对照组比较发现,mimic组的miR-513b-5p水平上调,差异均有统计学意义(P<0.05,图2A),mimic-NC与对照组比较,miR-513b-5p的水平变化,差异无统计学意义(P>0.05,图2A),成功地过表达了miR-513b-5p。另外对αB-crystallin蛋白水平变化检测结果发现,分别与mimic-NC组和对照组比较,mimic组的αB-crystallin的蛋白下调,差异均有统计学意义(P<0.05,图2B),mimic-NC与对照组比较,αB-crystallin的蛋白水平变化,差异无统计学意义(P>0.05,图2B)。对SRA01/04细胞转染miR-513b-5p的抑制剂inhibitor(inhibitor组),24h后发现inhibitor可以显著抑制miR-513b-5p的水平(P<0.05,图2C)。另一组未添加该抑制剂(inhibitor-NC组)。Western blot法检测αB-crystallin蛋白表达水平,结果发现与对照组比较,inhibitor组的αB-crystallin表达上调,差异有统计学意义(P<0.05,图2D);inhibitor-NC组的αB-crystallin表达与对照组比较,差异无统计学意义(P<0.05,图2D)。
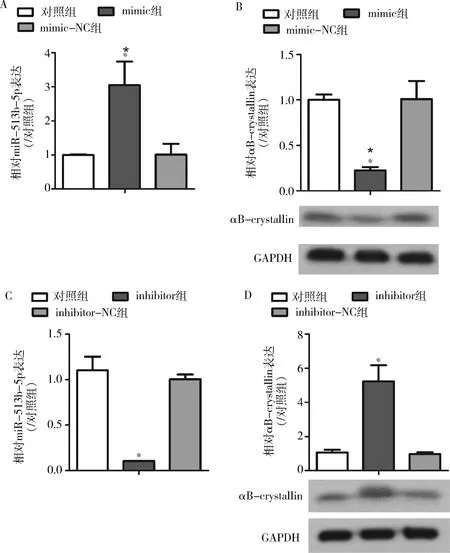
图2 人晶状体上皮细胞中调节miR-513b-5p水平对αB-crystallin表达影响A.miR-513b-5p的相对表达变化;B.αB-crystallin的蛋白水平相对表达变化;C.miR-513b-5p的相对表达变化;D.αB-crystallin的蛋白水平相对表达变化; 与对照组比较,*P<0.05,n=3
3.miR-513b-5p促进人晶状体上皮细胞氧化应激:使用inhibitor转染SRA01/04细胞24h,并继续对细胞进行400μmol/L H2O2诱导1h(inhibitor+H2O2组),而inhibitor-NC组也添加400μmol/L H2O2(inhibitor-NC+H2O2组)以作对比。通过Western blot法检测活性氧(ROS)和超氧化物歧化酶(SOD)的表达水平变化来评估SRA01/04细胞的的氧化应激反应。结果发现,与单独H2O2组比较,inhibitor+H2O2组中ROS的表达水平下降,差异有统计学意义(P<0.05,图3A),而inhibitor-NC+H2O2组的差异无统计学意义(P>0.05,图3A)。Western blot法检测SOD表达水平的结果发现,与单独H2O2组比较,inhibitor+H2O2组中SOD的表达水平上调,差异有统计学意义(P<0.05,图3B),而inhibitor-NC+H2O2组的差异无统计学意义(P>0.05,图3B)。另外,与对照组比较,mimic组中ROS表达水平上调,且SOD表达水平下调,差异均有统计学意义(P<0.05,图3C),而与单独H2O2组比较,mimic组的ROS表达水平变化差异无统计学意义(P>0.05,图3C)。
4.miR-513b-5p促进人晶状体上皮细胞的凋亡:通过测定细胞凋亡率和c-caspase3蛋白表达水平考察miR-513b-5p过表达对SRA01/04细胞凋亡的作用。与对照组比较,mimic组的细胞凋亡率和c-caspase3蛋白水平上调,差异均有统计学意义(P<0.05,图3D、E),而mimic-NC组与对照组比较,细胞凋亡率和c-caspase3蛋白水平变化差异无统计学意义(P>0.05,图3D、E)。miR-513b-5p可促进人晶状体上皮细胞的凋亡。
5.αB-crystallin是miR-513b-5p的靶基因:通过Targetscan及Targets and Expression生物信息学软件预测,αB-crystallin很有可能是miR-513b-5p的靶基因(图4A)。为了进一步证实这一预测,采用荧光素酶报告基因实验验证miR-513b-5p与αB-crystallin的关系。构建野生型(WT)及突变型(mut)的αB-crystallin(CRYAB) 3′-UTR并克隆到荧光素酶报告基因下游,与对照组比较,miR-513b-5p下调WT- CRYAB的3′-UTR水平,差异有统计学意义(P<0.05,图4B)。然而与对照组比较,miR-513b-5p对mut-CRYAB的3′-UTR水平无改变,差异无统计学意义(P>0.05,图4B),在人晶状体上皮细胞中CRYAB是miR-513b-5p的下游靶基因。
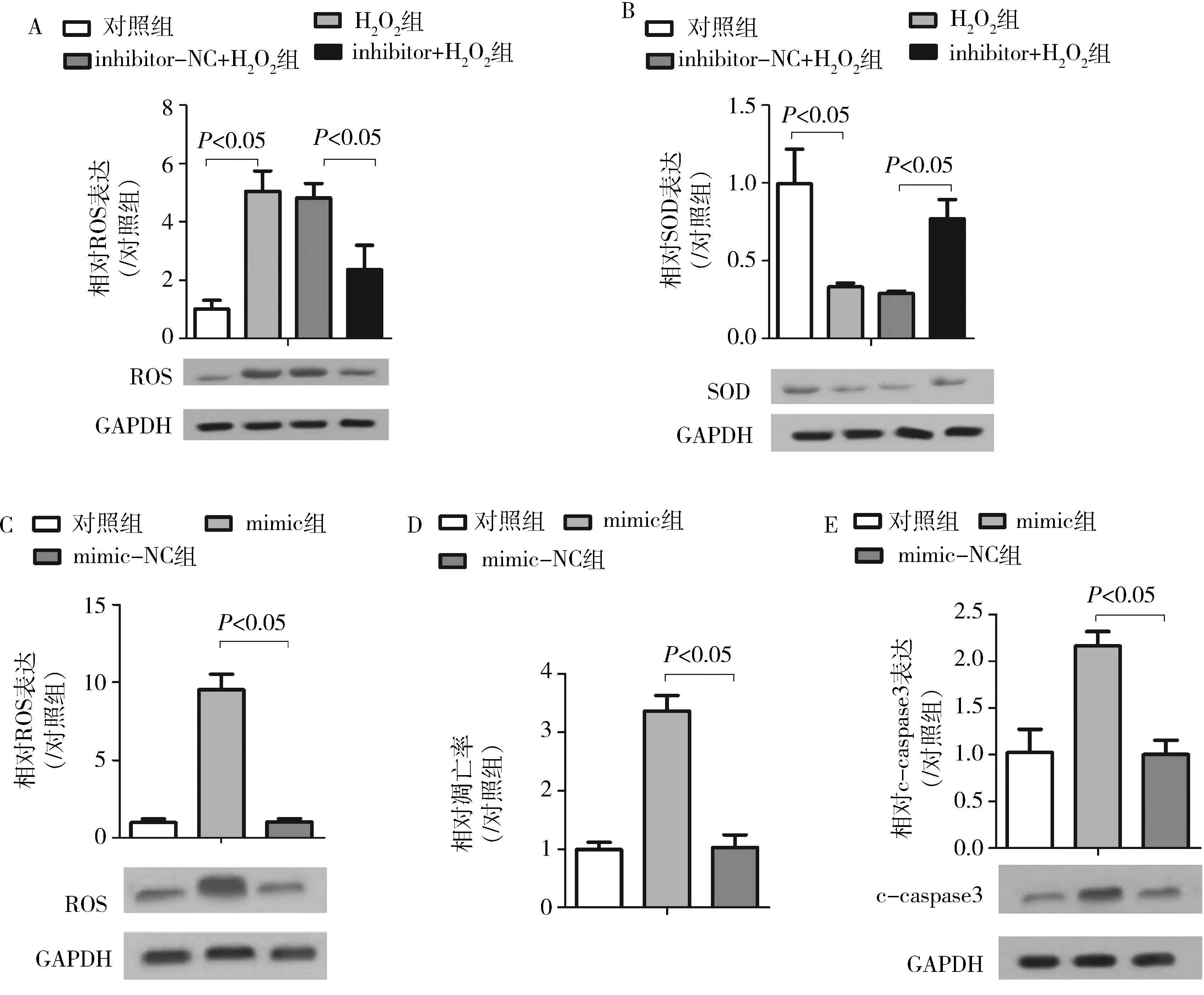
图3 miR-513b-5p对晶状体上皮细胞氧化应激和细胞凋亡的影响A.ROS相对表达变化;B.SOD相对表达变化,n=3;C.ROS相对表达变化;D.细胞凋亡率的相对变化;E.c-caspase3相对表达变化;n=3

图4 αB-crystallin是miR-513b-5p的功能性靶基因A.CRYAB(αB-crystallin)的3′UTR和miR-513b-5p结合位点;B.荧光素酶报告基因实验验证αB-crystallin是miR-513b-5p的下游靶基因; n=3(WT.wild type;mut.mutant type);C.细胞凋亡率的相对变化;D.ROS相对表达变化;c-CRYAB.CRYAB的过表达质粒,c-null.CRYAB过表达的阴性对照
对SRA01/04细胞转染mimic基础上继续使用转染αB-crystallin过表达质粒c-CRYAB(mimic+c-CRYAB组),检测细胞氧化应激和凋亡率的变化,验证αB-crystallin是否为miR-513b-5p的功能性靶基因。与仅添加未修饰质粒的mimic组(mimic+c-null组)比较,mimic+c-CRYAB组的细胞凋亡率下降,而且ROS的表达水平也下调,差异均有统计学意义(P<0.05,图4C),但是mimic+c-null组与mimic组比较,细胞凋亡率变化和ROS的表达水平变化比较,差异均无统计学意义(P>0.05,图4D)。
讨 论
αB-crystallin是一种维持的晶状体细胞内在稳定的关键蛋白[11],因此在白内障等晶状体疾病中αB-crystallin具有明显的差异性表达[12]。本研究中,白内障患者晶状体上皮组织中αB-crystallin的表达明显下调,而miR-513b-5p的表达水平却明显上升。在体外研究中,笔者研究发现晶状体上皮细胞的氧化应激能力和凋亡率均被高表达miR-513b-5p所上调。通过生信分析方法的预测以及荧光素酶基因报告实验,确认晶状体上皮细胞中αB-crystallin是miR-513b-5p的靶基因,其表达受miR-513b-5p的直接调控。进一步发现miR-513b-5p可通过对αB-crystallin蛋白质的调节从而参与调节晶状体上皮细胞的氧化应激和凋亡。
miR-513家族成员能调节多种细胞的凋亡[13, 14]。研究发现miR-513b-5p能够诱导睾丸胚胎癌细胞,而miR-513b可诱导胃癌细胞凋亡,另外miR-513可以调控干扰素γ诱导的人类呼吸道细胞凋亡[10,15,16]。本研究中miR-513b-5p可促进晶状体上皮细胞中c-caspase3的表达和细胞凋亡率。另外,miR-513b-5p过表达可明显促进晶状体上皮细胞的氧化应激标记分子ROS的水平并抑制抗氧化标志物SOD的表达,而且miR-513b-5p抑制剂能够明显抑制因H2O2诱导的氧化应激标志物的增加。以上研究表明,miR-513b-5p不仅促进人晶状体上皮细胞的凋亡,而且可能对晶状体上皮细胞的氧化应激具有促进作用。
本研究发现,miR-513b-5p可直接靶向调控白内障发展关键调控因子αB-crystallin,通过生物信息学分析和荧光素酶报告基因实验明确了在晶状体上皮细胞中miR-513b-5p通过miRNA-target机制对αB-crystallin进行直接抑制。以往研究表明,αB-crystallin同样可作为miR-491的靶基因参与调节骨肉瘤细胞的肺转移[9]。而且近年来发现αB-crystallin参与多种细胞的凋亡和应激过程,在白内障中发挥关键保护作用[6, 17~20]。因此提示miR-513b-5p对于晶状体上皮细胞的凋亡和氧化应激调节很可能是通过调控αB-crystallin而发挥作用。为了明确这一推测,在晶状体上皮细胞中联合过表达miR-513b-5p和αB-crystallin,与单独过表达miR-513b-5p比较,在诱导的miR-513b-5p调控凋亡和氧化应激分子标志物均被过表达αB-crystallin所抑制。研究表明,miR-513b-5p可通过抑制αB-crystallin促进晶状体上皮细胞的凋亡和氧化应激。
综上所述,αB-crystallin是miR-513b-5p的靶基因,其表达受miR-513b-5p的直接调控。而且miR-513b-5p可通过对αB-crystallin蛋白的调节从而参与调节晶状体上皮细胞的氧化应激和凋亡,为白内障机制研究提供了新的思路,为白内障的治疗提供新的潜在靶点。
