2型糖尿病患者血小板/淋巴细胞与颈动脉斑块在不同年龄组相关性研究
2019-11-05张彦霞彭荣荣乔成栋
张彦霞 彭荣荣 乔成栋
动脉粥样硬化是一种脂质代谢异常的全身免疫炎性疾病,可导致冠状动脉粥样硬化性心脏病[1]。炎症是导致冠状动脉疾病、糖尿病、高脂血症、代谢综合征等疾病发生的因素之一,与血管内皮细胞的损伤密不可分[2]。慢性低度炎症在动脉粥样硬化斑块的起始和发展中起关键作用,会导致斑块与血栓形成的不稳定性。PLR最近已成为潜在的炎性生物学标志物,研究发现PLR可作为心血管疾病的独立预测因子,加上PLR是一种易于获得且便宜的炎性指标,可用于预测冠状动脉粥样硬化的严重程度[3]。2型糖尿病患者合并颈动脉斑块在心血管疾病方面具有很高的病死率,因此在高危患者中进行早期分层,预计高风险患者的早期分层可降低心血管疾病的发生率和病死率。本研究旨在确定PLR在不同年龄组与颈动脉斑块的关系,是否可作为识别动脉斑块的预测工具。
对象与方法
1.研究对象:选取2017年3月~2018年6月就诊于笔者医院内分泌科2型糖尿病(type 2 diabetes mellitus,T2DM)患者291例,其中,男性206例,女性85例,年龄范围为26~76岁,平均年龄51.73±10.27岁。<55岁的2型糖尿病患者153例,男性占79.7%,其中单纯2型糖尿病作为对照组有103例,2型糖尿病合并颈动脉斑块50例;≥55岁为138例,男性占60.9%,其中对照组52例,合并颈动脉斑块86例。T2DM纳入标准根据《中国2型糖尿病防治指南(2013年版)》;高血压标准:根据《中国高血压防治指南 (2005 修订版)》,收缩压 (systolic blood pressure,SBP)≥140mmHg和(或)舒张压(diastolic blood pressure,DBP)≥90mmHg(1mmHg=0.133kPa,1cmH2O=0.098kPa)。排除标准:严重心脏、脑血管疾病及影响淋巴细胞和血小板的疾病,如血液病、恶性肿瘤、严重肝脏、肾功能障碍、急性感染及自身免疫性疾病。通过查询电子病历及询问病史的方式获得患者基本临床资料。以上患者或直系亲属已签署知情同意书,并且已通过笔者医院伦理学委员会的批准。
2.研究方法:(1)颈动脉诊断标准:对所有患者进行颈动脉超声检查,并由1~2名经验丰富的超声科专家审查结果。采用高频B型超声探头(7.5~10.0MHz)。患者取平卧头仰位,从颈动脉起始部开始对颈总动脉全段及颈内外动脉起始段进行纵向及横切面扫查,根据2007年欧洲高血压治疗指南,颈总动脉内膜中层厚度>0.9mm确定为内中膜增厚。动脉硬化斑块的判定标准:血管纵行扫描及横断面扫描时,均可见该位置存在突入管腔的回声结构、或突入管腔的血流异常缺损,或局部颈动脉内膜中层厚度≥1.3mm。(2)血液学及其他观察指标:所有患者空腹抽取肘静脉血,检测血常规,中性粒细胞/淋巴细胞比值(neutrophil lymphocyte ratio,NLR)为二者细胞计数比值,血小板和淋巴细胞比值(PLR)为二者细胞计数比值;测定血脂、尿酸、肌酐、空腹血糖、糖化血红蛋白(HbA1c),胰岛素抵抗指数(HOMA-IR,HOMA-IR=空腹胰岛素×空腹血糖÷22.5)等指标。观察研究对象性别构成、年龄、体重指数(BMI)、收缩压、舒张压、脉压、心率、病程及吸烟和饮酒。
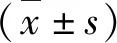
结 果
1.不同年龄组的基线特征:两个年龄组的基本临床特点见表1。
2.不同年龄组中有颈动脉斑块组(观察组)与无颈动脉斑块组(对照组)的临床资料比较(表2):(1)年龄<55岁患者临床特点:观察组和对照组进行t检验,PLR和颈动脉斑块差异无统计学意义(t=-0.167,P=0.867),男性、高血压、吸烟、饮酒、收缩压、脉压、总胆固醇(total cholesterol,TC)、低密度脂蛋白(low-density lipoprotein,LDL-C)、超敏C反应蛋白(hypersensitive C-reactive protein,hs-CRP)与颈动脉斑块差异有统计学意义。(2)年龄≥55岁患者临床特点:老年组中,PLR与动脉斑块差异有统计学意义(t=2.414,P=0.017),男性、吸烟史、收缩压、白细胞计数(WBC)、淋巴细胞计数、高密度脂蛋白(HDL-C)、空腹血糖(FPG)、肌酐(Cr)、尿酸(UA)与颈动脉斑块差异有统计学意义。
3.多因素Logistic回归分析:将连续性的PLR数值用三分位数转换成分类变量进行回归分析,以≥高三分位数119.4定义为高PLR,<119.4定义为低PLR。调整性别、高血压病史、吸烟史、TC、LDL-C、HDL-C传统动脉斑块危险因素后,评估颈动脉斑块和PLR的独立关联,多因素Logistic回归分析显示,高PLR与颈动脉斑块差异有统计学意义(OR=3.15,95% CI:1.32~7.54,P=0.01)。
讨 论
本研究发现PLR与T2DM老年患者颈动脉斑块存在关系,调整混杂因素后PLR与颈动脉斑块独立相关,而在老年前期组PLR和颈动脉斑块无相关性。
PLR与动脉粥样硬化的关系已在多项研究中有证实,Akboga等[3]根据Gensini评分将心血管疾病患者分为轻、中、重3组,发现PLR是严重心血管疾病的独立预测因子,并且PLR与冠状动脉的粥样硬化程度和C反应蛋白水平之间呈显著相关,加上PLR是一种易于获得且便宜的炎性指标,可用于预测冠状动脉粥样硬化的严重程度。在Gary等[4]研究中也证实了PLR与一些炎性标志物如C反应蛋白和纤维蛋白原之间呈显著相关。PLR不仅在冠状动脉粥样硬化中有研究,在外周动脉粥样硬化的研究中也发现,高PLR与症状性外周动脉闭塞性疾病的严重肢体缺血和其他心血管终点事件的高风险显著相关[5]。PLR在预测心血管事件及病死率方面也有许多研究。
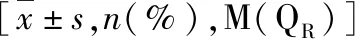
表1 不同年龄组人群的基线特征
一项Meta分析证实了升高的PLR是急性冠脉综合征患者全因病死率和心血管事件的预测因子[6]。Yildiz等[7]评估了术前PLR和NLR用于预测行PCI的心肌梗死患者无复流的效果,发现术前高PLR和NLR是患者术后无复流的独立预测因素。
但是这些研究均没有对患者进行年龄分组,本研究对2型糖尿病患者进行年龄分组后发现,老年组得出的结果与之前的研究结果一致,而老年前期组却不同,这种不一致性,可能与增龄有关,下面将从增龄对血小板活化、淋巴细胞计数、颈动脉斑块的影响3个方面来解释。首先,增龄对血小板计数的影响,衰老是心血管疾病最大的风险因素。血栓形成的发生率随着年龄的增长而急剧增加,这在年轻人中非常罕见,但在老年人中每年增加约1%,这表明衰老是血栓形成的风险因素之一[8]。而血小板在血栓及斑块的起始和发展过程中起着重要作用,它不仅在凝血系统中具有重要作用,还可介导炎性反应[9]。人的衰老和氧化应激密不可分,在衰老过程中,体内产生的活性氧在血小板活化机制中发挥关键作用[10]。老年人经历了从止血平衡向凝血增加和纤维蛋白溶解减少的转变[11]。因此,衰老可能导致血小板本身固有的变化,增加的血小板活化会加剧动脉血栓的形成[12]。并且血小板活性的增加与血小板磷脂含量增加有关,提示跨膜信号转导或第二信使积累也与年龄增加相关[13]。以上研究表明,增龄可增加血小板的活化,而活化的血小板在动脉硬化中扮演重要角色。
关于增龄对淋巴细胞的影响,衰老本身就与一些疾病的易感性增加有关,它还与免疫细胞功能降低和分布改变有关,特别是T细胞。随着年龄的增加,氧化应激和慢性抗原负荷增加,淋巴细胞对抗损伤诱导的细胞死亡降低,并增加炎性反应,最终导致细胞死亡增加[14]。由于持续暴露于抗原并伴有免疫功能低下,效应记忆和衰老T细胞和巨噬细胞产生促炎细胞因子的增加,老年人通常呈现慢性低水平炎症[15]。临床证据表明,随着年龄的增长,机体对新型抗原产生初级免疫应答的能力显著下降,这就可能导致对一些疾病的高度易感性,而免疫应答依赖于幼稚T细胞,但随着年龄增长,胸腺退化,幼稚T细胞减少[16]。而且CD4阳性T细胞淋巴细胞减少已被用作加速免疫衰老的生物学标志物[17]。不仅是T淋巴细胞,老年患者的骨髓中浆细胞数量也减少,浆细胞减少可导致抗体对抗原的低亲和力。以上表明,在衰老期间,促炎和抗炎免疫应答之间的不平衡,更容易发生炎性疾病。
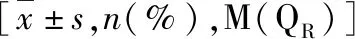
表2 斑块组与无斑块组一般临床资料和实验室检查结果比较
增龄关于对PLR影响的研究甚少,而PLR是对血小板计数及淋巴细胞计数的比值,它代表两个反向相关的预测因子,在血栓形成和免疫途径中起重要作用,并且较单个血小板计数或淋巴计数更稳定性。最后,增龄对颈动脉斑块的影响,随着年龄的增长,心血管疾病的发生率和患病率急剧增加,这和因年龄变化所导致的血管功能及止血系统改变有关。众所周知,动脉斑块的形成和慢性炎症发生不可分割,衰老可使一些细胞因子异常表达,导致促炎和抗炎的不平衡,这就导致炎性疾病的易感性。而且,增龄本身与衰弱及与多种疾病相关,衰弱的老年人多个器官系统逐渐衰退及功能异常,引起神经内分泌和免疫系统的显著失调,从而危及体内平衡。这些都会导致动脉硬化性疾病的高发生率。
本研究的局限性为单中心回顾性研究,样本量少,而且对于年龄的分组只是以55岁为分界,并且缺乏描述一些药物对研究的影响。今后需对年龄细化进行更多的研究以明确年龄因素对PLR与动脉斑块关系的影响。随着我国老龄化的严重发展,寻找及时可以对高危患者进行疾病风险分层的指标至关重要,PLR作为血小板和淋巴细胞计数比值,在血常规中容易获得,是一种常规、廉价、无创、广泛应用的检查,它目前作为新型炎性指标已在多种疾病中应用,临床中应重视其对老年人动脉硬化性疾病的意义。
