2015-2017年聊城市腹泻病例中沙门氏菌分子分型及耐药性研究
2019-11-05杜银菊梁胜楠李晓迪徐可心郭海燕程利红苗雪峰李心朋
杜银菊,梁胜楠,段 瑶,李晓迪,徐可心,郭海燕,程利红,王 飞,刘 雨,苗雪峰,李心朋
沙门氏菌是一种血清型别众多,分布广且人兽共患的常见病原菌。该菌主要通过食物(尤其是禽肉)感染人类,引起食源性疾病,如肠伤寒、败血症等,严重者可导致死亡[1]。而不同血清型的沙门氏菌致病力及耐药性显著不同[2],因此沙门氏菌的血清分型及耐药分析对临床研究和疾病控制都有重大意义。随着分子生物学的不断发展,对沙门氏菌的监测研究进入分子水平。脉冲场凝胶电泳(PFGE)技术通过比较菌株“DNA指纹图谱”的相似性,推断菌株的同源性,帮助追踪、识别传染源和传播途径,对传染病的监测有着非常重要的意义[3]。
近年来随着抗生素的不断使用,病原菌的耐药性不断增强,耐药率和耐药范围都呈现大幅上升趋势,因此病原菌的耐药性问题已成为世界范围的公共健康和卫生问题[4-5]。沙门氏菌作为重要的食源性致病菌及耐药指示菌,其耐药性越来越受到各界的重视。本文对山东省聊城地区食源性疾病监测来源的41株沙门氏菌进行分子分型及耐药性检测,了解聊城地区沙门氏菌的分型和耐药性特点,为减少和控制沙门氏菌在该地区的传播与感染提供依据。
1 材料与方法
1.1菌株来源 本实验中41株沙门氏菌菌株分离自2015-2017年聊城市两家食源性疾病哨点医院859例腹泻病人粪便标本。质控菌株为鼠伤寒沙门氏菌ATCC140128,药敏试验质控菌株为大肠埃希氏菌ATCC25922,上述菌株购自中国工业微生物菌种保藏中心(CICC),脉冲场凝胶电泳分子量标准菌株为沙门氏菌H9812,由山东省疾病预防控制中心细菌所提供。
1.2沙门氏菌分离鉴定与血清学分型 按照食品安全国家标准GB4789.4-2010及国家风险评估中心2010-2015年《食源性疾病监测工作手册》[6-7]进行沙门氏菌分离培养及鉴定;利用玻片凝集法进行血清凝集试验,所用抗血清来自丹麦国家食品研究所,且均在有效期内,根据White-Kauffmann-Le Minor抗原表确定菌株的血清型别。
1.3PFGE分型 参照美国疾病预防控制中心Pulse Net PFGE标准化方法[8]进行。使用限制性内切酶XbaⅠ进行酶切, 获得的菌株 PFGE 图像录入 BioNumerics (Version 5. 1, Applied maths, Inc.) 软件,使用非加权配对算术平均法(unweighted pair group average method,UPGMA) 进行聚类,构建聚类树,分析菌株间的相似性。
1.4药物敏感试验 药敏实验采用美国临床实验室标准研究所(CLSI)推荐的微量肉汤稀释法(MIC)进行,定量测定其最低抑菌浓度。试验共采用8种抗生素:环丙沙星(Ciprofloxacin,CIP),甲氧苄啶/磺胺甲噁唑(Trimethoprim/Sulfamethoxazole,SXT)、氯霉素(Chloramphenicol,CHL)、萘啶酸(Nalidixic acid,NAL)、庆大霉素(Gentamicin,GEN)、四环素(Tetracycline,TET)、头孢噻肟(Cefotaxime,CTX)、头孢西丁(Cefoxitin,CFX),用全自动药敏试验菌液接种判读仪和商品化的药敏板(上海星佰生物技术有限公司)进行测定,按照CLSI2017标准判读结果并确定其耐药表型。实验中大肠杆菌ATCC25922做为质控菌株确保药敏结果的可靠性。采用CLSI 推荐的方法进行产广谱β-内酰胺酶(ESBL)表型确证实验,即当头孢噻肟(0.25~16 μg/mL)或头孢他啶(0.5~16 μg/mL)和克拉维酸(4 μg/mL)联合获得的MIC 值低于上述抗生素单药 MIC 值3个稀释度或以上, 即可判定为产 ESBLs 菌株。
1.5耐药基因 检测运用文献报道的blaCMY、blaCTX-M常见ESBLs型的引物[9-10],PCR检测产 ESBLs菌株中编码ESBLs基因。引物由北京天一辉远生物科技有限公司合成。扩增阳性的PCR产物送北京天一辉远生物科技有限公司进行序列测定,所得序列BLAST比对后确定该耐药菌株ESBLs基因型别。PCR反应总体积为50 μL,具体组成为:2×Pyrobest Taq PCR Mix(TaKaRa公司)25 μL,上下游引物(50 μmol/L)各0.4 μL,模板(水煮)2 μL。扩增CMY基因引物为CMY-F:5′ATGATGAAAAAATCGTTATGC3′,CMY-R:5′GCTT-TTCAAGAATGCGCCAG3′; 扩增CTX-M基因引物为: CTX-M-F: 5′TTTGCGATGTGCAGTACCAGTAA3′, CTX-M-R: 5′CGATATC-GTTGGTGGTGCCATA3′。扩增条件为:94 ℃预变性5 min,30个循环(94 ℃ 30 s;55 ℃ 30 s;72 ℃ 60 s), 72 ℃补充延伸6 min。
1.6统计学分析 运用SPSS17.0软件包进行统计分析。用χ2检验进行率的比较,P<0.05为差异有统计学意义。
2 结 果
2.1沙门氏菌分离概况 2015-2017年共检测哨点医院腹泻病患者标本573份,检出沙门氏菌41株,总分离率7.16%。其中2016年沙门氏菌分离阳性率最高,为8.42%,2017年沙门氏菌阳性率有所降低,为7.03%(表1)。分离率在不同年龄阶段存在差异(表2):11岁以下患者分离率(8.31%)明显高于11~30岁组(2.68%,χ2=4.090,P<0.05),41例患者职业上散居儿童20例(48.78%),托幼儿童6例(14.63%),学生5例(12.20%),农民9例(21.95%),干部职工1例(2.44%),以散居儿童为主;男性22例,女性19例,女性患者检出沙门氏菌血清型种类多于男性患者,相对分散于7个血清型,男性患者检出的沙门氏菌血清型集中于鼠伤寒沙门氏菌和肠炎沙门氏菌;临床表现上发烧70.97%,腹泻(平均6次/d),腹痛35.48%,呕吐38.71%,粪便多数呈水样(46.34%),部分伴有粘液或脓血。
表1 不同年份沙门氏菌检出情况
Tab.1 Isolating ratio ofSalmonellaby year
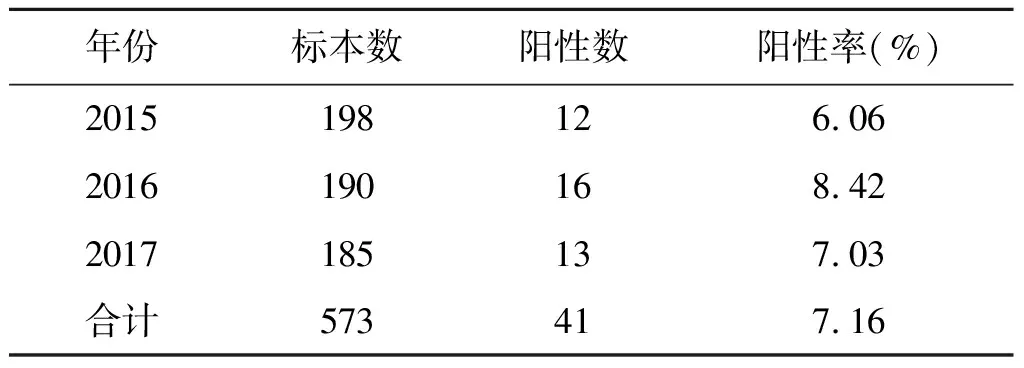
年份标本数阳性数阳性率(%)2015198126.062016190168.422017185137.03合计573417.16
表2 不同年龄组沙门氏菌检出情况
Tab.2 Detecting results ofSalmonellaby age group

年龄标本数阳性数阳性率(%)<11岁301258.3111-30岁11232.68≥30岁160138.13
2.2沙门氏菌血清型分布 对分离到的41株沙门氏菌进行血清分型,共鉴定出8个血清型(表3),主要为鼠伤寒沙门氏菌、肠炎沙门氏菌和病牛沙门氏菌,分别为18株、7株和5株。
2.3PFGE分型 情况对41株沙门氏菌进行PFGE分析,得到34种PFGE图谱,带型相同的有5组(2株鼠伤寒沙门氏菌,2株肠炎沙门氏菌,2株病牛沙门氏菌,2株都柏林沙门氏菌,1株肠炎沙门氏菌和1株都柏林沙门氏菌及1株鼠伤寒沙门氏菌),其他沙门氏菌PFGE图谱完全不同。41株沙门氏菌带型相似度在49%~100%之间(图1)。同一血清型沙门氏菌大部分菌株PFGE图谱可聚集成簇,但肠炎沙门氏菌与都柏林沙门氏菌PFGE图谱相似度较高,两种血清型菌株部分聚集成簇存在(图1)。根据该情况,对PFGE图谱相似度较高的11株沙门氏菌重新进行血清凝集,结果仍显示两种不同的血清型(肠炎沙门氏菌与都柏林沙门氏菌)。
表3 44株人源沙门氏菌的血清型分布
Tab.3 Serotype distribution of 44Samonellaisolates from patients

血清型抗原式菌株数鼠伤寒沙门氏菌4,12:i:1,218肠炎沙门氏菌9,12:g,m:-7都柏林沙门氏菌9,12:g,p:-4病牛沙门氏菌8:r:1,55火鸡沙门氏菌10: e,h:l,w4印第安纳沙门氏菌4:z:7 1婴儿沙门氏菌6,7:r:1,51汤普逊沙门氏菌7: k:51合计-41
2.4沙门氏菌耐药概况 长期以来,我国各地学者对食源性和动物源性沙门氏菌的耐药性进行了密切监测和研究。本文选取临床上常用的4大类抗生素中的8种进行研究,发现41株测试菌株,对四环素耐药率最高,为73.17%,对氟喹诺酮类药物环丙沙星的耐药率为41.46%,对头孢噻肟较敏感,敏感率为73.17%(表4)。菌株多重耐药现象明显,多重耐药率达68.29%,耐4种及以上抗生素的有18株,占43.90%(表5)。
41株菌共产生21个耐药谱(表4,图1),TET-GEN-NAL-CHL-TMP-CIP为优势耐药谱,主要存在于鼠伤寒沙门氏菌中。发现同一血清型的菌种其耐药谱有很大相似性,有4株鼠伤寒只对一种抗生素具有抗药性,有3株病牛沙门氏菌和1株鼠伤寒沙门氏菌的耐药谱具有很大相似性(图1),其余的鼠伤寒沙门氏菌和病牛沙门氏菌都对两种及两种以上抗生素具有抗药性。肠炎沙门氏菌与都柏林沙门氏菌的耐药谱也有一定的相似性(表5,图1),大多数菌株只对一种抗生素具有抗药性,其中有5株菌对2种及以上抗生素有抗药性。

注:图中耐药部分颜色深浅表示耐药程度,浅灰色表示敏感,深灰色表示中度敏感,黑色表示耐药。图1 沙门氏菌PFGE分子分型结果Fig.1 PFGE analysis of Salmonella
2.5产ESBL沙门氏菌耐药基因检测 经ESBL表型确证实验发现6株产ESBLs鼠伤寒沙门氏菌,产ESBLs沙门氏菌比例为14.63%,其中1株来自2015年,2株来自2016年,3株来自2017年,对这6株菌进行耐药基因PCR扩增,结果显示blaCMY、blaCTX-M扩增结果阳性。对PCR产物进行测序,序列通过BLAST比对,发现分别与已知的blaCTX-M-55、blaCTX-M-90、blaCMY-2、blaCTX-M-14,blaCTX-M-15,blaCTX-M-27序列100%同源。
表4 不同血清型的沙门氏菌耐药谱分布
Tab.4 Resistance profile of different serotypes ofSalmonella
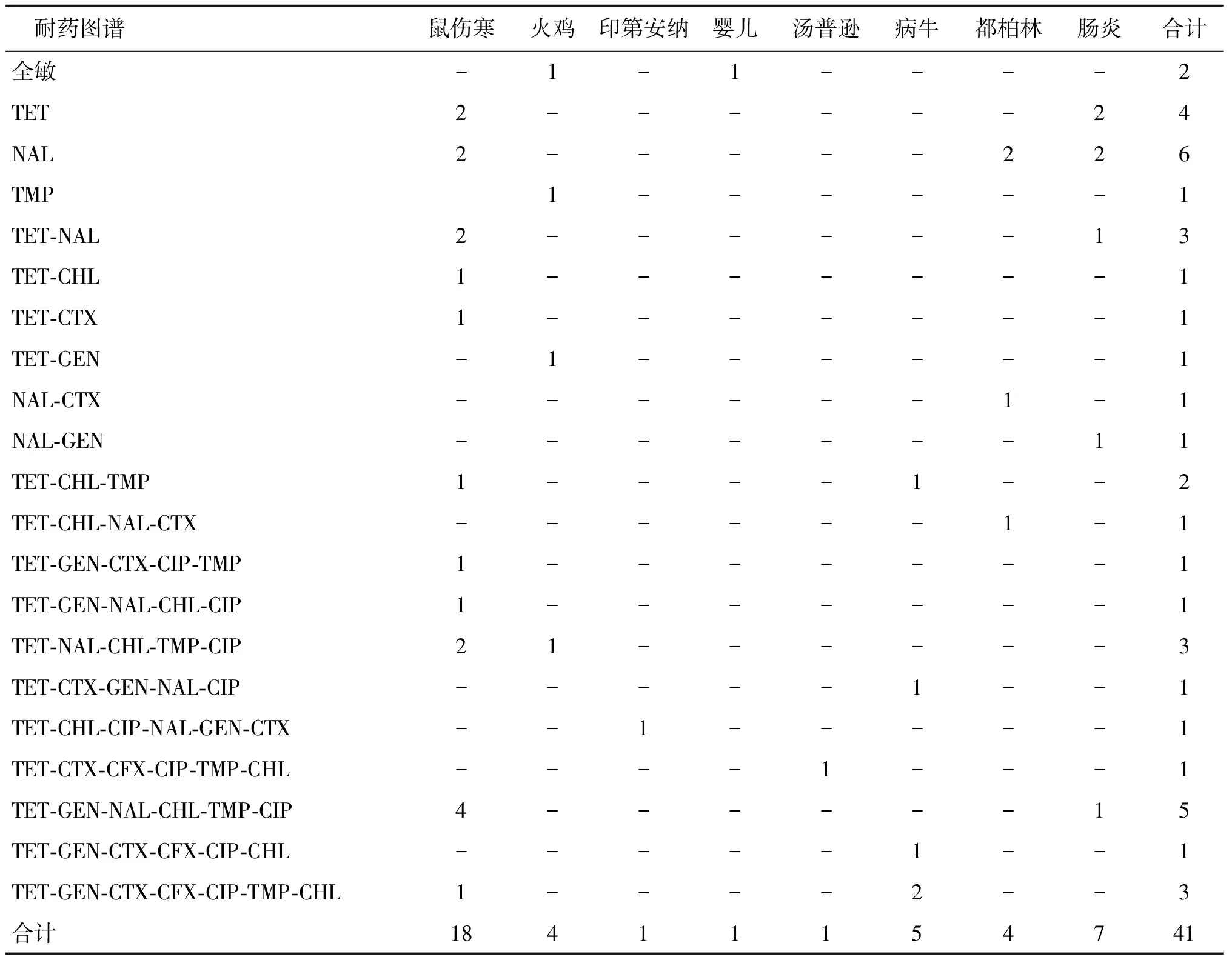
耐药图谱鼠伤寒火鸡印第安纳婴儿汤普逊病牛都柏林肠炎合计全敏-1-1----2TET2------24NAL2-----226TMP1------1TET-NAL2------13TET-CHL1-------1TET-CTX1-------1TET-GEN-1------1NAL-CTX------1-1NAL-GEN-------11TET-CHL-TMP1----1--2TET-CHL-NAL-CTX------1-1TET-GEN-CTX-CIP-TMP1-------1TET-GEN-NAL-CHL-CIP1-------1TET-NAL-CHL-TMP-CIP21------3TET-CTX-GEN-NAL-CIP-----1--1TET-CHL-CIP-NAL-GEN-CTX--1-----1TET-CTX-CFX-CIP-TMP-CHL----1---1TET-GEN-NAL-CHL-TMP-CIP4------15TET-GEN-CTX-CFX-CIP-CHL-----1--1TET-GEN-CTX-CFX-CIP-TMP-CHL1----2--3合计18411154741
注:CIP为环丙沙星,SXT/TMP为甲氧苄啶/磺胺甲噁唑,CHL为氯霉素,NAL为萘啶酸,GEN为庆大霉素,TET为四环素,CTX为头孢噻肟,CFX为头孢西丁。
表5 44株沙门氏菌对8种抗生素的耐药情况
Tab.5 Resistance of 44Salmonellaisolates to 8 antibiotics

药物名称耐药数n(%)中度敏感数n(%)敏感数n(%)环丙沙星(CIP)17(41.46)18(43.90)6(14.63)甲氧苄啶/磺胺甲噁唑(SXT)16(39.02)-25(60.98)氯霉素(CHL)10(46.34)-22(53.66)萘啶酸(NAL)23(56.10)-18(43.90)庆大霉素(GEN)15(36.59)2(4.88)24(58.54)四环素(TET)30(73.17)1(2.44)10(24.39)头孢噻肟(CTX)11(26.83)-30(73.17)头孢西丁(CFX)5(12.20)9(21.95)27(65.85)
3 讨 论
细菌性食源性疾病现在在全世界范围内广为流行,影响人们的生命安全。而其中沙门氏菌引起的食源性疾病位列首位。早先随着各种抗生素的广泛大量使用,包括沙门氏菌在内的多种细菌的耐药性以及耐药种类一直在增加,并且多重耐药已经成为普遍现象。本研究中沙门氏菌耐药性,与王茂起等[11]报道的2001年中国食源性致病菌及其耐药性主动监测研究结果相比,四环素、萘啶酸均由高敏感性转为高耐药性,而全部敏感的环丙沙星和庆大霉素也检测出耐药性。另外,本研究中沙门氏菌多重耐药率较严重,超过60%,且发现6株携带不同耐药基因类型的产广谱β-内酰胺酶的鼠伤寒沙门氏菌,产ESBLs菌株比例高于全国平均水平及欧美发达国家水平(一般平均为3%左右),具体原因有待进一步研究。其中blaCMY-2及blaCTX-M-55在耐药沙门氏菌中广泛存在[12-13],blaCMY-2还曾经在山东泰安的猪上检测到;虽然blaCTX-M-90在沙门氏菌中少见,但在耐药严重的大肠杆菌及克雷伯菌中常见[14];blaCTX-M-14,blaCTX-M-27及blaCTX-M-15均在我国不同省份(如河南、北京、上海等)人源耐药鼠伤寒沙门氏菌、肠炎沙门氏菌中检测到[15-16],同时动物源大肠杆菌及沙门氏菌中也普遍存在上述耐药基因,而且这些耐药基因大多可以在不同菌株菌种(包括不同种属)间水平转移[8]。上述不同耐药基因型的发现,提示可能存在耐药基因或耐药菌株的污染,以及在动物、环境及人类之间的扩散,不同地域之间的播散。考虑聊城为山东畜禽主要养殖地区之一,山东又是全国畜禽养殖大省,密切监测人群及动物中耐药趋势变化、耐药变迁、耐药基因携带及转移情况,对于科学合理管控临床及动物用药具有重要意义。
血清分型发现鼠伤寒沙门氏菌和肠炎沙门氏菌为聊城市优势沙门氏菌血清型,这与国内及国际其他研究结果一致。肠炎沙门氏菌是引起我国食物中毒的主要沙门氏菌血清型,聊城市2015年至2017年3年从腹泻病例中均分离得到肠炎沙门氏菌,分别分离到4株、2株和1株,不同年代不同批次样本中分离得到此致病菌,说明该地区肠炎沙门氏菌感染情况不容乐观,存在着肠炎沙门氏菌污染食品的风险,提示有关部门应高度重视,并进行溯源追踪,实时监测以避免肠炎沙门氏菌暴发的风险。但火鸡沙门氏菌相对分离率较高,PFGE结果提示2株火鸡沙门氏菌亲缘关系较近(2条带的差异),但由于菌株数量较少,具体原因及感染或污染来源尚待加强监测及流行病学调查进一步查明。此外,沙门氏菌的分离率自2015年至2016年有所增加,在分离方法不变的情况下,可能是由于现在生活条件相对提高,人们外出就餐机会较大,但是外出就餐的食品卫生方面无法保证,因此由沙门氏菌引起的感染性腹泻或食物中毒增多所致。
PFGE至今被公认为细菌特别是沙门氏菌分子流行病学研究的“金标准”[17],是一种非常有效的分子分型的方法,可用于分析不同来源菌株之间的遗传多样性及遗传关系,从而发现暴发、识别传染源(污染源)及推测流行范围。本研究中沙门氏菌PFGE带型具有多态性,未发现3株(含)以上菌株带型完全一致的现象,提示无沙门氏菌既往暴发。但由于分离菌株数量较少,尚需扩大监测范围,不断建立并完善菌株及分子分型数据库,为进一步发现暴发奠定基础。
本研究虽然获得的沙门氏菌株数量较少,但沙门氏菌分离率维持在正常水平,说明研究中方法适宜,不会造成结果的偏移。虽然菌株数量较少,但耐三代头孢菌素水平相对较高,且携带耐药基因种类多样,这是否与山东是食品动物饲养大省及动物中用药水平较高有关,尚需进一步研究证明。同时,该研究也为下一步开展动物-食品-人-环境全链条耐药监测奠定了基础,提供了线索。
总之,本研究建立了聊城地区感染性腹泻患者中沙门氏菌的分子分型数据库,为今后发现暴发奠定了基础。同时发现该地区沙门氏菌耐药现象严重,发现携带多种可转移的耐药基因的产ESBLs的鼠伤寒沙门氏菌,提示耐药基因或耐药菌株在该地区可能存在扩散现象,医院应做好卫生和环境日常消毒、终末消毒预防和降低多重耐药菌的传播,食药监部门和疾控部门也应加强合作,加大对食品等的综合检测力度,为食源性疾病的预防和控制提供数据支撑。
利益冲突:无
