2017—2018年广州市H3N2流感病毒流行及血凝素基因分子特征分析
2019-11-05鲁恩洁陈艺韵李魁彪陆剑云
曹 蓝,鲁恩洁,陈艺韵,马 钰,李魁彪,陆剑云,狄 飚
A型流感病毒属于正黏病毒科的单股、负链、分节段的RNA病毒,根据粒子表面血凝素(HA,Hemagglutinin)和神经氨酸酶(NA,Neuraminidase)的抗原性可进一步划分,HA有18个亚型(H1~H18),NA有11个亚型(N1~N11)[1]。H3N2 亚型流感病毒自1968 年首次暴发后[2],在全球范围内持续传播引起季节性流行,流感病毒传播迅速且广泛,加之流感病毒HA 基因极易发生突变和重配,导致抗原漂移[3],因此需要不断监测流行毒株以及时更新疫苗组分。有研究显示H3N2 亚型流感病毒HA基因相对于其他季节性流感病毒抗原漂移频率更快[4],本研究监测发现,H3N2亚型流感病毒是2017年广州市流感流行的主要病原,推测与携带有N21K位点突变的3C.2a1新流行分支出现有关,因此有必要对广州H3N2流感病毒流行情况和基因变异特点进行监测分析,为H3N2流感防控及疫苗株匹配性评价提供参考。
1 材料与方法
1.1样本来源 采集2017年1月-2018年9月广州市4家流感病原学监测哨点医院流感样病例咽拭子标本(流感样病例定义:体温≥38 ℃,有咳嗽或咽喉疼痛之一者)。采样对象:发病3 d内的流感样病例。标本类型:咽拭子、鼻拭子、鼻咽拭子和咽漱液。标本采集后放入含3~4 mL采样液的采样管中,并于2 个工作日内运送至相应的流感监测网络实验室,保存温度为2~8 ℃。
1.2病毒分离 提取病毒核酸,通过荧光定量RT-PCR(Reverse Transcription-Polymerase Chain Reaction)方法检测A型和H3N2亚型流感病毒(病毒核酸提取试剂盒购自德国QIAGEN公司,A型和H3N2亚型流感病毒荧光定量检测试剂盒购自江苏硕世生物科技有限公司)。将0.1 mL H3N2流感病毒阳性标本接种六孔板内MDCK细胞,后放于37 ℃ 5% CO2培养箱中吸附1~2 h。吸出接种物,清洗细胞2遍,然后加入病毒生长液于细胞板中,放置于33 ℃~35 ℃培养箱培养。每日观察细胞病变情况,当75%~100%细胞出现病变时进行收获,使用豚鼠血球(购于佛山聚联生物技术有限公司)进行血凝实验对病毒滴度进行测定。
1.3序列测定 应用Oligo 6软件设计H3N2流感病毒HA基因全长扩增引物,引物由华大基因合成。通过RT-PCR方法扩增HA基因,将阳性鉴定产物送至广州华大基因公司,通过ABI 3730进行病毒基因一代测序。
1.4HA基因分子特征分析 应用DNA Star7.1软件拼接HA基因序列并对序列进行同源性分析。用MegAlign软件比对抗原位点、受体结合位点、二硫键位点变异情况。使用在线糖基化预测软件分析潜在糖基化位点[5]。
1.5HA基因遗传进化分析 使用MEGA 4.0软件,以HA基因ORF(Open Reading Frame)为基本单元,以WHO(World Health Organization)历年北半球H3N2流感疫苗推荐株(A/Hong Kong/4801/2014,A/Singapore/INFIMH-16-0019/2016,A/Switzerland/9715293/2013,A/Texas/50/2012,A/Perth/16/2009)和不同分支代表株(A/Hong Kong/3110/2017,A/Pennsylvania/28/2014,A/VICTORIA/506/2013,A/Samara/73/2013,A/Netherlands/525/2014,A/Ohio/02/2012,A/Stockholm/18/2011,A/Puerto Rico/36/2012,A/Madagascar/0648/2011,A/Montana/05/2011,A/Victoria/208/2009,A/Norway/1330/2010)HA基因作为参比序列(参比序列由GISAID数据库提供),绘制HA基因系统进化树。绘制方法为Neighbor-joining法(参数设置为1000 replications)及Maximum composite likelihood model比对核苷酸序列。
2 结 果
2.1H3N2流感流行情况 2017年1月-2018年9月共累计检测流感样病例呼吸道标本8 535份,流感A通用阳性标本764份,阳性率为8.95%,H3N2流感阳性标本386份,阳性率为4.52%。监测结果显示,2017-2018年广州市流感流行均呈双峰流行特点,其中2017年以H3N2流行为主,3-8月为大流行高峰,9-11月为小流行高峰。2018年以H1N1流行为主,1-4月和6-9月为两个流行高峰,见图1。
2.2抗原位点变异分析 与当年度疫苗株A/Hong Kong/4801/2014相比,广州市16株H3N2流感病毒HA基因核苷酸同源性在98.5%~99.1%之间,氨基酸同源性在97.9%~99.5%之间。H3N2流感病毒抗原表位主要位于HA1蛋白A-E5个抗原决定簇,与同年度疫苗推荐株A/Hong Kong/4801/2014相比较,广州2017年H3N2流感抗原表位突变主要发生在A区,12株病毒在142位出现突变,6株病毒分别在144、150位出现突变。同时监测到B区T128A、S198P,C区S312F,E区E62G、S91N均有发生突变,C区抗原位点相对保守,未监测到突变。本研究毒株中有7株病毒出现2个或2个以上抗原位点变异,占比43.8%,详见表1。
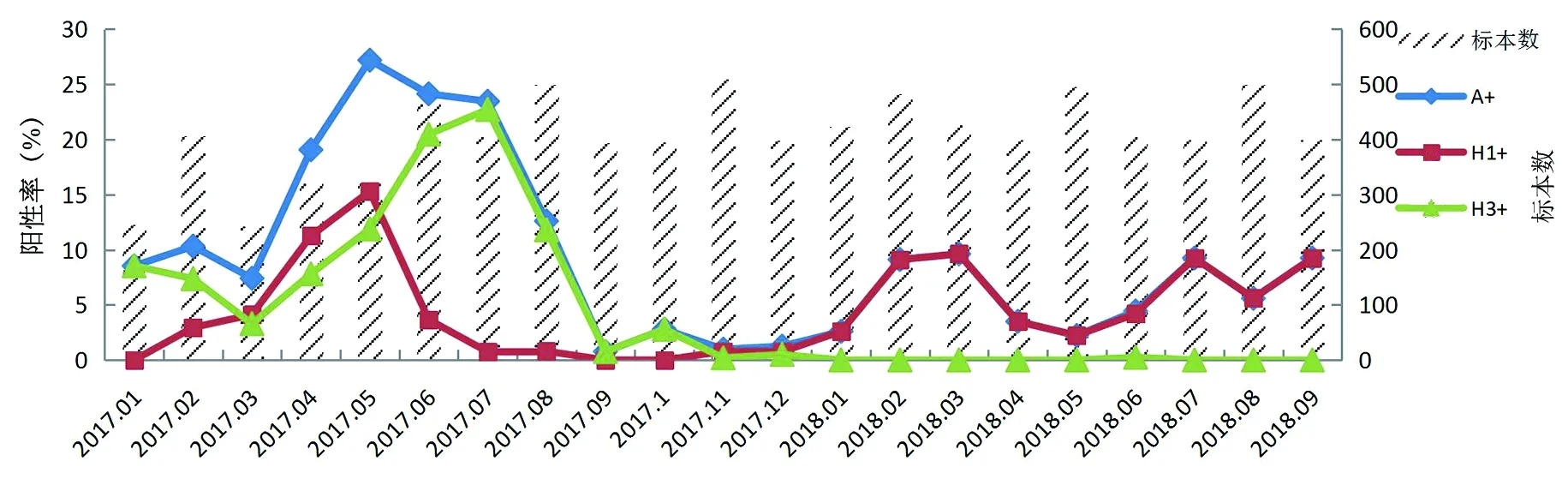
图1 2017-2018年广州市A型流感病毒流行情况Fig.1 Prevalence of influenza A virus in Guangzhou during 2017-2018
表1 H3N2流感病毒HA蛋白抗原位点变异分析
Tab.1 Mutation analysis of HA antigen of influenza A(H3N2) virus
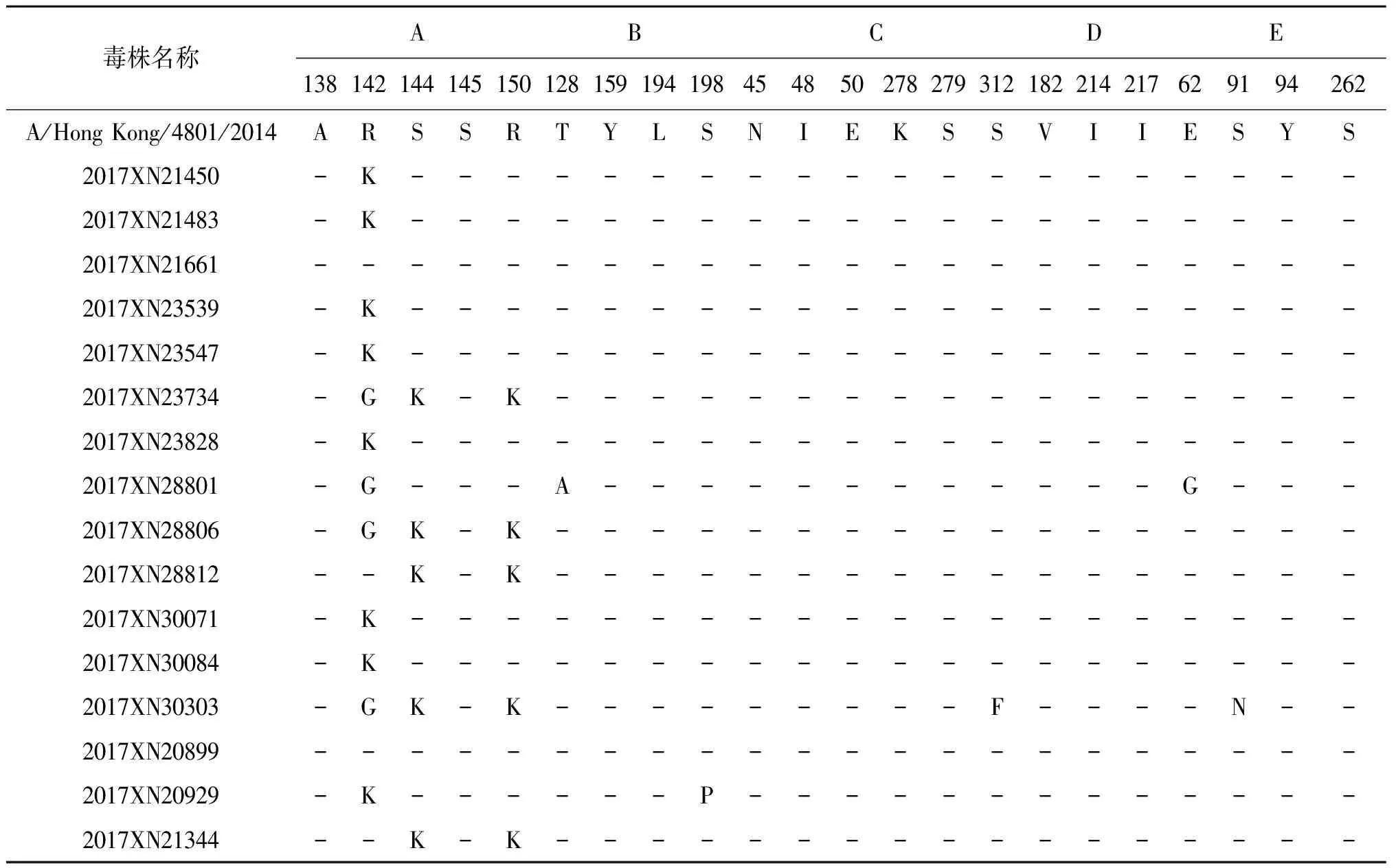
毒株名称ABCDE138142144145150128159194198454850278279312182214217629194262A/Hong Kong/4801/2014ARSSRTYLSNIEKSSVIIESYS2017XN21450-K--------------------2017XN21483-K--------------------2017XN21661----------------------2017XN23539-K--------------------2017XN23547-K--------------------2017XN23734-GK-K-----------------2017XN23828-K--------------------2017XN28801-G---A------------G---2017XN28806-GK-K-----------------2017XN28812--K-K-----------------2017XN30071-K--------------------2017XN30084-K--------------------2017XN30303-GK-K---------F----N--2017XN20899----------------------2017XN20929-K------P-------------2017XN21344--K-K-----------------
2.3受体结合位点变异分析 流感病毒受体结合位点位于HA1蛋白,有左壁(225-228位)、右壁(155位)、前壁(130-137位)、后壁(183位、190位、194位)和底壁(98位、153位)组成。与当年度疫苗推荐株A/Hong Kong/4801/2014相比较,2017年广州H3N2流感病毒受体结合位点变异主要发生在前壁,所有毒株均在131位或135位出现变异,见表2。
2.4潜在糖基化位点和二硫键分析 HA1蛋白含有大量的糖类,大部分位于氨基酸末端,其位点增加或减少对流感病毒的抗原性及其他生物学特性均有一定影响[6]。分离毒株HA蛋白共有12个潜在糖基化位点,分别位于第8、22、38、63、122、126、133、158、165、246、285和483位,与疫苗株A/Hong Kong/4801/2014相比,部分毒株分别在126位、133位和158位有糖基化位点缺失,另有2株病毒在135位增加了糖基化位点,其中2017XN28801毒株连续在126位和133位出现两个糖基化位点缺失,详见表3。HA蛋白上由12个不同位点的半胱氨酸共组成6个二硫键,与疫苗株相比,本研究毒株HA蛋白二硫键均未发现氨基酸替换或插入。
表2 H3N2流感病毒受体结合位点变异情况
Tab.2 Variation of receptor binding sites of influenza A(H3N2) virus
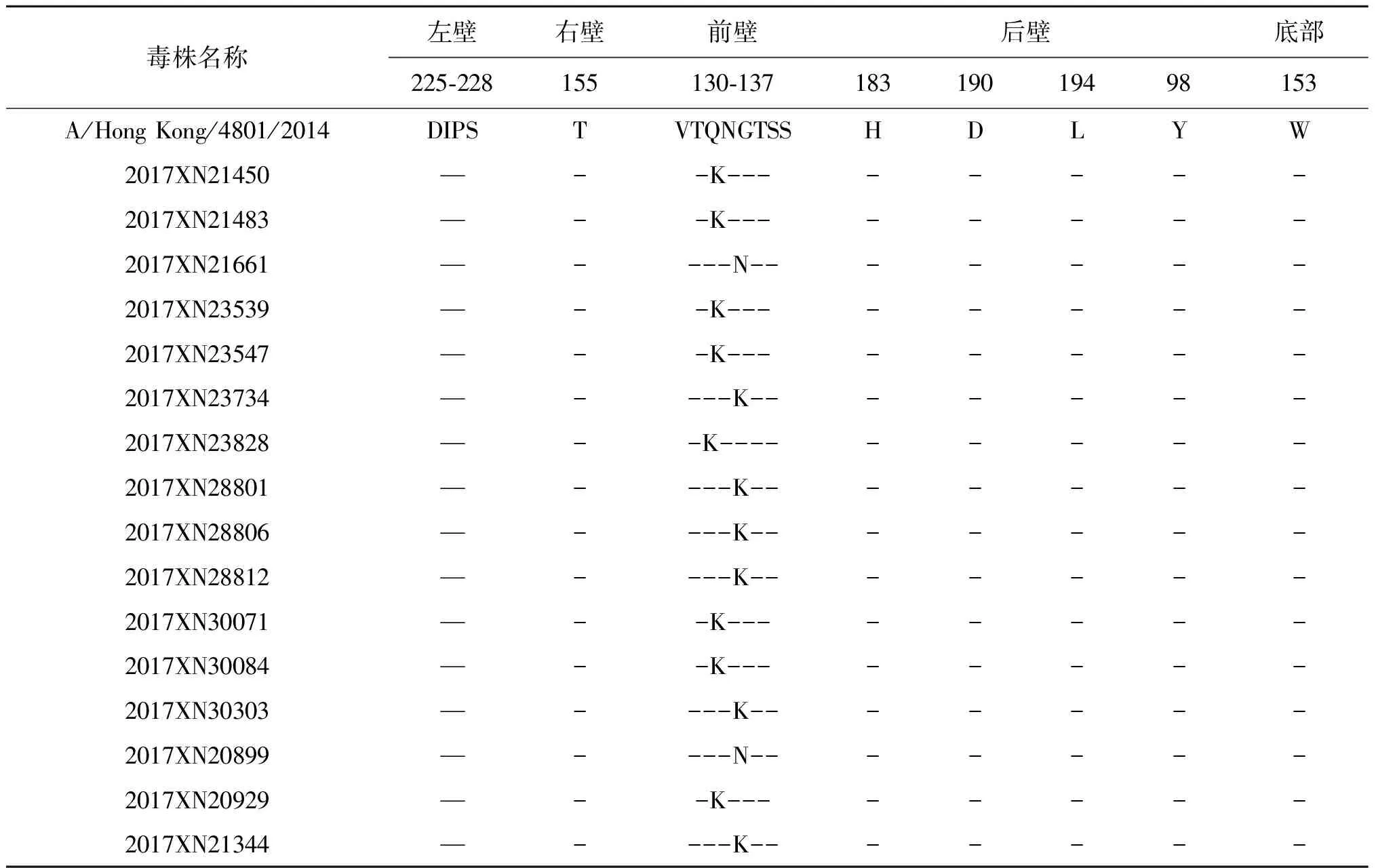
毒株名称左壁右壁前壁后壁底部225-228155130-13718319019498153A/Hong Kong/4801/2014DIPSTVTQNGTSSHDLYW2017XN21450—--K--------2017XN21483—--K--------2017XN21661—----N-------2017XN23539—--K--------2017XN23547—--K--------2017XN23734—----K-------2017XN23828—--K---------2017XN28801—----K-------2017XN28806—----K-------2017XN28812—----K-------2017XN30071—--K--------2017XN30084—--K--------2017XN30303—----K-------2017XN20899—----N-------2017XN20929—--K--------2017XN21344—----K-------
表3 H3N2流感病毒HA蛋白潜在糖基化位点分布情况
Tab.3 Distribution of potential glycosylation sites of HA protein

毒株名称8223863122126133135158165246285483NSTNGTNATNCTNESNWTNGTNSSNYTNVTNSTNGSNE/GTA/Hong Kong/4801/2014+++++++-+++++2017XN21450+++++++-+++++2017XN21483+++++++-+++++2017XN21661++++++-++++++2017XN23539+++++++-+++++2017XN23547+++++++-+++++2017XN23734++++++--+++++2017XN23828+++++++-+++++2017XN28801+++++---+++++2017XN28806++++++--+++++2017XN28812++++++--+++++2017XN30071+++++++-+++++2017XN30084+++++++-+++++2017XN30303++++++--+++++2017XN20899++++++-+-++++2017XN20929+++++++-+++++2017XN21344++++++--+++++
2.5遗传进化分析 2017年广州市H3N2流感病毒HA基因均属于3C.2a分支,与当年度疫苗株A/Hong Kong/4801/2014归属于同一遗传进化分支。在3C.2a分支内部HA基因进一步进化形成3个独立小分支,其中有3株病毒与2018-2019年度疫苗推荐株A/Singapore/INFIMH-16-0019/2016遗传关系相近,共同形成3C.2a1分支,该分支主要为香港地区流行毒株,共同携带N21K位点突变。有8株病毒与代表株A/Beijingxicheng/1193/2016等2016年北京分离株亲缘关系较近,形成同一分支。另有5株病毒与代表株A/Iowa/25/2017等2017年美国分离株亲缘关系较近,形成同一分支,见图2。
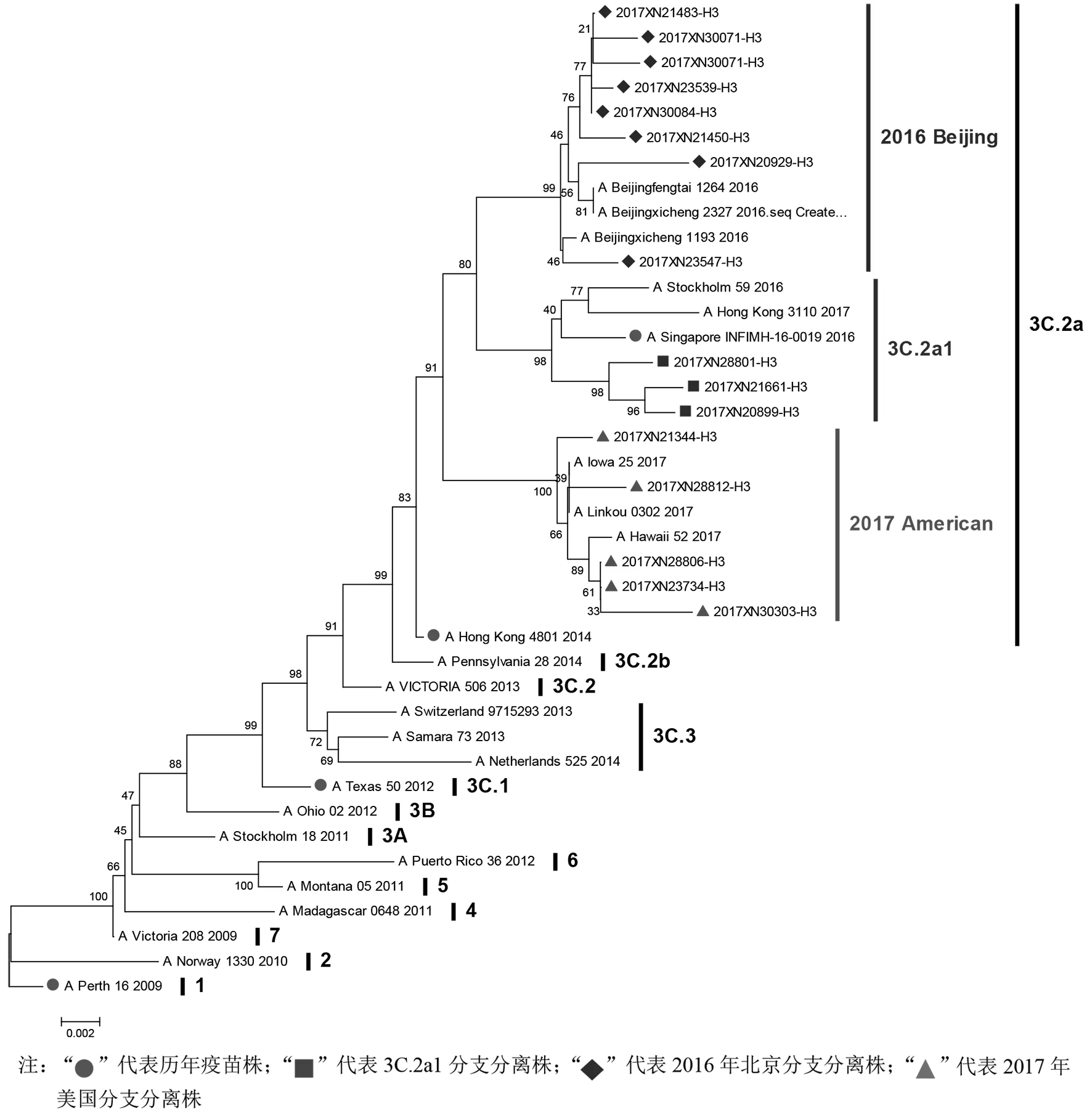
图2 广州市H3N2流感病毒HA基因遗传进化分析Fig.2 Phylogenetic tree of the HA gene of influenza A(H3N2) virus in Guangzhou
3 讨 论
世界卫生组织从1999年开始将H3N2流感病毒列入推荐疫苗组分中,从2009年迄今已更换使用8种疫苗推荐株,以应对不断暴发的H3N2流感流行。由于病毒基因组特点,并在疫苗的免疫压力下,流感病毒易通过基因突变和重组,产生抗原漂移和转换,以逃避疫苗的免疫保护。2012年以来的监测研究发现[7],广州市H3N2 和H1N1流感病毒交替流行,研究显示H3N2流感也是近年来引起广州儿童流感暴发疫情的重要病原[8],因此开展H3N2流感病毒流行监测和病原学研究,为及时发现新流感变异株、更新疫苗组分,具有重要的公共卫生意义。
HA蛋白为H3N2流感病毒表面的血凝素蛋白,分布有流感病毒的受体结合位点、抗原表位等参与病毒感染及被抗体清除的重要功能蛋白[9],抗原位点的变异可导致病毒抗原性改变,进而逃避疫苗的免疫保护。本研究结果显示,2017年广州H3N2病毒在A-E区抗原位点均有不同程度突变,变异频率较高位于A 区,与黄世腾等研究报道一致[10],且多发生于140位、144位和150位,D区相对保守没有发生突变。通常抗原表位两个及以上位点的突变即为新的抗原漂移[11],本研究中有7株病毒属于新抗原漂移,占比43.75%,提示广州市H3N2流感在抗原性上可能发生了较大变异,与我国部分南方省份的流感流行状况一致[12]。受体结合位点与宿主细胞表面唾液酸受体的结合决定了流感病毒的宿主嗜性,其位点改变可能会影响病毒黏附宿主上呼吸道黏膜细胞,以及病毒的抗原性及其他生物学功能[13]。本研究结果显示,广州市H3N2流感病毒均在受体结合位点的前壁发生突变,分别位于T131K或T135K(N),与盐城市H3N2流感受体结合位点变异位点不同[14]。流感病毒HA蛋白糖基化位点的增加或减少可能会影响到病毒的抗原性、致病力等其他生物学功能变化。与同年度疫苗株相比,本研究毒株糖基化位点的变化主要发生在133-NGT、126-NWT和158-NYT的缺失,和135-NSS位点增加,其中变异频率较高的133位和135位主要位于抗原位点A区和受体结合位点的前壁,推测H3N2流感病毒的抗原性及宿主对病毒的识别可能会因此受到影响。综上,广州地区H3N2流感病毒HA蛋白重要氨基酸位点的变异呈现遗传多态性。
2011-2015年的监测研究发现,广东H3N2毒株主要分布在3C.3a分支,从2015年开始逐渐出现3C.2a分支[15]。本研究结果显示,2017年广州H3N2流感病毒均位于3C.2a分支,与同年度疫苗株A/Hong Kong/4801/2014归属于同一进化分支,但在该分支内,流行毒株又进一步进化形成3个不同的小流行分支,这种分支内的进化变异,可能是疫苗压力选择的结果。其中代表分支3C.2a.1是2016-2017年我国H3N2流感病毒优势进化分支[16],因此2018-2019年度疫苗推荐株A/Singapore/INFIMH-16-0019/2016就位于该进化分支内。进一步分析发现3C.2a1分支均带有N21K突变,这种2017年起源于香港的N21K突变株,可能是2016-2017 年中国香港暴发H3N2 病毒感染并导致300 多人死亡的一个重要因素[16],而H3N2流感病毒也是2017年广州市流感流行的主要病原,推测与携带有N21K位点突变的3C.2a1分支流行有关。此外广州流行毒株还形成另外两个小进化分支,分别与A/Beijingxicheng/1193/2016等2016年北京分离株和A/Iowa/25/2017等2017年美国分离株亲缘关系相近,提示广州H3N2病毒进化的多样性和复杂性。2018年开始,广州H3N2病毒尚未引起大范围流行,因此关于H3N2病毒的病原学研究尚缺乏相关数据,尽管2018-2019年度的疫苗推荐株A/Singapore/INFIMH-16-0019/2016位于3C.2a1分支,但另两个小分支病毒是否会进一步进化,从而取代3C.2a1 分支病毒,形成新的优势流行毒株,从而逃避现有疫苗株的免疫保护,需要密切关注。
利益冲突:无
