黑龙江东部大豆疫霉生理小种及毒性结构时空动态分析
2019-11-05贾梦瑱赵钰琦高新颖丁俊杰陈宇飞文景芝
贾梦瑱,张 斌,田 苗,2,揭 岩,赵钰琦,高新颖,顾 鑫,丁俊杰,陈宇飞,文景芝
(1.东北农业大学 农学院,黑龙江 哈尔滨 150030;2.黑龙江省农垦科学院 农畜产品综合利用研究所,黑龙江佳木斯 154007;3.黑龙江省农业科学院 佳木斯分院,黑龙江 佳木斯 154007)
由大豆疫霉(PhytophthorasojaeKaufmann & Gerdemann)侵染引起的大豆疫霉根腐病(Phytophthoraroot and stem rot,PRR)在世界范围内普遍发生,近年来在黑龙江省发生普遍,个别年份发生严重[1]。
大豆疫霉是典型的土传病原菌,以卵孢子在土壤中越冬。翌年春,卵孢子在适宜条件下萌发产生游动孢子侵染大豆[2]。自然条件下,大豆是大豆疫霉的唯一栽培寄主,二者的关系符合基因对基因学说。目前,已鉴定出28个抗大豆疫霉基因(Rps gene),分别是Rps1a、Rps1b、Rps1c、Rps1d、Rps1k、Rps2、Rps3a、Rps3b、Rps3c、Rps4、Rps5、Rps6、Rps7、Rps8、Rps9、Rps10、Rps11、RpsYD25、RpsYu25、RpsYD29、RpsUN1、RpsJS、RpsSN10、RpsYB30、RpsZS18、RpsAH、RpsUN2和一个未命名基因[3-4]。利用8个含单个不同Rps基因的大豆近等基因系作为鉴别寄主可以对大豆疫霉进行生理小种鉴定[5]。自1957年在美国鉴定出1号生理小种以来,陆续在美国、加拿大、澳大利亚、阿根廷和巴西等地鉴定出新生理小种[6],截至2014年,国际上已报道至少59个生理小种和许多新致病型(NewPhytophthorasojae, NPs)[7]。中国至少鉴定出34个生理小种[8-9],其中黑龙江32个[10],分别是0~5,8~11,13~15,17,21,23~26,29,33,34,38~40,42~45,48,49,54号[11-14]。1号生理小种在以前被认为是黑龙江省优势小种,其分离频率高达60%[11],但在2015年降至1.52%[14]。近年来虽然黑龙江省大豆疫霉生理小种报道很多,但缺乏长期定位调查结果。多年普查结果表明,黑龙江省PRR在东部发生严重。为鉴定黑龙江主要发病区大豆疫霉生理小种及致病型并揭示其随时间和空间而变化的规律,本试验连续4 a定点定期调查分析黑龙江东部发病较重的2块大豆试验田和2块大豆生产田中大豆疫霉生理小种及其毒性结构,为利用品种抗性防治黑龙江省PRR提供重要依据。
1 材料和方法
1.1 土壤样品采集
从发病严重的2块大豆试验田和2块大豆生产田采集土壤样品,分别为黑龙江省农科院佳木斯分院大豆品种试验田和佳木斯农垦科学院大豆品种试验田,佳木斯土龙山镇大豆生产田和佳木斯曙光一队大豆生产田。于2014-2017年7月病害发生盛期,在4个地块随机选取发病植株根际土,若当年某地块未发病,则在低洼处取长势弱的健康植株根际土。从每个地块至少随机取10份土样混合(每份约200 g)带回室内自然阴干,去除杂草石块等杂质,装入自封袋中密封保存。
1.2 大豆疫霉分离及致病性鉴定
参考文景芝等[8]的方法从土壤中分离大豆疫霉,并对菌株进行DNA分子鉴定。接种不含任何抗疫霉根腐病基因(rps)的感病品种Sloan做致病性鉴定[14],将确认为大豆疫霉的菌株移到CA斜面培养基上,在15 ℃保存备用。
1.3 大豆疫霉生理小种鉴定
采用下胚轴伤口接种法进行大豆疫霉生理小种鉴定[14]。鉴别寄主为国际通用的含有8个不同单基因(Rps1a、Rps1b、Rps1c、Rps1d、Rps1k、Rps3a、Rps6、Rps7)的大豆近等基因系[15],以不含任何Rps基因的大豆品种Sloan(rps)为感病对照。鉴别寄主种子由南京农业大学邢邯教授提供。抗性评价参考Yang等[16]方法,≥70%植株死亡记为感病(S),≤30%植株死亡记为抗病(R),30%~70% 植株死亡记为中间类型(IRT)。参考朱振东等[17]方法,列出感病互作中的Rps基因即为该菌株致病型(Pathotype),对照Russell[18]生理小种鉴定表确定生理小种号。
1.4 数据分析
利用Office 2016中的Excel软件进行数据分析。
2 结果与分析
2.1 黑龙江东部大豆疫霉群体结构分析
2.1.1 生理小种多样性 2014-2017年,从试验地块共分离鉴定出497株大豆疫霉,属于135种致病型其中的139个菌株被鉴定为29个已知生理小种,其余的357个菌株被鉴定为105个新致病型,1个菌株为IRT。29个已知生理小种的分离频率为0.2%~3.2%,优势度不明显,其中13号生理小种分离频率最高,为3.2%。新致病型优势度不明显,1a,3a致病型分离频率达到2.8%,其余新致病型分离频率为0.2%~2.6%。IRT型、2,18,22,42号生理小种以及12个新致病型仅占1株,分离频率为0.2%(表1)。
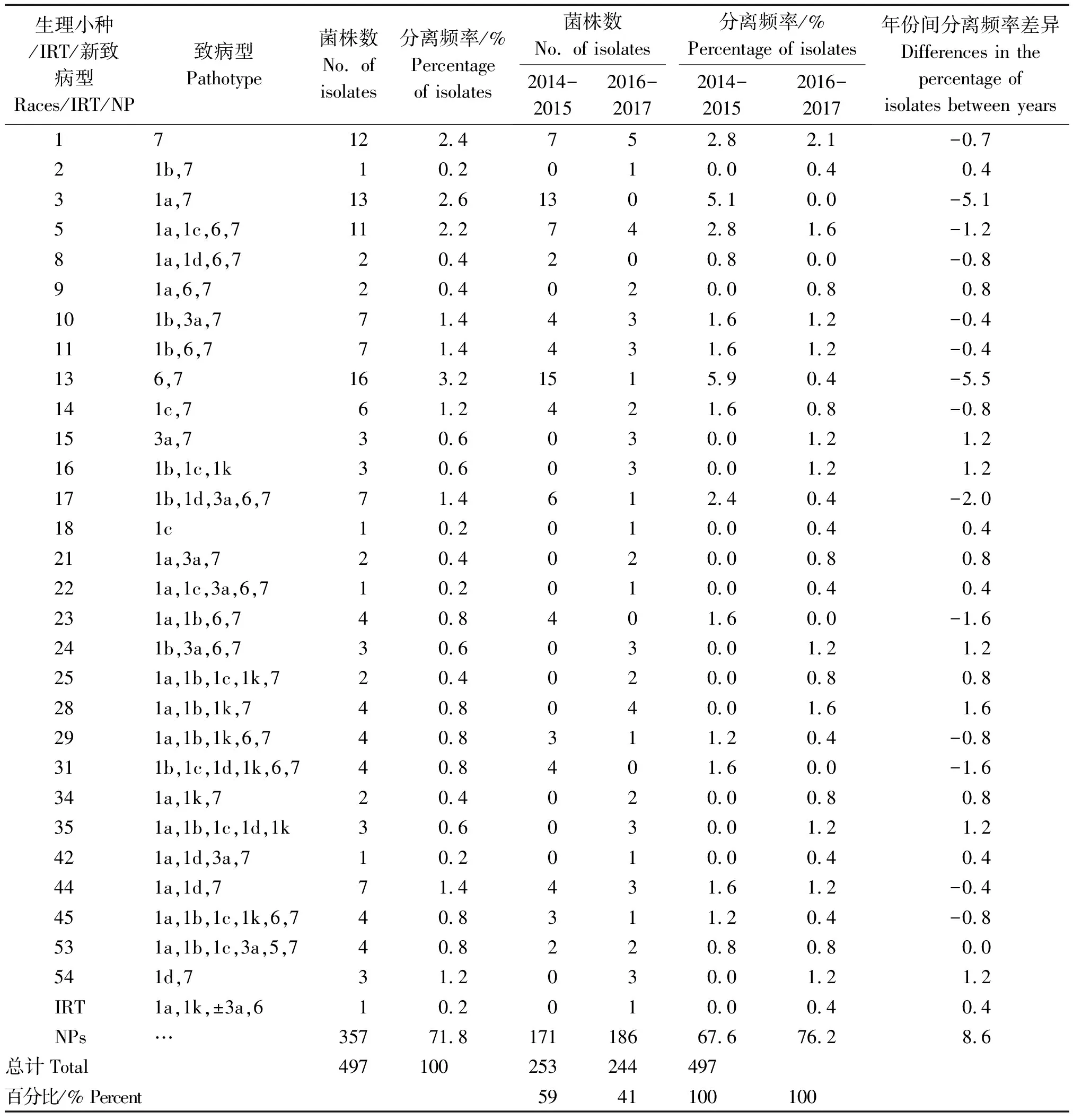
表1 2014-2017年黑龙江东部大豆疫霉生理小种、IRT和新致病型及其分离频率Tab.1 Races, IRT,new pathotypes and their percentages of Phytophthora sojae in Eastern Heilongjiang from 2014 to 2017
2.1.2 对单个Rps基因及Rps基因组合的致病频率 2014-2017年从4个地块分离到的497株大豆疫霉对8个Rps基因的致病频率为27.8%~53.1%,53.1%的菌株对Rps7有毒性,27.8%的菌株对Rps1k有毒性,对其他6个Rps基因的致病频率在31.6%~43.3%,说明在黑龙江东部种植含Rps1k、Rps3a、Rps1c和Rps6基因的大豆品种相对不易感病,含Rps7基因的大豆品种相对风险较高。该地区大豆疫霉群体可克服1~6个Rps基因,能克服1~3个Rps基因的菌株数占68.7%,能克服4~6个Rps基因的菌株数占31.2%,说明黑龙江东部大豆疫霉群体致病力偏弱(表2)。
2.2 黑龙江东部大豆疫霉群体结构时间动态
2.2.1 生理小种时间动态 2014-2015年从4个地块分离到253株大豆疫霉,其中的82株被鉴定为15个已知生理小种,其余的171个菌株被鉴定为40个新致病型。15个生理小种的分离频率为0.8%~5.9%,优势度不明显,其中13号生理小种分离频率最高,为5.9%,8号和53号生理小种分离频率最低,为0.8%,其余生理小种分离频率为1.2%~5.1%;新致病型优势度不明显,1a,3a致病型分离频率达到5.1%,其余新致病型分离频率为0.4%~4.7%。2016-2017年,从相同地块分离到244株大豆疫霉,其中的57株被鉴定为25个已知生理小种,其余的186株被鉴定为87个新致病型,1株为中间类型(IRT)。25个生理小种的分离频率为0.4%~2.1%,优势度不明显,其中1号生理小种分离频率最高,为2.1%,2,13,17,18,22,29,42,45号生理小种分离频率最低,为0.4%,其余生理小种分离频率为0.8%~1.6%。新致病型分离频率为0.4%~3.3%,优势度不明显,致病型1a,1b,1c分离频率最高为3.3%,其余新致病型分离频率为0.4%~2.5%(表1)。

表2 黑龙江东部大豆疫霉群体对单个Rps基因及Rps基因组合的致病频率Tab.2 Virulence frequencies of Phytophthora sojaepopulation to single Rps gene and Rps gene combination in the East of Heilongjiang
2016-2017年与2014-2015年共同出现的生理小种有11个,分别是1,5,10,11,13,14,17,29,44,45,53号,重复率37.9%,除53号生理小种分离频率保持不变外,其他生理小种分离频率均随时间推移而降低,13号小种降低5.5百分点,10,11,44号小种降低0.4百分点,其余小种降低0.7~2.0百分点。2年共同出现的新致病型有22个,重复率20.3%,14个新致病型分离频率增加0.9~7.4百分点,8个新致病型分离频率降低0.9~12.1百分点。2016-2017年新增14个生理小种,分别是2,9,15,16,18,21,22,24,25,28,34,35,42,54号,占48.3%;新增65个新致病型,占63.0%。比2014-2015年减少4个生理小种,分别是3,8,23,31号小种,占13.8%,减少18个新致病型,占16.7%。可见随时间推移,共同出现的生理小种分离频率降低,但生理小种分化迅速,出现更多生理小种和新致病型,表明黑龙江东部大豆疫霉群体毒性组成更加复杂化、多样化。
2.2.2 对单个Rps基因致病频率时间动态 2014-2015年的253株大豆疫霉对8个Rps基因致病频率为21.7%~57.7%,<30%的菌株对Rps1k(21.7%)、Rps3a(23.3%)和Rps1c(29.6%)有毒性,>50%的菌株对Rps7(57.7%)有毒性,对其余4个Rps基因致病频率为30.8%~41.1%。从病原菌致病频率看,抗病基因对该病原菌的有效性由高到低依次为:Rps1k>Rps3a>Rps1c>Rps1b>Rps1d=Rps6>Rps1a>Rps7;2016-2017年的244株大豆疫霉对8个Rps基因致病频率为29.5%~49.6%,<30%的菌株对Rps6(29.5%)有毒性,49.6%的菌株对Rps1b有毒性,对其余6个Rps基因致病频率为34.0%~48.8%,从病原菌致病频率看,抗病基因对该病原菌的有效性由高到低依次为:Rps6>Rps1k>Rps1c>Rps1d>Rps3a>Rps1a>Rps7>Rps1b(表2)。
与2014-2015年相比,2016-2017年的群体对Rps6和Rps7有毒性的菌株分别减少8.0,8.9百分点,对其余6个Rps基因有毒性的菌株增加4.4~18.8百分点。2014-2015年对致病频率低于和接近30%的4个Rps基因(Rps1k、Rps3a、Rps1c和Rps1b)的致病频率分别增加12.3,16.9,7.3,18.8百分点,增幅排在前4位,说明这4个曾经有效的Rps基因正在逐渐失去其有效性。而对原来致病频率较高的Rps基因,随着时间推移致病频率或者稍有提高(如Rps1a和Rps1d),或者下降(如Rps7和Rps6)。总体来说,随着时间推移,黑龙江东部大豆疫霉群体对绝大多数Rps基因的致病频率增加,预示着绝大多数Rps基因的有效性在下降(表2)。
2.2.3 群体致病力时间动态 2016-2017年,黑龙江东部大豆疫霉群体能克服1~6个Rps基因,与2014-2015年相同,能克服1~3个Rps基因的菌株占62.4百分点,比2014-2015年降低12.6百分点,能克服4~6个Rps基因的菌株占37.7%,比2014-2015年增加12.9百分比。说明随时间推移,黑龙江东部大豆疫霉群体致病力增强,单株大豆疫霉即可克服更多Rps基因(表2)。
2.3 黑龙江东部大豆疫霉群体结构空间动态
2.3.1 生理小种空间动态 大豆疫霉生理小种在不同类型地块的种类和数量也不同。试验田分离到246株大豆疫霉,其中的69株被鉴定为18个已知生理小种,其余176株被鉴定为64个新致病型,1个菌株为IRT。18个生理小种的分离频率为0.4%~5.3%,优势度不明显,其中3号生理小种分离频率最高,为5.3%,2,18,22号生理小种和IRT分离频率最低,为0.4%,其余生理小种分离频率为0.8%~3.3%;新致病型优势度不明显,分离频率为0.4%~3.7%,1c,1d分离频率达到3.7%,其余新致病型分离频率为0.4%~2.9%。生产田分离到251株大豆疫霉,其中的70株被鉴定为21个已知生理小种,其余181株被鉴定为65个新致病型。21个生理小种的分离频率为0.4%~4.0%,优势度不明显,其中13号生理小种分离频率最高,为4.0%,11,24,35,42,44号生理小种分离频率最低,为0.4%,其余生理小种分离频率为0.8%~3.2%,新致病型分离频率为0.5%~4.0%,优势度不明显,其中致病型1a,3a分离频率最高,为4.0%,其余新致病型分离频率为0.4%~3.6%。
试验田与生产田有10个共同生理小种,分别是1,5,10,11,13,15,24,28,35,44号,重叠率34.5%,试验田有8个小种单独存在,分别是2,3,18,21,22,25,29,45号,生产田有11个小种单独存在,分别是8,9,14,16,17,23,31,34,53,54号。与生产田相比,试验田1,13号生理小种分离频率降低1.6百分点,5号生理小种分离频率上升最高,为2.1百分点,10,24,35号生理小种分离频率上升0.4百分点,11,44号生理小种分离频率上升2.0百分点,28号小种分离频率没有变化;2个地块共同出现的新致病型有24个,重复率为22.2%,与生产田相比,试验田14个新致病型分离频率增加0.9~10.2百分点,10个新致病型分离频率降低0.9~11.1百分点。试验田中3号生理小种分离频率最高,为5.3%,生产田中13号生理小种分离频率最高,为4.0%,试验田比生产田减少41个新致病型,占39.8%。从试验结果发现,生产田和试验田生理小种和新致病型种类有所区别,而数量差别不大(表3)。
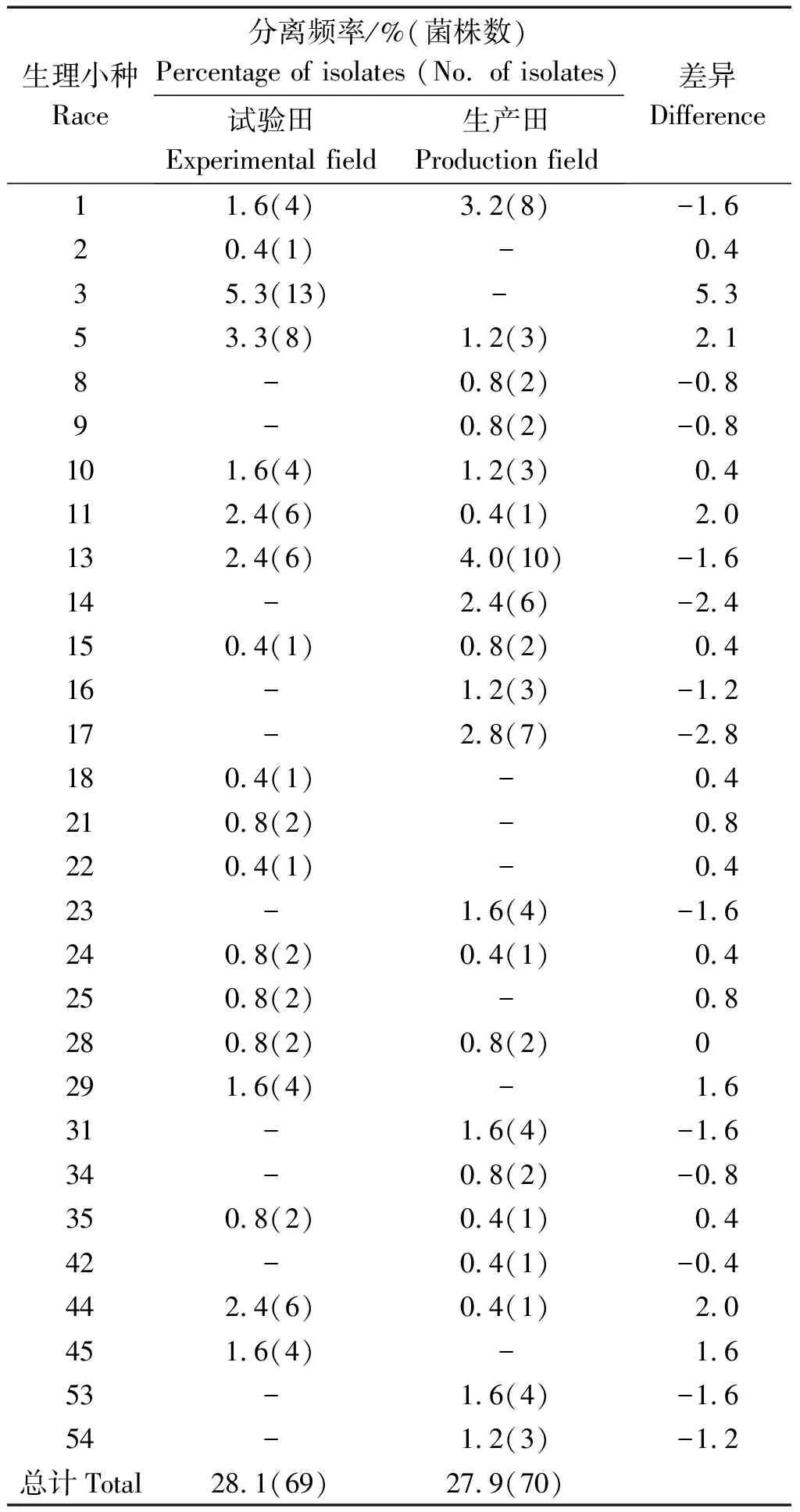
表3 不同地块生理小种及其分离频率Tab.3 The races and their isolation frequencies of Phytophthora sojae in different fields
2.3.2 对单个Rps基因致病频率空间动态 试验田246株大豆疫霉对8个Rps基因致病频率为30.5%~57.3%,>50%的菌株对Rps7(57.3%)有毒性,对其余7个Rps基因致病频率为30.5%~45.1%。从病原菌致病频率看,试验田抗病基因对病原菌的有效性由高到低依次为:Rps1k>Rps3a>Rps6>Rps1d=Rps1c>Rps1b>Rps1a>Rps7;生产田251株大豆疫霉对8个Rps基因致病频率为25.1%~49.0%,<30%的菌株对Rps1k(25.1%)有毒性,对其余7个Rps基因致病频率为30.3%~49.0%。从病原菌致病频率看,生产田抗病基因对病原菌的有效性由高到低依次为:Rps1k>Rps1c>Rps3a>Rps6>Rps1d>Rps1a>Rps1b>Rps7(表4)。
试验田大豆疫霉群体对5个Rps基因(Rps1a、Rps1c、Rps1k、Rps6和Rps7)的致病频率高于生产田,对其余3个Rps基因的致病频率低于生产田,说明Rps1a、Rps1c、Rps1k、Rps6和Rps7在试验田中有效性比在生产田低。试验田中较有效的Rps基因为Rps1k和Rps3a,生产田中较有效的Rps基因为Rps1c和Rps1k,Rps7在试验田和生产田中的有效性均最低。
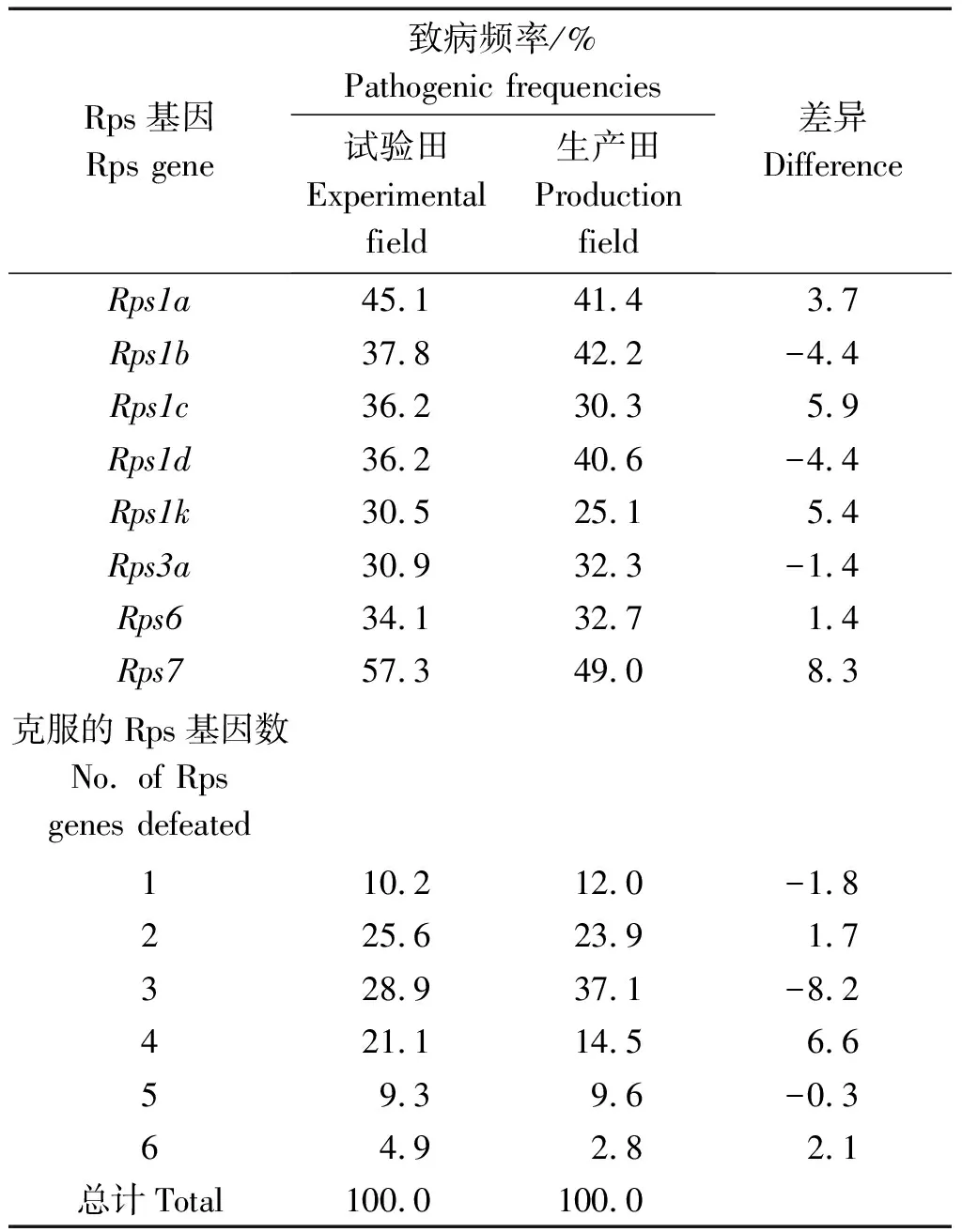
表4 不同地块大豆疫霉群体对单个Rps基因及Rps基因组合致病频率Tab.4 Virulence frequencies of Phytophthora sojae population to single Rps gene and Rps gene combination in different fields
2.3.3 群体致病力空间动态 黑龙江东部试验田菌株能克服1~6个Rps基因,与生产田相同,能克服1~3个Rps基因的菌株占64.7%,比生产田降低8.3百分点;能克服4~6个Rps基因的菌株占35.3%,比生产田增高8.4百分点。表明黑龙江省东部试验田大豆疫霉群体致病力较强,单株大豆疫霉可克服更多的Rps基因(表4)。
3 结论与讨论
大豆根腐病由多种病原菌侵染引起,包括多种镰孢菌(Fusariumspp.)、腐霉菌(Pythiumspp.)、立枯丝核菌(RhizoctoniasolaniKuhn)和大豆疫霉(Phytophthorasojae)[8]。与其他根腐病原菌相比,大豆疫霉是一种难分离的病原菌。此外,土壤中和病组织上还有大量腐生细菌和真菌也会干扰分离效果。大豆疫霉分离通常有病组织分离法、土壤诱捕分离法。有研究仅从病组织上分离大豆疫霉[19],也有研究从病组织和土壤中共同分离大豆疫霉[20],但土壤分离法得到的菌株更具代表性[21]。由于当年种植的寄主品种只对土壤中的部分大豆疫霉具有选择性,一旦更换不同基因型品种,选择性就会改变,因此,只从病组织上分离获得的大豆疫霉菌株不能完全代表土壤中大豆疫霉群体。本试验采用土壤分离法,避免因大豆品种基因型对土壤中大豆疫霉基因型的选择性而导致的试验偏差,得到的大豆疫霉群体更具代表性,数据更准确。本试验参考文景芝等[8]的叶碟诱捕法加以改进:处理土壤时即加入五氯硝基苯和匹马霉素抑制真菌,加入利福平、硫酸链霉素和万古霉素抑制细菌,加入恶霉灵抑制腐霉菌,并在选择性培养基中加入万古霉素和匹马霉素,大大提高了分离效率。此外,采用形态学和DNA分子鉴定相结合的方法,再加上接种不含任何抗疫霉根腐病基因的大豆品种Sloan鉴定致病性,确保菌株为大豆疫霉。
目前,在中国已经报道了34个大豆疫霉生理小种,除6,7号外,其余32个生理小种在黑龙江均有报道。本试验鉴定出的29个生理小种中,16,18,22,28,35号为中国首次报道,而原有的4,33,38,39,43,48,49号没有被分离到。原来在黑龙江一直占优势的1号生理小种的分离频率从2008年的60%[10],降到2015年的1.52%[14]和2016年的3.6%[8],本试验又继续降低到2.4%,与分离频率最高的3,13号生理小种(分离频率2.6%和3.2%)基本持平。分析其原因,一方面是由于以往大豆疫霉菌株一般分离自病株,受到大豆品种基因型的选择,菌株致病型多样性较低;另一方面,1号生理小种只对Rps7有毒性,而3,13号生理小种除对Rps7有毒性外,还分别增加了对Rps1a和Rps6的毒性,可以看成是在1号生理小种基础上分别聚合了对Rps1a和Rps6基因毒性演变而来的,本试验中53.1%的菌株都是在1号生理小种基础上聚合了对1~5个Rps基因的毒性演变而来,导致1号生理小种失去优势,同时增加了单个菌株的毒性。与2014-2015年相比,2016-2017年新增14个生理小种和65个新致病型,减少了4个生理小种和18个新致病型,表明随时间推移,黑龙江东部大豆疫霉生理小种分化迅速,年度间即发生显著变异,毒性结构组成更加复杂化多样,与文景芝等[8]的结论一致。黑龙江东部大豆疫霉群体致病力较弱,表现在能克服1~3个Rps基因的菌株占2/3,但也存在少量强毒性菌株,如17.3%的菌株能克服4个Rps基因,9.5%的菌株能克服5个Rps基因,3.8%的菌株能克服6个Rps基因。在2009年,黑龙江东部大豆疫霉100%的菌株对Rps7有毒性,50%的菌株对Rps1d和Rps6有毒性,25%的菌株对Rps1a和Rps1b有毒性,没有菌株能克服Rps1c和Rps1[22],但到2017年,对Rps7、Rps1d和Rps6有毒性的菌株有所减少,对Rps1a、Rps1b、Rps1c和Rps1k有毒性的菌株有所增加,说明随时间推移,黑龙江东部大豆疫霉群体毒性结构发生显著变异,导致曾经有效的Rps基因丧失抗病优势。
通过对生产田和试验田数据分析发现,生理小种和新致病型数量差异不大,但种类差异较大,只有1/3的生理小种和1/4的新致病型是重复的,说明在没有基因交流的2个地块间,生理小种和新致病型发生显著变异。与生产田相比,试验田大豆疫霉群体对Rps1a、Rps1c、Rps1k、Rps6和Rps7有毒性的菌株有所增加,对Rps1b、Rps1d和Rps3a有毒性的菌株有所减少,说明Rps1a、Rps1c、Rps1k、Rps6和Rps7在试验田中更危险,Rps1b、Rps1d和Rps3a更安全。试验田能克服4~6个Rps基因的菌株比生产田增加8.3%,说明试验田大豆疫霉群体致病力较强;试验田比生产田少分离3个小种,新致病型减少41个,说明试验田群体毒性结构较简单,与文景芝等[8]结论一致。试验田大豆品种会每年更换,而生产田大豆品种较单一,依据寄主对病原菌的选择性,推测试验田大豆疫霉群体毒性结构应该更复杂些,但本试验结果恰恰相反,原因可能是本试验选取的试验田种植的大豆品种具有相同的系谱关系,如黑龙江省农科院佳木斯分院大豆品种试验田种植的合丰60和合丰55等是以北丰11为母本经过有性杂交、系谱法选育而成的[23],2个品种亲缘关系相近,遗传背景相似,虽然轮换种植,但对土壤中大豆疫霉群体具有相同的定向选择性,导致该地块大豆疫霉群体毒性结构多样性降低;而生产田一旦更换大豆品种,很可能就是毫无亲缘关系的,使生产田大豆疫霉群体毒性结构复杂多样。
