过表达小麦锌指型转录因子基因TaZAT8烟草根系差异蛋白的鉴定
2019-11-05丁维维蒋明月苏晓帅李小娟
顾 倩,丁维维,蒋明月,苏晓帅,李小娟,肖 凯
(1.河北农业大学 生命科学学院,河北省植物生理与分子病理学重点实验室,河北 保定 071001;2.河北农业大学 农学院,河北 保定 071001)
磷素供应水平对作物生化代谢、生长发育和产量形成能力具有重要影响。由于磷素在土壤中容易被吸附和固定的特性,土壤中的磷素多以不能被植物吸收利用的难溶态形式存在,长期施用磷肥已经成为改善作物产量的重要途径之一[1]。提高土壤中磷素和施用磷肥的利用效率,对于缓解世界范围内的磷资源紧缺,促进农业生产可持续发展具有重要意义[2]。
前人研究表明,转录因子在调控植株应答低磷逆境过程中发挥重要作用[3-4]。其中,锌指蛋白作为一类重要转录因子,结合Zn2+后形成短的可折叠成“手指”的结构,执行特定的生物学功能。根据半胱氨酸和组氨酸的数量与位置,锌指转录因子分为C2H2、C2HC、C2HC5、C2C2、CCCH、C3HC4、C4、C4HC3、C6和C8型等类型[5]。在植物种属中,C2H2型锌指蛋白参与了许多重要的代谢途径和应答胁迫及防卫激活的反应[6-9]。近年来研究表明,C2H2型锌指蛋白还参与植株应答低磷逆境的过程。如拟南芥的C2H2型基因Zat6的表达与根发育和细胞中磷稳态的调节有关,过表达Zat6拟南芥株系,植株抵御低磷逆境的能力显著增强[10]。
作者前期研究表明,1个C2H2型小麦锌指基因TaZAT8呈低磷胁迫诱导特征,过表达该基因的烟草株系,通过上调表达磷转运蛋白基因及保护酶基因等途径,具有改善植株抵御低磷逆境的能力[11]。为进一步揭示TaZAT8调控植株应答低磷逆境分子机制,本研究采用蛋白质组学技术,对正常培养的野生型与转TaZAT8基因烟草株系蛋白表达谱进行了分析,旨在从蛋白水平阐明该基因参与调控的生物学过程。
1 材料和方法
1.1 试验材料
供试材料为作物高产抗逆分子生物学实验室野生型和过表达TaZAT8基因烟草(N.tabacumcv Wisconsin 38)[11]。
挑选饱满健康的野生型和过表达TaZAT8基因烟草种子,用75%酒精杀菌1 min,无菌水清洗后分别撒在湿润蛭石上,28 ℃暗培养约7 d萌芽,待生长到四-五叶期时挑选长势一致的幼苗移植到培养盘中,使用Hoagland′s营养液培养10~15 d左右收取幼苗根系,液氮冻存备用。
1.2 蛋白组学试验及方法
1.2.1 蛋白质样品制备及含量测定 采用酚抽提法提取烟草植株根部总蛋白[12],将1 g 样品在液氮下充分研磨成极细粉,加提取液4 mL,化冻后加PMSF(100∶1)和1.3 mol/L DTT(50∶1),继续研磨至匀浆后转入离心管,加入4 mL Tris-饱和酚振荡30 min,4 ℃ 12 000 r/min离心15 min,取上清,加入等体积抽提液4 000 r/min振荡25 min,离心15 min。取上清,加入4~5倍体积的0.1 mol/L甲醇醋酸铵上下颠倒混匀,-20 ℃沉淀2 h以上,4 ℃ 12 000 r/min离心10 min,弃上清。用冷甲醇和冷丙酮分别洗涤沉淀3次后于真空冷冻干燥机中干燥。蛋白干粉先以每1.4 mg干粉加100 μL Lysis Buffer(7 mol/L 尿素, 2 mol/L 硫脲, 4% CHAPS, 2% 安福灵 pH值3.5~10,1% DTT)的比例溶解,采用 Bradford 蛋白定量方法测定蛋白浓度。
1.2.2 蛋白质双向电泳
1.2.2.1 第一向固相pH值梯度等电聚焦 双向电泳第一向采用长度13 cm,pH值 4~7的线性干胶条,将蛋白提取液与水化缓冲液(1% DTT、1% IPG Buffer、1×BPB、RB)混合至总体积250 μL,加入到GE水化盘中,覆盖上干胶条泡胀过夜(10~12 h)。把泡胀好的胶条转移到等电聚焦盘,按以下参数进行聚焦:300 V 1 h S、500 V 1 h S、1 000 V 1 h S、8 000 V 2 h G、8 000 V 2 h S、500 V 12 h S 保护电压。第一向电泳结束后,将胶条置于平衡缓冲液(50 mmol/L Tris-HCl、6 mol/L尿素、30%甘油、2% SDS、0.002%溴酚蓝)平衡2次,每次15 min。第一次平衡和第二次平衡分别在缓冲液中加入100 mmol/L DTT 和250 mmol/L IAA。
1.2.2.2 第二向SDS-PAGE电泳 将平衡好的胶条加到二向胶面上,30 mA每块胶,直至电泳结束。
1.2.3 染色成像及分析
1.2.3.1 染色与扫描 将电泳完成的胶片放到固定液中(40 mL 乙醇、25 mL 冰醋酸、50 mL超纯水)固定20 min后,转移至0.1%的考马斯亮蓝R-250染色液中染色2 h。染色完毕将胶片转移到脱色液中脱色直至蛋白点清晰。打开Image Scanner扫描仪及扫描软件,扫描成像。
1.2.3.2 图像分析 转基因样品与对照之间的差异点通过Image Master 2D Platinum 7分析软件进行分析,设定相应的landmark作为内标,通过软件计算蛋白点相对含量的变化来确定蛋白表达的变化。差异蛋白点为相对表达丰度上调(出现)或下调差异大于1.5倍(Ratio>1.5),并且在统计学t检验上P<0.05的蛋白质。
1.2.4 质谱分析 挖取差异蛋白,送华大蛋白公司应用MicroTOF-QII(Bruker Daltonics)质谱仪进行LC-MS/MS质谱鉴定。
1.2.5 蛋白质功能鉴定 对鉴定蛋白质进行GO分析,注释生物过程和分子功能。
2 结果与分析
2.1 过表达TaZAT8基因烟草蛋白表达谱分析
采用双向电泳技术,获得正常培养的野生型与过表达TaZAT8基因烟草株系的蛋白表达谱。利用Image Master 2D Platinum 7分析软件对图像进行分析,共得到811个蛋白点,其中有22个蛋白点的表达量发生了变化(图1),包括上调蛋白(U)20个(其中包含1个诱导蛋白),下调蛋白(D)2个(图1)。

差异蛋白点用箭头标出。The differentially expressed protein spots are indicated by arrows.
2.2 差异蛋白鉴定
22个差异蛋白的表达量变化在1.76~3.72倍(表1),挖取后酶解进行LC-MS/MS质谱鉴定。参考Schiltz等[13]的分类标准,上述22个差异蛋白点归属于6个功能类别,包括物质代谢(U1、U2、U6、U12和U14,22.7%)、逆境应答与细胞保护(U3、U4、U8和U17,18.2%)、能量代谢(U5、U10、U13、 U19 和D1,22.7%)、转录翻译(U7、U16、U18和D2,18.2%)、蛋白质转换(I1、U11和U15,13.6%)和未知蛋白类(U9,4.5%)(表1)。鉴定的差异蛋白以物质代谢类和能量代谢类别最多,其中物质代谢涉及氨基酸、次生物和糖复合物等的合成;能量代谢包括部分糖酵解和三羟酸循环的酶类。其次是逆境响应与细胞保护类别,超氧化物歧化酶和抗坏血酸过氧化物酶等得到鉴定,可见过表达TaZAT8对多个生物学过程产生了影响。
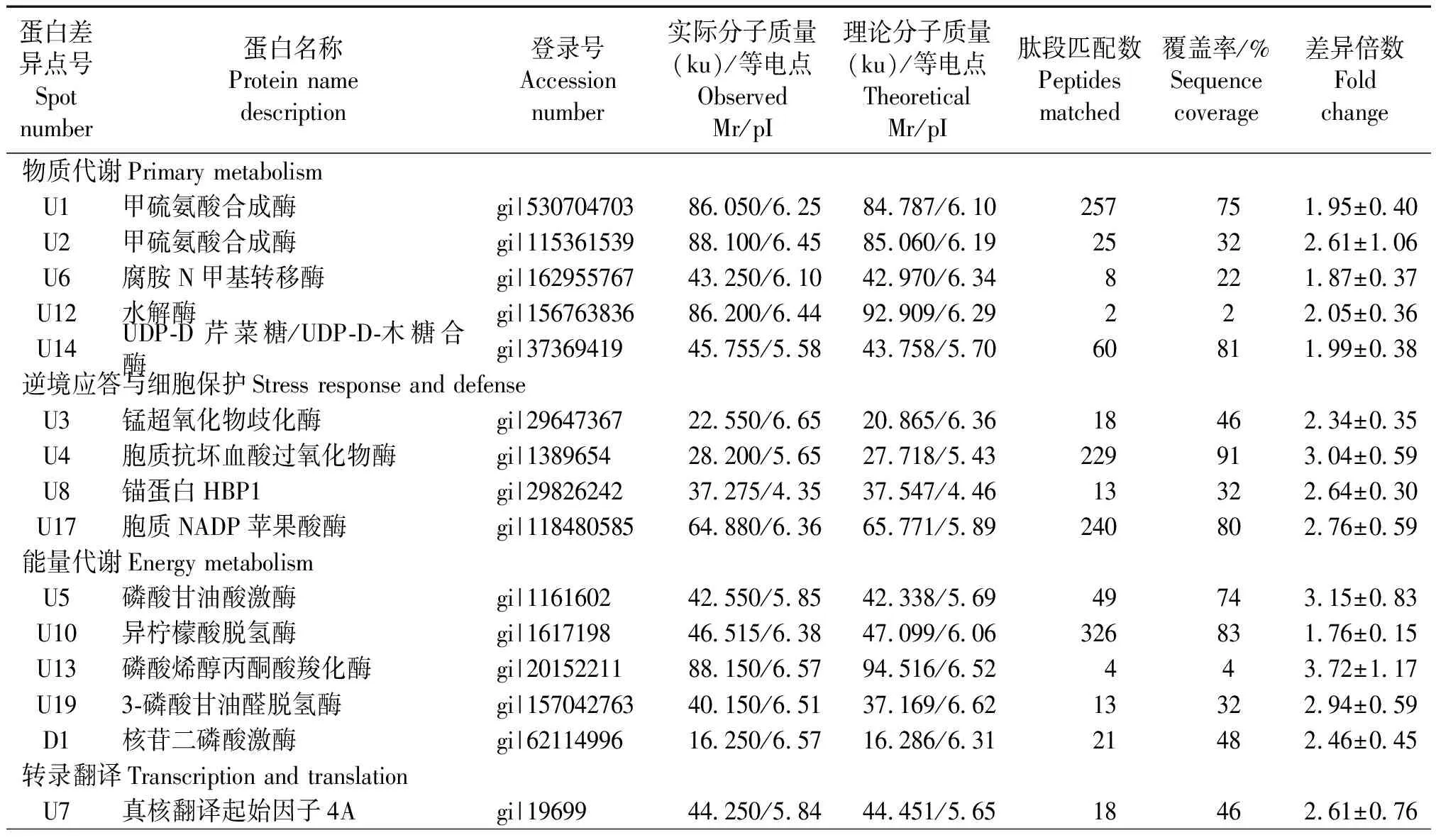
表1 过表达TaZAT8基因烟草根系差异表达蛋白Tab.1 Identification of proteins that were significantly differentially expressed in tobacco root overexpressing TaZAT8

表1(续)
注: I、U和D分别为与野生型相比,转基因植株中诱导、上调和下调的蛋白。差异倍数.表示相对表达量差异倍数。数值为倍数平均值±s(n=3)。
Note:I, U and D represent induced, upregulated and downregulated spots respectively in transgenic lines when compared with wild plants.Fold change.The fold change relative expression amount of wild and overexpressing lines samples.Date are presented as means±s(n=3).
2.3 差异蛋白点亚细胞定位分析
利用Softberry程序,对鉴定的差异蛋白亚细胞定位特征进行了预测。结果表明,10个差异蛋白(U1、U2、U4、U5、U9、U11、U13、U17、U18、U19)定位于细胞质中,组成了最大的一类亚细胞定位蛋白;另有7个蛋白(U3、U6、U10、U12、U14、U16、D1)定位于线粒体中;还包括2个(U8、I1)过氧化物酶体定位蛋白;2个(U7、U15)细胞核定位蛋白;此外,还有1个蛋白(D2)定位于叶绿体(图 2)。
2.4 差异表达蛋白GO分析
对成功鉴定的差异蛋白进行生物过程GO分析,结果发现,22个鉴定蛋白属于19个GO分类。其中,包含蛋白质数目最多的为参与小分子代谢过程,共有6个,其次为分别包含4个蛋白参与的分解代谢、细胞氮化合物代谢、代谢物前体和能量产生、生物合成过程,分别包含3个蛋白参与的碳水化合物代谢、单一生物过程、单机体碳水化合物代谢、逆境应答,2个蛋白参与的单机体分解代谢、细胞氨基酸代谢、辅因子代谢、硫化物代谢和细胞蛋白质修饰过程(图3);在分子功能GO分析中,鉴定的差异蛋白分别属于15个GO分类。其中,10个蛋白质属于离子结合分类,5个属于氧化还原酶类。结果表明,过表达TaZAT8基因对物质代谢、能量产生、逆境应答等生物过程产生调控效应,在分子功能中则主要参与离子结合和氧化还原酶活性的调节(图3)。

图2 野生型和过表达TaZAT8基因植株差异表达蛋白亚细胞定位分析Fig.2 Subcellular localization analysis of differentially expressed proteins in wild and over expressing TaZAT8 plants

1.小分子代谢过程;2.分解代谢过程;3.细胞氮化合物代谢过程;4.代谢物前体和能量产生过程;5.生物合成过程;6.碳水化合物代谢过程;7.单一生物过程;8.单机体碳水化合物代谢过程;9.逆境应答;10.单机体分解代谢过程;11.细胞氨基酸代谢过程;12.辅因子代谢过程;13.硫化物代谢过程;14.细胞蛋白质修饰过程;15.DNA代谢过程;16.染色体组织生物过程;17.tRNA代谢过程;18.蛋白质折叠;19.内部结构发育;20.离子结合功能;21.氧化还原酶活性;22.甲基转移酶活性;23.解旋酶活性;24.激酶活性;25.翻译因子活性;26.酶结合;27.肽酶活性;28.核酸酶活性;29.ATP酶活性;30.裂解酶活性;31.异构酶活性;32.连接酶活性。
1.Small molecule metabolic process;2.Catabolic process;3.Cellular nitrogen compound metabolic process;4.Generation of precursor metabolites and energy;5.Biosynthetic process;6.Carbohydrate metabolic process;7.Single-organism biosynthetic process;8.Single-organism carbohydrate metabolic process;9.Response to stress;10.Single-organism catabolic process;11.Cellular amino acid metabolic process;12.Cofactor metabolic process;13.Sulfur compound metabolic process;14.Cellular protein modification process;15.DNA metabolic process;16.Chromosome organization biological process;17.tRNA metabolic process;18.Protein folding;19.Anatomical structure development;20.Binding molecular function;21.Oxidoreductase activity;22.Methyltransferase activity;23.Helicase activity;24.Kinase activity;25.Translation factor activity, RNA binding;26.Enzyme binding;27.Peptidase activity;28.Nuclease activity;29.ATPase activity;30.Lyase activity;31.Isomerase activity;32.Ligase activity.
图3 差异蛋白质GO功能注释结果
Fig.3 GO function annotation results of differentially expressed proteins
3 讨论与结论
研究证实,C2H2型锌指蛋白转录因子在介导植株抵御低磷等非生物逆境的过程中发挥重要功能。对拟南芥的研究表明,过表达C2H2锌指蛋白基因Zat6的拟南芥植株增强了对低磷胁迫的抵御[10]。作者前期对过表达小麦该类转录因子基因TaZAT8的烟草植株研究表明,低磷逆境下转化株系通过多个过程的调节,介导了植株对低磷逆境的响应[11]。
本研究应用蛋白质组学技术,鉴定了在过表达TaZAT8烟草根系发生差异表达的22个蛋白。上述蛋白分布于细胞的不同部位,参与了不同代谢过程或体现不同类别的酶活性。其中5个参与物质代谢的蛋白发生上调表达,包括2个甲硫氨酸合成酶蛋白点(U1和U2)。该酶是植物必需氨基酸甲硫氨酸合成的关键酶,通过其代谢产物可控制乙烯等关键代谢物水平[14]。此外,与烟碱合成相关的腐胺N甲基转移酶(U6)也在转基因烟草中上调表达。水解酶(U12)经同源查询为锌磷酸二酯酶ELAC2,其功能是在锌离子存在的情况下水解细胞内第二信使。UDP-D芹菜糖/UDP-D木糖合酶(U14)是许多糖复合物合成的重要核苷糖供体[15]。上述结果表明,过表达TaZAT8基因对植株体内多个物质代谢过程具有明显的调控效应。
22个差异蛋白中还有5个参与能量代谢。磷酸甘油酸激酶(PGK, U5)和三磷酸甘油醛脱氢酶(GAPDH, U19)是EMP途径的重要酶类。GAPDH在植物抗氧化胁迫和应答氧化还原信号转导中发挥重要作用。有研究表明,水稻三磷酸甘油醛激酶OsGAPC3通过提高过氧化氢酶活性避免了盐胁迫下H2O2对细胞的伤害[16]。异柠檬酸脱氢酶(ICDH, U10)是TCA循环的限速酶[17],磷酸烯醇式丙酮酸羧化酶(U13)催化磷酸烯醇式丙酮酸产生草酰乙酸,为TCA循环补充原料。核苷二磷酸激酶(NDPK, D1)转移NTP和NDP之间的高能磷酸基团,参与植物生长发育和逆境应答等。上述差异表达蛋白参与了过表达TaZAT8植株中能量水平供应和保护功能。
包括锰超氧化物歧化酶(U3)、胞质抗坏血酸过氧化物酶(U4)、锚蛋白HBP1(U8)和胞质NADP苹果酸酶NADP-ME(U17)的4个逆境响应与细胞保护类差异蛋白也在本研究中被鉴定。超氧化物歧化酶和抗坏血酸过氧化物酶是重要抗氧化剂,通过清除活性氧减轻细胞活性氧损伤[18-19]。NADP苹果酸酶保持植物细胞渗透势和清除活性氧等方面起重要作用[20-21]。有报道指出,NADP-苹果酸酶的表达受到干旱诱导,超表达水稻NADP-苹果酸酶基因增强了拟南芥株系的抗盐胁迫能力[22-23]。因此,过表达TaZAT8植株通过增强上述保护蛋白的表达水平优化了活性氧清除和保护系统。
本研究还发现,3个蛋白质转换类蛋白包括蛋白酶体β4亚基(I1)、2个上调蛋白FK506结合蛋白(U11)和泛素结合酶E2(U15)呈上调或诱导表达。其中,FK506结合蛋白(FKBPs)作为分子伴侣参与蛋白质的辅助折叠,在逆境防御和生长发育等过程扮演重要角色[24-25]。蛋白酶体β4亚基和泛素结合酶E2为泛素蛋白酶体途径重要组分,可对蛋白质进行选择性降解,清除损伤或异常蛋白质,参与植株逆境应答、细胞信号转导和细胞凋亡等生理过程[26]。过表达拟南芥泛素结合酶UBC32,植株对盐分胁迫的抗性增强[27]。水稻OsPHO2基因编码泛素结合酶E2,研究发现其与磷酸盐转运相关蛋白OsPHF1及OsPHO1;2互作,构建磷饥饿应答信号重要途径[28]。上述结果表明TaZAT8还通过稳定蛋白结构或胞内蛋白降解途径,参与磷胁迫信号的转导过程。
本研究采用双向电泳技术,获得野生型与过表达TaZAT8基因烟草株系的蛋白表达谱,挖取22个差异点进行LC-MS/MS质谱分析,鉴定的差异蛋白主要参与物质代谢、逆境响应及细胞保护、蛋白质降解、分子伴侣水平以及能量调控。亚细胞定位预测以上蛋白主要定位于细胞质、线粒体、过氧化物酶体、细胞核和叶绿体等部位;GO分析表明,差异蛋白参与了不同代谢过程或体现不同类别的酶活性。综上,TaZAT8通过调控细胞保护、物质和能量代谢、逆境响应蛋白的表达水平,为增强植株应答和抵御低磷逆境奠定了基础。
