牛奶中大肠杆菌对抗生素的耐药性研究*
2019-11-04刘海锋张艳娇廖小微孙丰慧郭莉娟
刘海锋,张艳娇, 廖小微,孙丰慧,代 敏, 郭莉娟△
1.成都医学院 检验医学院(成都 610500);2.成都医学院 四川省动物源性兽药残留防控工程实验室 (成都 610500)
牛乳营养丰富、易于吸收、经济方便,适用于婴幼儿和青少年的生长发育,有利于骨质疏松、高血脂症等疾病的治疗,在人类饮食生活中扮演着重要的角色[1]。目前,牛乳的污染主要来源于致病菌、鲜乳腐败变质和化学毒物,其中牛乳的腐败变质主要是由细菌引起,主要来源于牛体自身的大肠杆菌(Escherichiacoli,E.coli)最为常见,可分解鲜乳中的乳糖、蛋白质等营养物质,使牛乳产生酸味和恶臭,不可食用[2]。随着科技的发展,抗生素的种类和使用量逐渐变多[3],许多牧场主为了提高牛的免疫力,预防乳房炎等疾病,使用多种抗生素,部分场主甚至违反规定,不合理使用抗生素,使牛乳房内自带的微生物菌群产生相应的耐药性,加之牛乳加工操作、运输和贮存等不规范,使耐药菌杀灭不彻底或细菌的再污染,通过食物链传播给人类,致使抗生素失效,严重威胁到人类健康。抗生素的大量使用和牛对抗生素的少量吸收,使其大部分随牛体排出体外,从而使牛场中含有抗生素或携带耐药基因的牛粪污和废水通过还田利用、灌溉和堆粪,导致环境中其他细菌的耐药性提高并加速耐药基因的扩散[4]。因此,E.coli作为牛乳房内常见细菌和在食品卫生检测中重要指标菌,分析牛乳源E.coli的对抗生素耐药和耐药基因携带情况,有重要意义。本实验从不同牧场的牛乳中,分离出牛乳源E.coli,测定其对11种抗生素的耐药情况,检测20种耐药基因,探究E.coli抗生素耐药表型和基因型之间的关系,为牧场抗生素的选择、正确使用和牛乳中E.coli污染防控提供依据。
1 材料与方法
1.1 样品来源
从不同牛奶养殖场分别采集样品两次,第1次从绵阳某养殖场随机采集奶牛生牛奶样品55个,第2次从成都青白江区某养殖场随机采集正常奶牛生牛奶样品19个,总共74个样品。样品用100 mL无菌离心管采集后装入冰盒中带回,并于24 h内处理完毕。
1.2 实验药品
1.2.1 培养基与试剂 蛋白胨水(BPW)、伊红美蓝培养基(EMB)、胰蛋白胨大豆琼脂培养基(TSA)、胰蛋白胨大豆肉汤培养基(TSB)、琼脂糖凝胶购于北京陆桥技术有限责任公司;水解酪蛋白琼脂培养基(MHA)购于英国OXOID公司;0.5麦氏单位比浊管、Taq DNA聚合酶、PCR相关试剂及DNA Marker购于成都擎科生物科技有限公司。
1.2.2 药敏纸片 β内酰胺类:奥格门汀(AMC,20 μg/片)、氨苄西林(ampicillin,AMP,10 μg/片);头孢类:头孢曲松 (ceftriaxone,CRO,30 μg/片)、头孢西丁(FOX,30 μg/片)、头孢呋辛(CXM,30 μg/片)、 头孢唑啉(CZO,30 μg/片);氨基糖苷类:丁胺卡那(AMK,30 μg/片)、庆大霉素(gentamicin,GEN,10 μg/片);四环素类:四环素(tetracycline,TET, 30 μg/片);磺胺类:磺胺异噁唑(SIZ,300 μg/片);氟喹诺酮类:环丙沙星(ciproflfl oxacin,CIP, 5 μg/片); 11种药敏纸片均购于杭州微生物试剂有限公司。
1.2.3 引物合成E.coli16S rDNA引物、抗生素耐药性基因的20对引物均由擎科生物技术公司合成。具体各耐药基因引物为β-内酰胺酶类:blaTEM、blaSHV、blaCTX-M,氨基糖苷类:aac(6′)-Ib、aph(3′)-IIa、aac(3)-IIa、ant(3″)-Ia,四环素类:tet(A)、tet(B)、tet(C)、tet(D)、tet(E)、tet(M),磺胺类sul1、sul2、sul3,喹诺酮类:qnrA、qnrB、qnrS、qepA[5]。
1.3 E.coli的分离鉴定
分别取25 mL牛奶样品置于225 mL BPW中,剧烈摇晃,然后取50 mL加入无菌三角烧瓶中,加入50 mL双倍麦康凯液体培养基,37 ℃培养18 h后,划线至EMB琼脂平板上,35 ℃培养24 h,挑取菌落形态为有紫色或黑色中心且具有的金属光泽的菌落划线至TSA上,最后挑取3~5个单菌落至TSB中,培养18 h后保存于含20%的甘油内,于-80 ℃冰箱保存。分别挑取上述菌落,扩增16S rDNA(引物为27F和1 492R), 扩增产物由成都擎科生物技术公司测序后于Gene Bank 中Blast进行序列比对,与其他E.coli同源率为99%的,则确定为大肠杆菌。
1.4 抗生素耐药表型检测
采用纸片扩散(K-B)法测定E.coli对11种抗生素的耐药性。培养结束后,观察是否形成均匀的圆形抑菌环,直接量取各种抗生素纸片周围抑菌环直径,测量结果精确到毫米,并记录数据。参照上述标准判断E.coli对各抗生素的敏感、中介和耐药情况。质控菌株为E.coliATCC®25922,E.coliATCC®25928。
1.5 抗生素耐药基因检测
1.5.1 模板制备 蘸取表型耐药菌株-80 ℃保存的E.coli及质控菌株纯培养物菌液,划线接种于TSA培养基上,37 ℃培养16~24 h。煮沸法制备模板,用无菌棉签刮取过夜培养的菌苔,加入 700 μL煮沸10 min,在离心机中以12 000 r/min,离心半径6.8 cm,离心2 min,取上清液作为PCR模板。
1.5.2 PCR反应体系与循环条件 PCR扩增体系:金牌Mix12.5 μL,10 μmo1/L的上下游引物各1 μL,上述制备的E.coliDNA模板2.5 μL,无菌去离子水8 μL,最终总体积为25 μL。PCR扩增循环条件:95 ℃预变性2 min,98 ℃变性10 s,退火温度根据引物设定,并持续10 s,以72 ℃延伸10 s,进行25个循环,最后72 ℃延伸5 min。扩增完成后进行琼脂糖凝胶电泳检测结果。
2 结果
2.1 E.coli的分离情况
本研究中74份牛奶样品中共分离出E.coli43株,分离率为58.11%。
2.2 E.coli对抗生素的耐药率
43株E.coli对抗生素耐药率分别为AMC(97.67%)、AMP(51.16%)、TET(25.58%)、CRO(2.33%)、FOX(18.60%)、CXM(2.33%)、CZO(16.28%)、AMK(0.00%)、GEN(11.63%)、SIZ(23.26%)、CIP(6.98%)。E.coli耐药范围广泛,但对于不同的抗生素耐药率差异较大,E.coli对AMC耐药率最高(97.67%),对CZO中介率最高(32.56%),中介率为0的有6个,对四种抗生素敏感率超过90.00%,分别是AMK(100.00%)、CRO(97.67%)、CXM(97.67%)和CIP(93.02%)(表 1)。

表 1 E. coli对11种抗生素的耐药率(%,n=43)
注:S:敏感;I:中质;R:耐药
2.3 E.coli的抗生素的耐药谱
43株E.coli对11种抗生素均产生了耐药性,共有产生了18种耐药谱,谱型较分散,其中耐2种抗生素的菌株有15株(34.88%),多重耐药菌株有15株(34.88%),以耐β内酰胺类、四环素类、氨基糖苷类、磺胺类最多,达6.98%,有1株E.coli的耐药种类达到9种(表 2)。
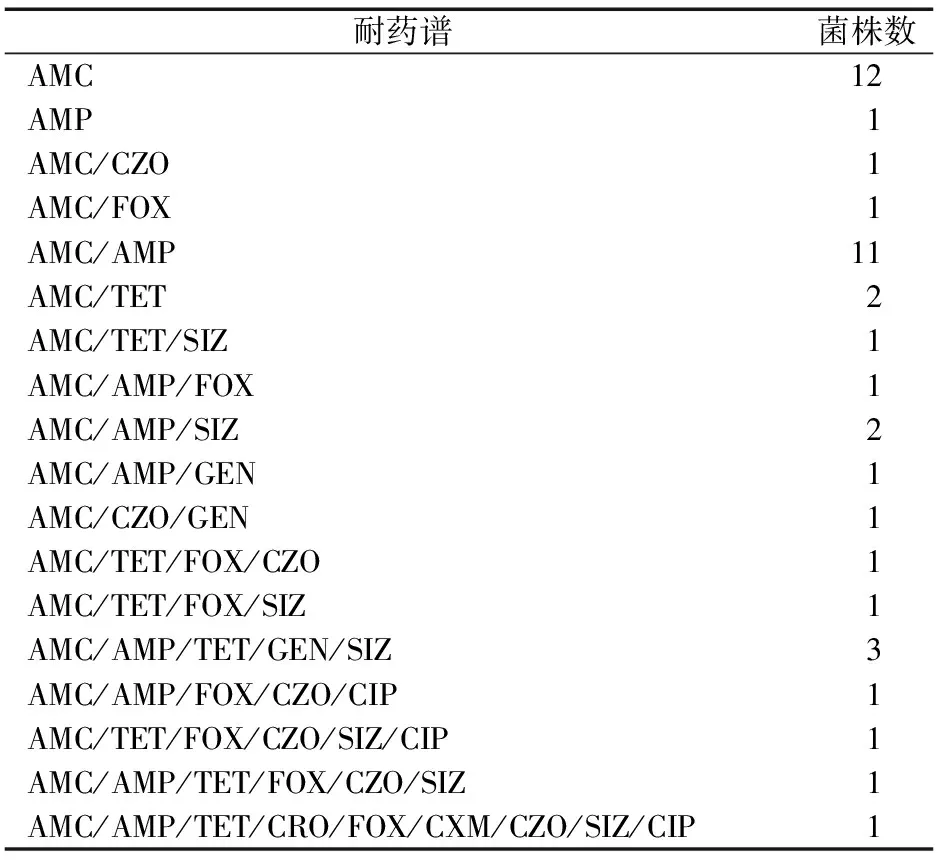
表2 E. coli的抗生素的耐药谱
2.4 E.coli对抗生素的耐药基因检测结果
43株耐β-内酰胺类抗生素E.coli菌株分别进行blaTEM、blaSHV、blaCTX-M基因的PCR检测,所有基因均有检出,检出率分别为blaTEM(25.58%)、blaSHV(18.60%)、blaCTX-M(9.30%)。
5株耐氨基糖苷类抗生素E.coli菌株分别进行aph(3′)-IIa、aac(3)-IIa、ant(3″)-Ia基因的PCR检测,检出率分别为aph(3′)-IIa(40.00%)、aac(3)-IIa(60.00%)、ant(3″)-Ia(100.00%)。
11株耐四环素类抗生素E.coli菌株分别进行tet(A)、tet(B)、tet(C)、tet(D)、tet(E)、tet(M)基因的PCR检测,仅检测出tet(A)、tet(E)、tet(M)3种基因被检测出,其检出率分别为:54.55%、18.18%、90.91%。
10株耐磺胺类抗生素的E.coli菌株分别进行sul1、sul2、sul3基因的PCR检测,除sul1基因尚未检出,sul2和sul3的检出率分别为30.00%和50.00%。
3株耐喹诺酮类抗生素的E.coli菌株分别进行qnrA、qnrB、qnrS、qepA、aac(6′)-Ib基因的PCR检测,所有基因均有检出,其检出率分别为:qnrA(66.67%)、qnrB(66.67%)、qnrS(66.67%)、qepA(66.67%)、aac(6′)-Ib(100.00%)(图1)。
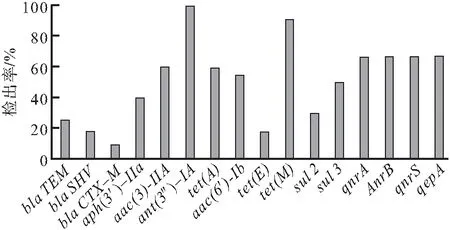
图1 大肠杆菌抗生素耐药基因检检出情况
2.5 耐药表型与基因型的关系
在43株E.coli中共检测出16种不同的抗生素耐药基因组合,3种或3种以上的组合占比皆为4.17%,共占25.02%,其中基因组合最复杂的菌株涉及到13种抗生素耐药基因,仅氨基糖苷类基因未检出,在耐4种及4种以上抗生素的菌株检测中,均检出3种及3种以上的耐药基因,耐药基因检出种类与耐药表型成正比(表 3)。
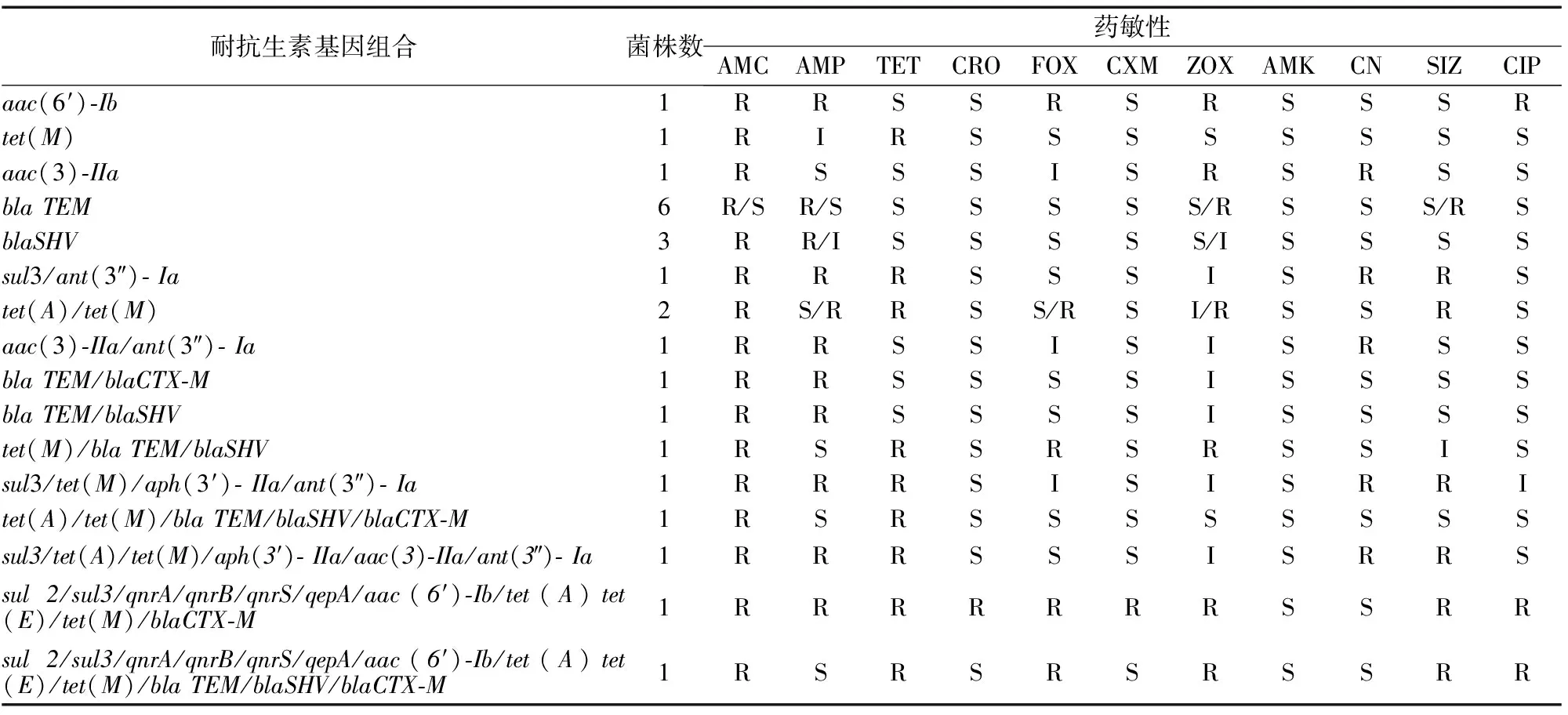
表3 大肠杆菌中抗生素抗性基因分布
注:S:敏感;I:中质;R:耐药
3 讨论
3.1 牛乳中E. coli对抗生素的耐药性
E.coli可通过自身的快速分裂、突变、防御系统,能够迅速获得耐药性,加之可通过质粒转移耐药基因,使细菌对抗生素的耐药性进一步提高,已引起广泛的关注。戴秀美等[6]对我国部分地区猪源E.coli的耐药性研究发现,各地猪源E.coli对抗生素的耐药均较高,几乎没有不耐药的地区。在本实验研究中,43株E.coli对各类广谱抗菌药的耐药性各不相同,除了β内酰胺类耐药率高于50.00%,其余抗生素的耐药率基本低于25.00%,在18种耐药谱中,多数为低耐,与田瑞等[7]、毛福超等[8]对猪源、禽源E.coli的高耐药率、高耐药谱检出明显不同,根据朱小玲等[9]年不同动物源E.coli对15种抗生素的抗药性研究,奶牛场的E.coli平均耐药性最低,只有18.7%,与本实验结果基本一致。β内酰胺类药物多用于各大牧场,通过乳房注射的方法来预防和治疗奶牛的乳腺炎,致使牛乳中易有该类抗生素的残留,并形成耐药菌,本实验中E.coli对AMC的耐药率高达97.67%,说明两大牧场对AMC的严重依赖,可以合理采用其他种类的抗生素来提高牛群的机体能力,如喹诺酮类抗生素:环丙沙星、恩诺沙星,本实验中E.coli对该类抗生素的耐药率仅为7.00%。牧场对牛群的抗生素使用,直接影响牛乳中E.coli的耐药性,加工过程中杀菌不彻底或运输、贮存等不规范,最终将增强人类肠道菌群的耐药性,降低各类抗生素的临床治疗效果,影响人类健康。
3.2 牛乳中E. coli抗生素耐药基因的检测分析
E.coli作为常见的肠内细菌,其耐药谱广泛,对多种抗生素都呈耐药性,涉及到耐药基因有磺胺类、喹诺酮类、四环素类、氨基糖苷类、β-内酰胺酶类等基因,E.coli对不同种类抗生素有着不同的耐药机制。
磺胺类抗生素主要通过干预细菌叶酸的合成代谢,从而抑制细菌的生长繁殖,而细菌可能通过质粒介导产生有抗性的二氢叶酸合成酶来利用叶酸,根据王娜等[10]的研究,sul基因可介导细菌对磺胺类抗生素的耐药。在寇宏等[11]研究中,均检测出3种sul基因,并呈现以sul3基因为主,sul1、sul2基因为辅的耐药基因搭配。本实验虽尚未检出sul1基因,但结果基本一致。喹诺酮类抗生素主要通过被动扩散、磷脂渗透,进入细菌体内,与拓扑异构酶或DNA 促旋酶结合从而产生抑菌作用[12],而细菌对其主要的耐药性来源为染色体上的基因突变,研究者[13]发现基因Qnr,促使E.coli对CIP的耐药性提高。本实验喹诺酮类基因检出率为(66.67%~100.00%),说明类耐药菌的耐药基因丰富,喹诺酮类抗生素的治疗效果将会明显下降,此类基因由质粒介导而广泛分布,但交叉耐药性较少。四环素类抗生素在细菌体内阻碍氨酰tRNA与核糖体的结合来抑制蛋白质的合成,从而达到抑菌目的,而细菌的耐药性主要依靠主动外排机制或核糖体保护机制[14]。在本实验中tet(M)的检出率高达90.91%,而外排泵基因只有两个被检出,说明该类耐药菌主要依靠核糖体保护机制来产生耐药性,这与许多研究所发现tet(A)基因的高检出率略有不同。氨基糖苷类抗生素主要通过作用细菌体内的核糖体,抑制蛋白质的合成,导致细菌裂解死亡[15],而细菌可利用具有钝化作用的修饰酶,如:氨基糖苷类乙酰转移酶(AAC)、核苷转移酶(ANT)、磷酸转移酶(APH)等使抗生素失去抗菌活性。本实验耐药菌株的氨基糖苷类基因检出率为(40.00%~100.00%),与黄琴[16]对广州26株猪源E.coli耐药菌的研究结果一致。β-内酰胺酶类抗生素通过抑制青霉素结合蛋白,干扰细菌细胞壁肽聚糖的合成,而肠内细菌内广泛分布的SHV、TEM、CTX-M型[17]β-内酰胺酶,能直接分解青霉素、单环β-内酰胺类等抗生素。本实验β-内酰胺类基因检出率为(9.30%~25.58%),与薛原等[18]发现基本一致,3种基因的检出率皆较低,但根据表型所呈现的耐药性,说明介导该类耐药菌耐药的基因以不局限于这传统的ESBLs基因。根据有关研究[19]表明碳青霉烯酶和质粒介导的AmpC,如:blaNDM-1、blaCIT等基因都可介导该类耐药菌的耐药。
本实验各基因型均有不同程度的检出,基因组合的种类相对较多(共有16种)且差异很大,两种或两种以下的组合较多,表明部分耐药基因分布广泛,但还未呈现较高的联合耐药,合理交替使用不同种类的抗生素,能达到良好的抑菌效果,通过耐药表型与基因型对比可发现,介导E.coli产生耐药性的耐药基因或方式还有很多,E.coli通过自然筛选,防御抗生素的基因种类或方法将会越来越多,未来抗生素的耐药研究将更加严峻。
3.3 E. coli耐药性的防控措施
控制牛乳中E.coli的耐药性恶化,最终仍要落实到牧场对牛群的抗生素使用,在遵守法律法规的前提下,及时掌握牛群的耐药谱,根据牛群感染的不同微生物,对症下药,而非盲目用药,积极采取轮换用药,能够充分提高抗生素的使用效率。目前,我国大力推进中西医结合,已经有研究[20]表明部分中草药,不仅能杀灭和抑制细菌,而且与抗生素联合使用,能产生协同抗菌和增效的作用。积极研发抗生素替代品,如:噬菌体试剂、益生素等能有效的改善各抗生素耐药率增高的现状。
