米诺环素通过自噬抑制结肠癌细胞增殖的作用研究
2019-11-04李灵玲兰景彬何贤禄
李灵玲,兰景彬,何贤禄
1.成都市妇女儿童中心医院(成都 610091);2.成都医学院(成都 610500);3.成都医学院第二附属医院(成都 610051)
结肠癌(colorectal cancer,CRC)是全世界高发的恶性肿瘤之一,其致死率居各类肿瘤第2位。CRC发病率高,预后差,严重威胁着人们的健康生活[1]。目前,CRC常用的治疗手段包括手术、放疗及化疗,但这些手段不良反应大、复发率高,严重影响患者的治疗。因此,寻找新的抗CRC药物具有重要意义[2]。米诺环素是一种四环素类抗生素,主要用于治疗痔疮类疾病[3]。近期研究[4-6]显示,米诺环素能有效抑制卵巢癌、骨癌、胶质瘤,但关于米诺环素对CRC抑制作用的报道较少。本实验以人CRC细胞LoVo细胞为研究对象,检测米诺环素对LoVo细胞增殖和自噬水平的影响,并探讨自噬在米诺环素抑制CRC细胞增殖中的作用。
1 材料与方法
1.1 材料
人CRC细胞LoVo购自中科院上海生命科学研究院细胞资源中心,于-80 ℃冻存;米诺环素(质量分数>98%)和自噬抑制剂氯喹(CQ)均购自上海阿拉丁生物科技有限公司;四唑盐(MTT)和二甲基亚砜(DMSO)购自美国Sigma公司;细胞培养基Dulbecco′s Modified Eagle Medium(DMEM)购自以色列BI公司;胎牛血清购自德国PAN公司;双抗(青霉素、链霉素溶液)购自美国Hyclone公司;Atg5 siRNA购自上海吉玛制药技术有限公司;蛋白质预染Marker购自美国Thermo Fisher公司;RIPA细胞裂解液和BCA蛋白定量试剂盒购自上海碧云天生物公司;β-actin、Beclin1、p62、LC3、Akt、p-Akt、mTOR、p-mTOR、Cleaved-Caspase3、Cyt-C、Bax单克隆抗体均购自美国Santa Cruz公司;兔二抗、鼠二抗均购自成都正能生物技术有限责任公司;ECL显影液、PVDF 膜购自美国Millipore公司;其他化学试剂均为国产分析纯。
1.2 方法
1.2.1 细胞培养 LoVo细胞用DMEM培养基(含10% 胎牛血清、100 U/L青霉素、100 mg/L链霉素)于37 ℃,5% CO2培养。
1.2.2 MTT法测细胞活力 取对数生长期的LoVo细胞,以5×103个/孔的密度接种于96孔板,于37 ℃培养箱中孵育过夜。待细胞密度长至40%时,加入不同质量浓度梯度(0.390 62、0.781 25、1.562 5、3.125、6.25、12.5、25、50、100、200、400 μmol/L)米诺环素,放入37 ℃培养箱中继续培养48 h,每组设置4个复孔,另设不含细胞仅有培养基的空白对照孔。44 h后,将加药培养好的96孔板取出,在避光条件下向每孔加入20 μL MTT(5 mg/mL),于37 ℃、5% CO2培养箱中孵育4 h,以空白对照孔调零,用酶联免疫检测仪检测490 nm处的吸光度。
1.2.3 克隆形成实验 取指数生长期的LoVo细胞,以100个/孔细胞接种于无菌六孔板中,摇匀,放入37 ℃培养箱中培养24 h。用米诺环素(0、3、6 μmol/L)处理LoVo细胞,放入37 ℃培养箱中培养2周后,弃六孔板中液体,PBS洗涤3次,每次5 min。 用4%多聚甲醛固定细胞15 min,PBS洗3次, 每次5 min。加入结晶紫,室温,染色15 min,PBS洗涤3次,每次5 min。观察、拍照。
1.2.4 TUNEL法检测细胞凋亡 用米诺环素(0、3、6 μmol/L)处理LoVo细胞,培养箱37 ℃培养24 h。每组收集约1×106个细胞,用PBS液洗1次,重悬,加入经赖氨酸处理过的载玻片上,自然干燥。用4%多聚甲醛固定30 min后,PBS洗涤3次,每次5 min。然后加入含0.1% TritonX-100的PBS,冰浴孵育2 min,PBS洗涤3次,每次5 min,在样品上加50 μL TUNEL检测液,37 ℃避光孵育60 min,PBS洗涤3次,每次5 min,用抗荧光淬灭封片液封片后荧光显微镜下观察,计数凋亡细胞。
1.2.5 免疫荧光检测自噬体的形成 参照文献[7]方法,通过LC3抗体免疫荧光强弱检测细胞自噬体的形成。在6孔板中放入处理过的盖玻片,后将细胞铺在盖玻片上,于5% CO2、37 ℃培养箱中培养过夜。待细胞贴壁后,用米诺环素(0、3、6 μmol/L)处理LoVo细胞,在37 ℃,5% CO2培养箱中培养24 h。4%多聚甲醛固定15 min, PBS溶液洗涤3次, 每次5 min。0.5% Triton X-100室温通透20 min,PBS溶液洗涤3次,每次5 min。5%脱脂奶粉封闭1 h,PBS溶液洗涤3次,每次5 min。LC3一抗室温孵育1 h,PBS溶液洗涤3次,每次5 min。 FITC-荧光二抗室温孵育1 h,PBS溶液洗涤3次,每次5 min,滴加抗荧光淬灭封片液,荧光显微镜观察,采集图像。
1.2.6 MTT法测siRNA沉默自噬关键基因Atg5后药物对细胞的影响 取对数生长期结肠癌细胞LoVo以1×105/孔接种于6孔板中,培养24 h,加入含血清和双抗的正常培养基2 mL,以每100 μL培养基中含有150 ng Atg5 siRNA或Scramble siRNA并加入转染试剂12 μL/孔,轻摇使溶液混合均匀,室温中放置10 min。每孔100 μL轻轻加入6孔板中,混合均匀,37 ℃培养48 h。将转染后的细胞转移到96孔板中。向LoVo细胞加入最终体积分数为0、3、6 μmoL/L米诺环素,37 ℃培养48 h。将加药培养好的96孔板取出,在暗光条件下向每孔加入20 μL MTT(5 mg/mL)处理4 h后490 nm处的OD值。
1.2.7 蛋白质印迹法 收集经药物处理后的细胞,按照说明书,每1× 106个细胞加入100 μL RIPA 裂解液,振荡混匀,超声破碎细胞。12 000 r/min,4 ℃,离心15 min(离心半径6 cm),取上清用BCA蛋白定量试剂盒进行定量分析,以确保蛋白上样量一致。加入上样缓冲液,于90 ℃加热变性10 min, 通过 12% SDS-PAGE电泳分离后,转膜至PVDF膜上,5%脱脂奶粉室温封闭1 h,TBST洗涤3次,每次5 min,加入稀释的相应一抗,4 ℃孵育过夜,TBST洗涤3次,每次5 min,辣根过氧化物酶标记二抗室温孵育1 h,TBST洗涤3次,每次5 min,加入ECL显影液后暗室中通过X线片曝光。
1.3 统计学方法
2 结果
2.1 米诺环素抑制CRC细胞的增殖
采用MTT实验和克隆形成实验检测经不同浓度的米诺环素处理CRC细胞LoVo 48 h后细胞活力的变化。MTT实验结果显示:米诺环素可促进LoVo细胞的胞内毒性,细胞活力下降,且呈浓度依赖性。克隆形成实验结果显示:米诺环素处理LoVo细胞后,细胞克隆数明显减少,并且克隆数和米诺环素的浓度呈负相关。实验结果表明:米诺环素能显著抑制CRC细胞LoVo的细胞增殖,且抑制程度呈药物浓度依赖性(图1)。

图1 米诺环素对CRC细胞增殖的影响
注:A:MTT实验检测米诺环素处理下LoVo的细胞活力;B:米诺环素处理下LoVo细胞的克隆形成情况及细胞克隆数统计;与空白对照组比较,ns:差异无统计学意义;*P<0.05;**P<0.01;***P<0.001
2.2 米诺环素对CRC细胞凋亡的影响
采用TUNEL染色法和蛋白质印迹法检测经0、3、6 μmol/L米诺环素处理LoVo细胞24 h后,细胞凋亡情况。TUNEL染色实验结果显示:米诺环素处理CRC细胞LoVo后,凋亡指数无明显变化。蛋白质印迹实验结果显示:米诺环素处理CRC细胞LoVo后,Bax、Cyt-C、Cleaved-Caspase3等凋亡相关标志蛋白表达无明显变化。实验结果表明:米诺环素对CRC LoVo细胞增殖的抑制作用不是由细胞凋亡所致(图2)。
2.3 米诺环素促进CRC细胞自噬
采用免疫荧光、蛋白质印迹法检测米诺环素对CRC细胞LoVo自噬的影响。免疫荧光实验结果显示:采用米诺环素(0、3、6 μmol/L)处理LoVo细胞24 h后,胞内LC3荧光斑点数明显增加,表明米诺环素促进自噬体的形成。经米诺环素处理后,自噬相关基因Beclin-1、LC3-Ⅱ的表达增加,自噬抑制基因 p62 的表达降低。为进一步验证米诺环素对CRC细胞自噬的影响,采用米诺环素单独处理和米诺环素与自噬抑制剂氯喹(CQ)共处理CRC细胞LoVo后检测LC3-Ⅱ表达情况。结果显示:与CQ处理组相比,CQ和米诺环素共处理组LC3-Ⅱ含量明显增加,表明米诺环素能诱导完整的自噬流。以上实验结果表明:米诺环素促进CRC细胞自噬(图3)。
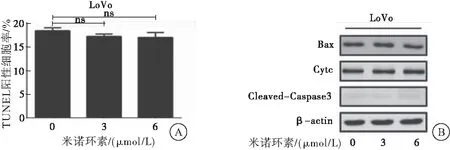
图2 米诺环素对CRC细胞凋亡的影响
注:A:TUNEL实验检测米诺环素处理下LoVo细胞的凋亡率;B:蛋白质印迹法检测米诺环素处理下凋亡相关标志蛋白的变化;与空白对照组比较,ns:差异无统计学意义,P>0.05
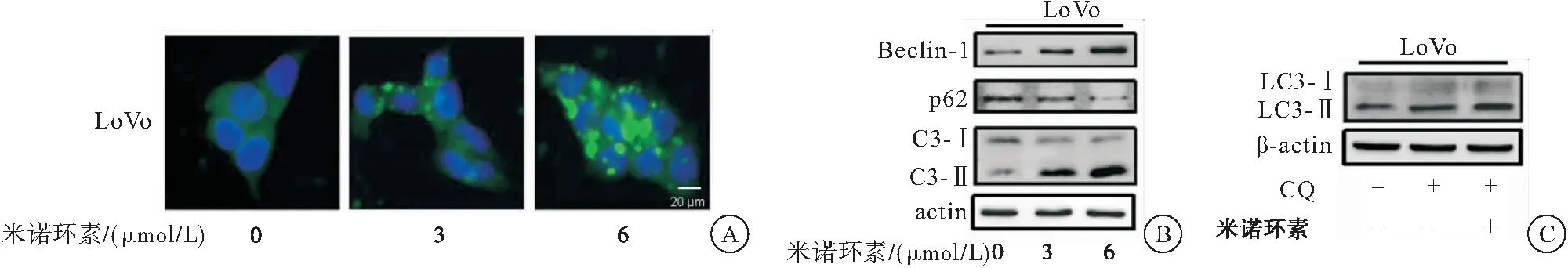
图3 米诺环素诱导CRC细胞产生自噬
注:A:免疫荧光检检测米诺环素处理下LoVo细胞中的LC3荧光斑点;B:蛋白质印迹法检测米诺环素处理下自噬相关标志蛋白的变化;C:米诺环素单独处理和米诺环素与自噬抑制剂CQ共处理细胞LoVo后检测LC3-Ⅱ表达情况
2.4 米诺环素促进自噬进而抑制CRC细胞增殖
采用siRNA沉默自噬相关基因Atg5后检测米诺环素对CRC LoVo细胞活力的影响(图4)。结果显示:与对照组相比,米诺环素作用后,沉默组细胞活力有明显回复。上述实验结果表明米诺环素通过促进CRC细胞LoVo自噬,进而抑制CRC细胞增殖。
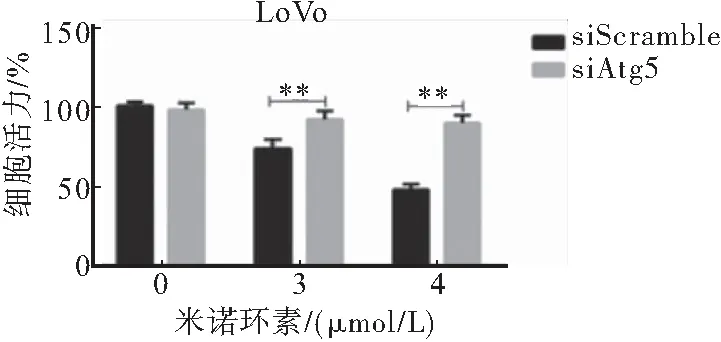
图4 MTT法检测siRNA沉默Atg5后米诺环素对CRC细胞增殖的影响
注:与siScramble组比较,**P<0.01
2.5 米诺环素抑制Akt/mTOR信号通路
采用免疫印迹检测米诺环素对CRC LoVo细胞Akt、mTOR蛋白磷酸化水平的影响(图5)。结果显示:米诺环素处理LoVo细胞24 h后,p-Akt、p-mTOR的蛋白表达量均明显下调,而Akt、mTOR的蛋白表达量未发现明显差异。上述实验结果表明:米诺环素通过抑制Akt/mTOR信号通路促进CRC细胞自噬,进而抑制CRC细胞增殖。

图5 米诺环素对Akt、mTOR蛋白磷酸化水平的影响
3 讨论
CRC是世界上最常见的消化道恶性肿瘤之一,由于其高发病率和死亡率而倍受人们关注[1]。CRC的早期诊断是目前人类需要攻克的一大难题,由于其早期发现率较低,许多患者诊断时已是进展期CRC。进展期CRC转移率和手术复发性高,因此寻找妥善的CRC治疗手段至关重要。米诺环素是二代半合成四环素类衍生物抗生素,最初主要被当作抗菌药使用。近年研究[8-9]报道,米诺环素除抗菌作用外,还具抗炎抑制肿瘤增殖等作用。本研究证实米诺环素能够有效抑制CRC细胞的增殖,并呈浓度依赖性。
诱导细胞凋亡是许多化疗药物抑制肿瘤细胞增殖的主要机制。为研究米诺环素抑制结肠癌细胞增殖的机制,本研究选取3、6 μmol/L米诺环素处理人CRC LoVo细胞后,釆用TUNEL染色及蛋白免疫印迹检测,染色结果发现米诺环素组的细胞凋亡率与正常组比较,差异无统计学意义;而且蛋白免疫印迹检测发现米诺环素处理结肠癌细胞后凋亡相关标志蛋白(Bax、Cyt-c、Cleaved-Caspase3等)的表达比较,差异无统计学意义。该实验结果提示米诺环素抑制CRC细胞增殖存在其他主要机制。
自噬是除凋亡外的另一种细胞程序性死亡方式,是一种将胞质内容物递送给溶酶体进行降解的过程,也是维持真核细胞生存的重要调节过程。近年研究[10-11]表明,自噬是一把双刃剑,一方面能促进肿瘤细胞的发生发展,另一方面又能介导肿瘤细胞发生自噬性死亡。如何运用好自噬这把双刃剑是治疗肿瘤的新方向。自噬的出现标志是自噬体的形成。本研究采用LC3抗体进行细胞免疫荧光检测发现,米诺环素处理CRC细胞后,胞质中LC3荧光斑点数明显增加,提示米诺环素诱导CRC细胞自噬体形成增加。进一步采用蛋白免疫印迹检测发现,米诺环素组较正常组自噬相关基因Beclin-1、LC3-Ⅱ的表达增加,自噬抑制基因p62的表达降低。同时运用自噬抑制剂CQ发现,联合运用CQ和米诺环素较单用CQ能明显增加LC3-Ⅱ表达,提示米诺环素能促进CRC细胞自噬。为了进一步研究细胞自噬是否在米诺环素抑制人CRC细胞增殖中起作用,采用siRNA沉默自噬相关基因Atg5后检测发现,米诺环素处理后,沉默组较正常组细胞活力有明显回复,说明米诺环素通过促进细胞自噬,进而抑制CRC细胞增殖。自噬是一个十分复杂的生物学过程,涉及细胞内关键分子事件的变化,其中,AKT/mTOR细胞信号转导通路作为自噬最重要的上游调控因子而受到广泛关注[12]。本研究证实米诺环素能够抑制AKT、mTOR蛋白的磷酸化水平从而抑制AKT/mTOR信号通路。
综上所述,本研究结果解释了米诺环素通过抑制Akt/mTOR信号通路促进自噬进而抑制CRC细胞增殖,为CRC治疗奠定了理论基础。
