血清中前列腺特异性抗原、谷胱甘肽S-转移酶水平与前列腺癌的相关性分析*
2019-11-04王鹏桥郑人源
王鹏桥,郑人源,杨 雷
1.成都医学院第一附属医院 泌尿外科 (成都 610500);2.成都医学院 (成都 610500)
前列腺癌是指前列腺上皮细胞恶性增生,易发于广大中老年男性患者,临床致死率极高,对患者危害性较大。随着我国人口老龄化、饮食结构、生活方式、社会压力改变,以及现代诊断技术手段的提高,前列腺癌发病率呈逐年上升趋势[1-2]。为此,对前列腺癌患者采取尽早的诊断和确诊,以便及时开展相应的治疗干预,对缓解患者症状和延续患者生命有着重要意义[3]。目前,常规检查方法有直肠指诊、经直肠前列腺超声、CT、盆腔MRI检查等,但对于前列腺癌发病的早期症状并不明显,影像学检查并未显示明显病灶异常,因而造成误诊、漏诊情况的出现,导致患者错过最佳治疗时机[4]。近些年,随着分子肿瘤病理研究的不断进步,前列腺癌肿瘤生物标记蛋白研究也在逐渐深入。研究[5-6]显示,前列腺特异性抗原(prostate specific antigen, PSA)、谷胱甘肽S-转移酶(glutathione s-transferase, GSTs)在前列腺癌患者体内呈现异常表达现象。PSA、GSTs水平的改变对于前列腺癌的诊断提供了新思路,特别是对早期无症状前列腺癌患者的诊断具有重要意义[7]。为进一步探讨PSA、GSTs水平与前列腺癌发病的相关性,本研究中对前列腺癌患者的PSA、GSTs水平进行检测对比,并探讨与Gleason评分的相关性,现报道如下。
1 资料与方法
1.1 临床资料
选择2015年1月至2018年12月在成都医学院第一附属医院进行治疗的前列腺癌患者90例为研究对象纳入试验组,患者年龄45~78 (57.82±10.23)岁。纳入标准:1)患者经CT、MRI、穿刺活检确诊为前列腺癌(图1~2);2)患者均为首次确诊,尚未接受前列腺癌的系统放化疗治疗及手术治疗;3)患者对本研究内容知情同意,研究方案无伦理学争议。排除标准:1)患者并发其他泌尿系统疾病;2)尿潴留患者;3)研究过程中死亡或中途退出的患者。另选同期在我院进行健康体检的志愿者50例为对照组,年龄42~71 (55.18±10.09)岁,经检查各项生命指标良好,无前列腺疾病史。
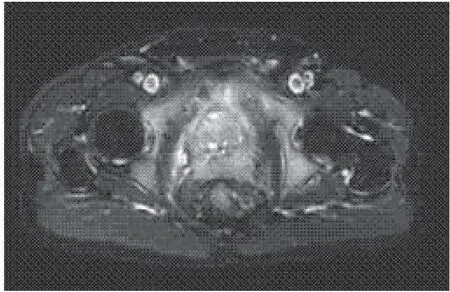
图1 试验组患者前列腺MRI图片

图2 试验组患者前列腺穿刺活检病理切片图
注:A:前列腺左前叶;B:前列腺左后叶;C:前列腺右前叶;D:前列腺右后叶
1.2 检查方法
两组入选对象抽取空腹静脉血约5 mL,加入到抗凝管中,以TGL-21M型多功能高速离心机(长沙湘智离心机仪器有限公司)离心,3 000 r/min,离心半径10 cm,离心10 min后,分离得到血清样本。采用化学免疫发光法检测血清中PSA、GSTs水平,检测仪器为Cobas 8000 e801型全自动化学发光免疫分析仪(上海罗氏诊断科学仪器有限公司),检测试剂盒均购置于赛默飞世尔科技公司,操作步骤严格按说明书要求进行。
1.3 评价方法
对比试验组和对照组的PSA、GSTs水平,并将试验组患者按Gleason评分大小分为:高分化组(Gleason评分2~4分)17例、中分化组(Gleason评分5~6分)41例、低分化组(Gleason评分7~10分)32例,对3组间患者的PSA、GSTs水平进行对比。将试验组患者依据前列腺癌的侵犯程度和扩散范围,分为4期: A期18例,即癌肿局限于前列腺组织中,临床上没有症状,只是前列腺标本的病理检查中发现癌肿;B期23例,癌肿只局限于前列腺组织内,直肠指检可以摸到,B超或CT检查也可发现,一般没有淋巴结转移,血中前列腺特异性抗原可升高;C期34例,即癌肿已经侵犯到前列腺包膜之外,局部淋巴结也有转移,但尚无远处转移;D期15例,即常有骨骼及其他器官的转移。对上述不同分期患者间的PSA、GSTs水平进行对比。最后采用Pearson检验对前列腺癌患者血清中PSA、GSTs水平与Gleason评分相关性进行分析。
1.4 统计学方法
2 结果
2.1 两组PSA、GSTs水平比较
试验组患者血清中PSA水平高于对照组,GSTs水平低于对照组,差异有统计学意义(P<0.05)(表1)。
表1 两组PSA、GSTs水平比较
2.2 试验组内不同Gleason评分患者PSA、GSTs水平比较
按Gleason评分对试验组分组后的高、中、低3组患者的PSA、GSTs水平比较,差异有统计学意义 (P<0.05)(表2)。
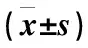
表2 试验组内不同分期患者PSA、GSTs水平比较
注:与低分化组比较,*P<0.05;与中分化组比较,#P<0.05
2.3 试验组内不同分期患者PSA、GSTs水平比较
A、B、C、D 4期患者间PSA、GSTs水平比较差异有统计学意义 (P<0.05),且随着患者临床分期的加重,患者血清中PSA水平均明显增加,而GSTs水平明显降低(表3)。
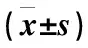
表3 试验组内不同分期患者PSA、GSTs水平比较
注:与D期组比较,*P<0.05;与C期组比较,#P<0.05;与B期组比较,△P<0.05
2.4 相关性分析
经Pearson相关性检验分析,血清中PSA水平与前列腺癌患者的Gleason评分呈正相关性,而GSTs水平与 Gleason评分呈负相关性(P<0.05)(表4)。
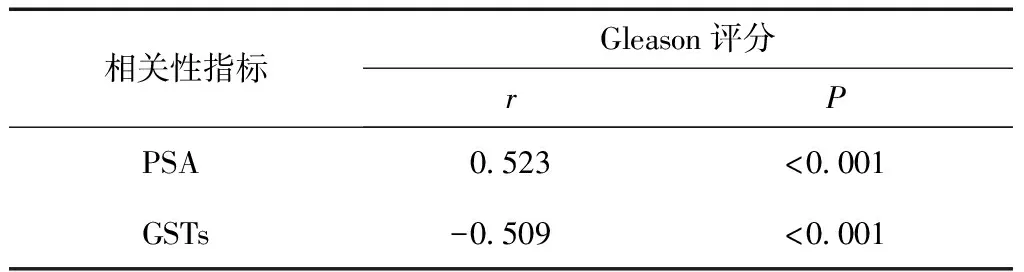
表4 相关性分析
3 讨论
前列腺癌是对男性患者危害性最大的一种恶性肿瘤疾病,且早期症状不明显,多伴随着尿路梗阻、尿失禁、尿潴留等非特异性症状出现。据相关统计[8-9]显示,患者确诊时均已晚期,延误了前列腺癌患者最佳治疗时机,因此早确诊、早治疗对于提高患者预后效果和维持患者的生命有重要意义。近期随着诊断技术的发展,临床对前列腺癌早期诊断及前列腺癌肿瘤标志物的研究重视程度不断提高。PSA是一种具有组织特异性的单链多肽,是男性前列腺上皮及尿道周围腺体组织中分泌产生的一种丝氨酸蛋白酶,具有分解胶原蛋白、稀释精液的作用[10-11]。在正常人群中,PSA只在男性前列腺腺泡和上皮细胞中表达,当出现前列腺炎症、良性增生和癌变时均会使患者血清中PSA水平出现异常升高[12-13]。PSA水平异常升高的原因主要是患者前列腺的结构和功能损伤,从而使前列腺组织中PSA合成、分泌及代谢过程紊乱,进而PSA弥散进入前列腺组织血液中,并随着前列腺癌患者肿瘤病灶的增生,对前列腺癌患者组织毛细血管、淋巴管壁的破坏,造成PSA释放进入血循环,引起患者体内PSA水平急剧升高[14-15]。GSTs是谷胱甘肽结合反应的关键酶,催化谷胱甘肽结合反应的起始步骤,主要存在于机体的胞液中,是机体解毒过程中的关键酶类[16]。近期临床报道[17-18]显示,在各型肿瘤疾病患者体内,GSTs水平表现为异常降低。这是因为GSTs为机体中具有解毒作用的蛋白酶,当患者前列腺组织出现癌变损伤,机体GSTs水平处于较低水平时,对机体的前列腺肿瘤细胞清除作用较弱,从而使前列腺癌的病情进展程度加剧。
在本研究中,相比于正常人群,前列腺癌患者血清中PSA水平高于对照组,GSTs水平低于对照组,表明PSA、GSTs水平的改变与前列腺癌发病有一定关联。在前列腺癌患者进一步病情进展分析中,随着患者Gleason评分的升高,患者血清中PSA水平明显增加,而GSTs水平明显降低。并且随着患者临床分期的加重,患者血清中PSA水平均明显增加,而GSTs水平明显降低。表明血清中PSA、GSTs水平的变化随着前列腺癌患者的病情进展而发生规律性变化。在相关性分析中,血清中PSA水平与前列腺癌患者的Gleason评分呈正相关性,而GSTs水平与 Gleason评分呈负相关性,进一步证实了PSA、GSTs与前列腺癌患者病情变化间的关系。
综上所述,血清中PSA、GSTs水平与前列腺癌Gleason评分有相关性,提示PSA、GSTs水平变化与前列腺癌患者病情的发生、进展有关。前列腺癌患者PSA、GSTs水平检测,对于疾病的诊断、病情及疗效评估有重要临床作用。
