牛筋果中酚性化合物及其对DPPH自由基的清除活性
2019-11-04唐小涵陈艳妮汤红玉李博婷汪云松郝小江邸迎彤
唐小涵,陈艳妮,汤红玉,李博婷,汪云松,曾 英,郝小江,邸迎彤*
1云南大学化学科学与工程学院,昆明 650091;2中国科学院昆明植物研究所 植物化学与西部植物资源持续利用国家重点实验室,昆明 650201
牛筋果Harrisoniaperforata(Blanco) Merr.是苦木科牛筋果属植物,该属植物全球共四种,产热带非洲、热带亚洲和大洋洲。我国只产一种,多产福建,广东和海南等地;常见于低海拔的灌木林和疏林中[1]。牛筋果根、茎、叶均可入药,具有清热、解毒、截疟等功效,在民间常用于治疗疟疾、疮痈、外感风热、咳嗽、咯痰及咽喉肿痛等[2,3]。目前,国内外学者在对牛筋果化学成分的研究中发现,其根、茎、叶富含色原酮、聚酮、香豆素类、柠檬苦素类以及苦木素类化合物[4,5],同时发现其粗提物表现出很好的抗疟活性和选择性[6]、昆虫拒食活性和杀蚊活性[7,8]以及一定的抗菌活性[9]。该属植物的化学成分研究主要集中在具有环系复杂多变、重排现象普遍特点的柠檬苦素成分[10,11]以及苦木科的特征性次生代谢产物苦木素上。本课题组在前期的研究中分离鉴定了具有优异杀虫活性的新颖结构C-25型苦木素perforalactone A[12]以及具有新颖骨架类型的柠檬苦素类化合物perforanoid A[13]。为了寻找植物牛筋果中的活性化学成分,作者对牛筋果小枝的乙酸乙酯部位进行了研究,从中分离鉴定了14个酚性化合物,其中化合物1、3、5~10、和12~13共10个化合物为首次从牛筋果中分离得到。本研究进一步丰富了牛筋果的化学成分多样性,为牛筋果资源的深入开发利用提供了一定的依据。
1 仪器、试剂与材料
1H和13C NMR谱由DRX-500和Avance Ⅲ-600型超导核磁共振仪(Bruker,德国)测定;ESI由岛津UPLC-IT-TOF液相-离子阱飞行时间色谱质谱联用仪(Shimadzu,日本)测定;HPLC分离用安捷伦1260液相色谱仪(Agilent,美国)开展,色谱柱为沃特世XSelect CSH C18(5 μm,10×250 nm);凝胶Sephadex LH-20(40~70 μm)购自瑞典Amersham Pharmacia Biotech AB公司;反向填充材料Lichroprep RP-18 gel(40~63 μm)购自德国默克公司;柱层析用硅胶(100~200目,200~300目,300~400目),薄层层析硅胶板(GF254)购自青岛海洋化工厂;甲醇,乙酸乙酯,丙酮,二氯甲烷,石油醚等有机溶剂均为工业纯经重蒸后使用;液相甲醇和液相乙腈购自新蓝景公司;显色剂为10%的硫酸-乙醇溶液。
TECAN Infinite M200 Pro多功能酶标仪(TECAN,瑞士);1,1-二苯基-2-三硝基苯肼(DPPH)购自上海阿拉丁生化科技股份有限公司;水溶性维生素E(Trolox)购自上海碧云天生物技术有限公司;二甲基亚砜(分析纯)购自西陇科学股份有限公司。
牛筋果Harrisoniaperforata(Blanco) Merr.的枝叶于2018年1月采自海南;植物样品由海南热带生物技术研究所黄圣卓副研究员采集并鉴定。标本(NO.20180104)存放于昆明植物研究所植物化学国家重点实验室。
2 实验方法
2.1 提取与分离
牛筋果植物样品采自牛筋果茎100 kg。粉碎后经甲醇回流提取三次,合并提取液减压回收溶剂。将浓缩后的提取物加水悬浮,分别用石油醚和乙酸乙酯萃取。乙酸乙酯萃取物(1000 g)MCI小孔树脂进行脱色,采用甲醇-水(30%~100%)梯度洗脱后经TLC检测合并分为5个部分(Fr1~5)。Fr3部分经正相硅胶柱层析(石油醚-乙酸乙酯梯度洗脱)分为5个流分(Fr.3.1~Fr.3.5)。Fr.3.2部分利用重结晶方法分离得到化合物1(76 mg)和2(25 mg)。Fr.3.3经RP-18反相色谱层析,水-甲醇(30%~100%)梯度洗脱,TLC检验合并相同流分得到6个流分(Fr.3.3.1~Fr.3.3.6)。Fr.3.3.1经半制备 HPLC(Waters X-Select CSH C-18,5 μm,10 × 250 nm,3 mL/min,acetonitrile:H2O=25%)得到化合物7(4.1 mg)。Fr.3.3.2部分经反复Sephadex LH-20柱(甲醇)凝胶层析及正相硅胶柱色谱层析后,经半制备 HPLC(Waters X-Select CSH C-18,5 μm,10×250 nm,3 mL/min,acetonitrile:H2O=28%)得到化合物8(11 mg)、9(2.2 mg)和10(2.1 mg)。Fr.3.3.4部分经Sephadex LH-20柱(二氯甲烷∶甲醇=1∶1)凝胶层析后得到化合物4(26.5 mg)。Fr.3.3.5部分经Sephadex LH-20柱(二氯甲烷∶甲醇=1∶1)凝胶层析和正相硅胶板色谱层析后得到化合物5(13.7 mg)和6(34.6 mg)。Fr4部分经正相硅胶柱层析,二氯甲烷:甲醇(120∶1~0∶1梯度洗脱)分为3个流分(Fr.4.1~Fr.4.3)。Fr.4.2经RP-18反相色谱层析,水-甲醇(30%~100%)梯度洗脱,TLC检验合并相同流分得到5个流分(Fr.4.2.1~Fr.4.2.5)。Fr.4.2.2部分经反复Sephadex LH-20柱(甲醇)凝胶层析及硅胶柱色谱层析后,经半制备 HPLC(Waters X-Select CSH C-18,5 μm,10 × 250 nm,3 mL/min,acetonitrile:H2O=30%)纯化得到化合物3(2 mg)、11(25.4 mg)、12(1.5 mg)。Fr.4.2.3部分经反复凝胶及硅胶柱色谱层析后得到化合物13(12.8 mg)和14(16.1 mg)。
2.2 DPPH自由基清除活性
本实验参考Brand-williams等[14,15]报道的方法并加以改进。精密配置2 mM浓度的DPPH(1,1-二苯基-2-三硝基苯肼)溶液作为储备液待用。将样品溶解于DMSO溶液,配置成10 mg/mL作为样品母液。实验过程中,将DPPH储备液稀释10倍至0.2 μM,得到DPPH工作液;将样品母液逐级稀释配制成浓度梯度的样品溶液,以Trolox作为阳性对照;配制反应体系:取样品溶液100 μL及DPPH溶液100 μL,室温下震摇混匀,在96孔板中室温避光反应30 min后,用酶标仪测量各孔在517 nm处的吸光值,平行测定三次。DPPH自由基清除率=[A0-(A1-A2)]/A0×100%,其中A0为以相同体积甲醇代替样品溶液的阴性对照组吸光值,A1为加样组的吸光值,A2为甲醇代替DPPH工作液的空白组吸光值。初筛浓度为500 μM,对初筛清除率大于50%的化合物进行复筛,使用GraphPad Prism7软件计算半数有效浓度(EC50)。
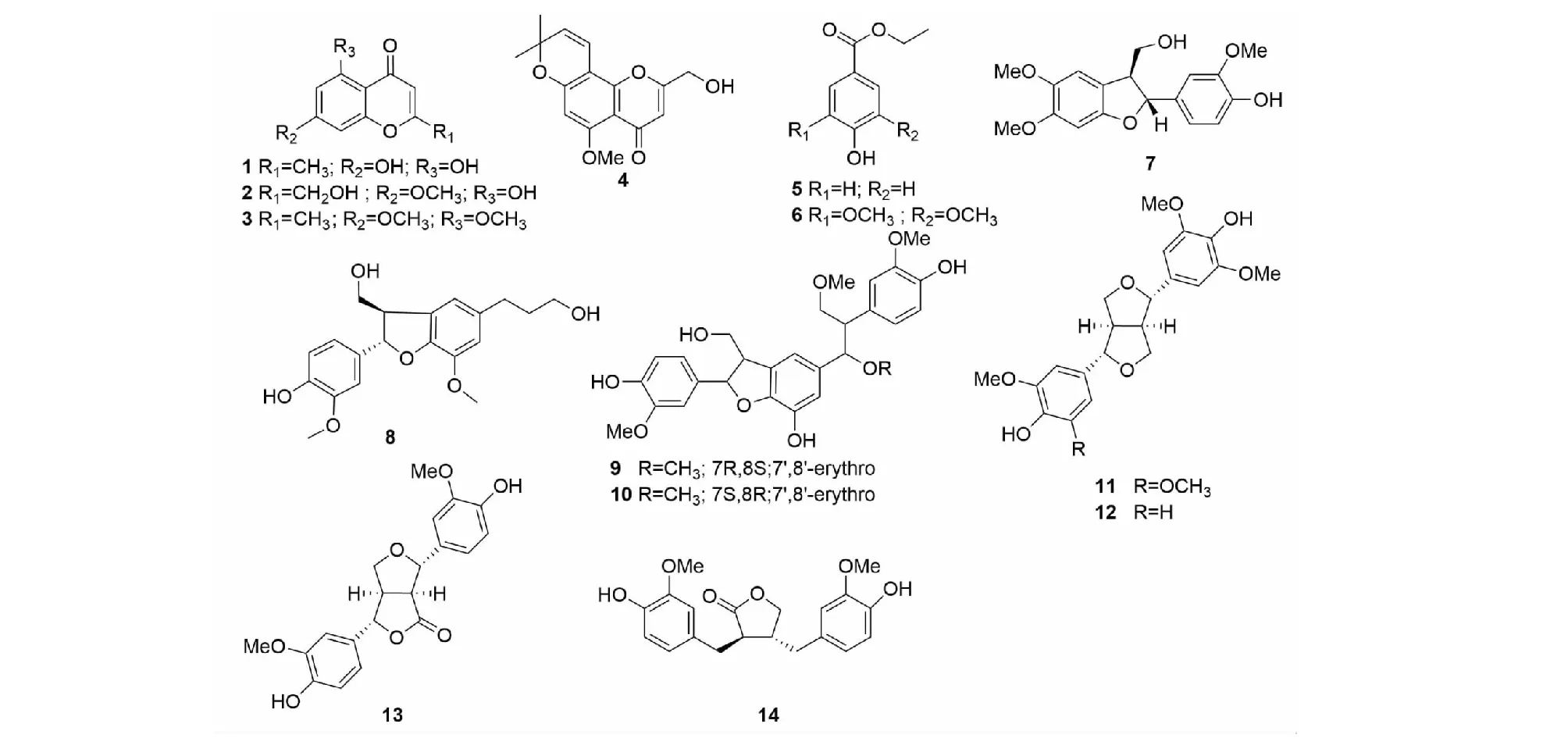
图1 化合物1~14的化学结构Fig.1 The chemical structures of compounds 1-14
3 结果与讨论
3.1 结构鉴定
化合物1白色粉末;ESI-MS:m/z191 [M-H]-,分子式C10H8O4;1H NMR (500 MHz,MeOD)δ:6.29 (1H,d,J=2.1,H-2),6.18 (1H,d,J=2.1,H-5),6.01 (1H,s,H-7),2.32 (3H,s,H-CH3);13C NMR (125 MHz,MeOD)δ: 183.9 (C-1),169.1 (C-6),166.0 (C-3),163.3 (C-8),159.9 (C-4),109.0 (C-2),105.1 (C-9),100.1 (C-8),95.0 (C-5),20.3 (CH3)。以上数据与文献[16]报道一致,故鉴定为去甲丁香色原酮(noreugenin)。
化合物2白色粉末;ESI-MS:m/z221([M-H]-),分子式C11H10O5;1H NMR (500 MHz,(CD3)2CO)δ:6.48 (1H,d,J=2.3 Hz,H-2),6.31 (2H,m,H-5,H-7),4.53 (2H,d,J=4.8 Hz,H-3-CH2OH),3.89 (3H,s,H-6-OCH3);13C NMR (125 MHz,(CD3)2CO)δ:184.3 (C-1),171.5 (C-3),166.6 (C-6),163.1 (C-8),158.8 (C-4),106.6 (C-2),98.6 (C-7),93.0 (C-5),61.1 (C-3-CH2OH),56.4 (C-6-OCH3)。以上数据与文献[17]报道一致,故鉴定为柴胡色原酮A(Saikochromone A)。
化合物3黄色油状;ESI-MS:m/z243 ([M+Na]+),分子式C12H12O4;1H NMR (600 MHz,CDCl3)δ:6.42 (1H,d,J=2.3 Hz,H-5),6.33 (1H,d,J=2.3 Hz,H-2),6.01 (1H,s,H-7),3.93 (s,3H,H-8-OCH3),3.87 (s,3H,H-6-OCH3),2.27 (s,3H,H-3-CH3);13C NMR (150 MHz,CDCl3)δ:177.5 (C-1),163.7 (C-2),163.0 (C-6),160.9 (C-4),160.2 (C-8),112.0 (C-2 and C-9),95.9 (C-7),92.6 (C-5),56.4 (C-8-OCH3),55.7 (C-6-OCH3),19.8 (C-3-CH3)。以上数据与文献[18]报道一致,故鉴定为5,7-dimethoxy-2-methylchromone。
化合物4白色粉末;ESI-MS:m/z311 ([M+Na]+),分子式C16H16O5;1H NMR (500 MHz,CDCl3)δ:1.43 (6H,s,gem-Me),3.87(3H,s,H-OMe),4.49 (2H,s,H-CH2OH),5.52 (1H,d,J=10 Hz H-3′),6.21 (1H.s.H-3),6.26 (1H.s.H-6),6.61 (1H.d,J=10 Hz,H-4′);13C NMR (125 MHz,CDCl3)δ:178.3 (C-4),165.6 (C-2),160.4 (C-8a),157.9 (C-8),153.9 (C-4a),127.3 (C-3′),115.0 (C-4′),109.6 (C-3),108.5 (C-8),102.4 (C-4a),96.5 (C-6),78.1 (C-2′),60.9 (C-CH2OH),56.3 (C-OCH3),28.2 (C-gem-Me)。以上数据与文献[19]报道一致,故鉴定为2-hydroxymethylalloptaeroxylin。
化合物5白色粉末;ESI-MS:m/z165 ([M-H]-),分子式C9H10O3;1H NMR (500 MHz,CDCl3)δ:7.93 (1H,d,J=8.3 Hz,H-2,6),6.86 (1H,d,J=8.3 Hz,H-3,5),4.33 (2H,q,J=7.1 Hz,H-1′),1.37 (3H,t,J=7.1 Hz,H-2′);13C NMR (125 MHz,CDCl3)δ:166.8 (C-7),160.5 (C-4),155.1 (C-5),131.8 (C-2),130.0 (C-6),122.4 (C-1),115.2 (C-3),60.8 (C-1′),14.3 (C-2′)。以上数据与文献[20]报道一致,故鉴定为羟苯乙酯(ethylparaben)。
化合物6黄色粉末;ESI-MS:m/z249 ([M+Na]+),分子式C11H14O5;1H NMR (500 MHz,CDCl3)δ:7.34 (2H,s,H-2,H-6),5.93 (1H,brs,H-OH),4.35 (2H,q,J=7.0 Hz,H-OCH2CH3),3.92 (6H,s,2×OCH3),1.38 (3H,t,J=7.1 Hz,OCH2CH3);13C NMR (125 MHz,CDCl3)δ:166.4 (C-7),146.6 (C-3,C-5),139.2 (C-4),121.4 (C-1),106.6 (C-2,C-6),70.0 (C-1′),56.4 (2×OCH3),14.4 (C-2′)。以上数据与文献[21]报道一致,故鉴定为苯丙酮(propiophenone)。
化合物7白色粉末;ESI-MS:m/z355 ([M+Na]+),分子式C18H20O6;1H NMR (500 MHz,CDCl3)δ:6.89 (1H,s,H-2),6.89 (1H,s,H-5),6.89 (1H,s,H-6),6.78 (1H,s,H-6′),6.53 (1H,s,H-3′),5.49 (1H,d,J=6.7 Hz,H-7),3.90 (2H,m,H-9),3.87 (3H,s,3-OCH3),3.86 (3H,s,2′-OCH3),3.84 (3H,s,1′-OCH3),3.54 (1H,dd,J=11.7,5.8 Hz,H-8),13C NMR (125 MHz,CDCl3)δ:154.3 (C-4′),150.3 (C-2′),146.7 (C-3),145.7 (C-4),133.5 (C-1),119.1 (C-2),116.1 (C-5′),114.4 (C-5),108.4 (C-6),108.4 (C-6′),95.1 (C-3′),87.5 (C-7),64.4 (C-9),57.0 (C-1′),57.0 (C-1′-OCH3),56.1 (C-3′-OCH3),56.0 (C-3-OCH3),53.7 (C-8)。以上数据与文献[22]报道一致,故鉴定为cephafortin B。
化合物8淡黄色粉末;ESI-MS:m/z383 ([M+Na]+),分子式C20H24O6;1H NMR (600 MHz,MeOD)δ:6.94 (1H,d,J=1.6 Hz,H-2),6.81 (1H,dd,J=8.2,1.7 Hz,H-6),6.75 (1H,d,J=8.1 Hz,H-5),6.72 (2H,s,H-4′,H-6′),5.48 (1H,d,J=6.3 Hz,H-7),,3.82 (3H,s,3-OCH3),3.86 (3H,s,3′-OCH3),3.80 (1H,m,H-9b),3.75 ( 1H,dd,J=11.0,7.2 Hz,H-9a),3.56 (1H,t,J=6.5 Hz,H-9′),3.46 (1H,dd,J=12.3,6.3 Hz,H-8),2.62 (2H,m,H-7′),1.81 (1H,m,H-8′);13C NMR (150 MHz,MeOD)δ:149.1 (C-3),147.5 (C-4),147.5 (C-2′),145.2 (C-3′),136.9 (C-5′),134.8 (C-1),129.9 (C-1′),119.7 (C-6),117.9 (C-6′),116.1 (C-5),114.0 (C-4′),110.5 (C-2),89.0 (C-7),65.0 (C-9),62.2 (C-9′),56.7 (C-3′-OCH3),56.3 (C-3-OCH3),55.4 (C-8),35.8 (C-8′),32.9 (C-7′)。以上数据与文献[23]报道一致,故鉴定为去氢双松柏醇(dehydroconiferyl alcohol)。
化合物9黄色油状;ESI-MS:m/z535 ([M+Na]+),分子式C28H32O9;1H NMR (600 MHz,CDCl3)δ:6.92 (1H,d,J=1.4 Hz,H-2),6.80 (1H,dd,J=8.2,1.5 Hz,H-6),6.75 (1H,d,J=8.1 Hz,H-5),6.66 (1H,d,J=8.0 Hz,H-5"),6.59 (1H,s,H-6′),6.58 (1H,d,J=1.3 Hz,H-2"),6.56 (1H,dd,J=8.1,1.5 Hz,H-6"),6.48 (1H,s,H-2′),5.51 (1H,d,J=5.8 Hz,H-7),4.52 (1H,d,J=5.2 Hz,H-7′),3.89 (1H,dd,J=10.7,7.1 Hz,H-9′),3.72 (1H,m,H-9),3.80 (3H,s,3-OH3),3.71 (3H,s,3′-OCH3),3.69 (3H,s,3"-OH3),3.68 (1H,m,H-9′),3.64 (1H,m,H-9),3.44 (1H,dd,J=12.6,5.5 Hz,H-8),3.18 (3H,s,7′-OH3),2.84 (1H,dd,J=12.2,6.8 Hz,H-8′);13C NMR (150 MHz,CDCl3)δ:149.2 (C-3),148.6 (C-4′),148.3 (C-3"),147.8 (C-4),146.3 (C-4"),145.1 (C-3′),135.4 (C-1),134.5 (C-1′),132.0 (C-1"),129.3 (C-5′),123.2 (C-6"),119.7 (C-6),117.2 (C-6′),116.2 (C-5),115.6 (C-5"),114.7 (C-2"),112.7 (C-2′),110.5 (C-2),89.3 (C-7),85.0 (C-7′),65.3 (C-9),64.3 (C-9′),57.2 (7′-OCH3),56.7 (3-OCH3),56.5 (C-8′),56.3 (3′-OCH3),56.3 (3"-OCH3),55.3 (C-8)。以上数据与文献[24]报道一致,故鉴定为hawthornnin C。
化合物10黄色油状;ESI-MS:m/z535 ([M+Na]+),分子式C28H32O9;1H NMR (600 MHz,CDCl3)δ:6.90 (1H,d,J=1.6 Hz,H-2),6.78 (1H,dd,J=8.2,1.6 Hz,H-6),6.72 (1H,d,J=8.1 Hz,H-5),6.67 (1H,s,H-6′),6.66 (1H,d,J=7.7 Hz,H-5"),6.58 (1H,d,J=1.5 Hz,H-2"),6.57 (1H,dd,J=8.1,1.7 Hz,H-6"),6.47 (1H,s,H-2′),5.49 (1H,d,J=6.3 Hz,H-7),4.51 (1H,d,J=5.4 Hz,H-7′),3.89 (1H,dd,J=10.7,6.9 Hz,H-9′),3.80 (1H,dd,J=10.9,5.7 Hz,H-9),3.79 (3H,s,H-3-OCH3),3.72 (3H,s,H-3′-OH3),3.68 (3H,s,H-3"-OCH3),3.73 (1H,dd,J=11.1,7.3 Hz,H-9′),3.66 (1H,dd,J=10.8,6.8 Hz,H-9),3.45 (1H,dd,J=12.3,6.3 Hz,H-8),3.18 (3H,s,7′-OH3),2.87 (1H,dd,J=12.5,6.6 Hz,H-8′);13C NMR (150 MHz,CDCl3)δ:149.7 (C-3),149.3 (C-4′),148.7 (C-3"),148.5 (C-4),146.7 (C-4"),145.1 (C-3′),135.2 (C-1),133.4 (C-1′),131.8 (C-1"),129.6 (C-5′),123.2 (C-6"),119.9 (C-6),117.2 (C-6′),116.6 (C-5),115.7 (C-5"),114.7 (C-2"),112.7 (C-2′),110.5 (C-2),89.4 (C-7),85.0 (C-7′),65.0 (C-9),64.3 (C-9′),57.2 (C-7′-OCH3),56.5 (C-3-OCH3),56.4 (C-8′),56.4 (C-3-OCH3),56.3 (C-3′-OCH3),55.2 (C-8)。以上数据与文献[24]报道一致,故鉴定为hawthornnin D。
化合物11白色粉末;ESI-MS:m/z441 ([M+Na]+),分子式C22H26O8;1H NMR (600 MHz,MeOD)δ:6.65 (4H,s,H-2′,2",6′,6"),4.71 (2H,d,J=4.0 Hz,H-2,6),4.26 (2H,dd,J=8.9,6.8 Hz,H-4,8),3.87 (2H,dd,J=9.1,3.3 Hz,H-4,8),3.84 (12H,s,4×OCH3),3.14 (2H,d,J=1.5 Hz,H-l,5);13C NMR (150 MHz,MeOD)δ:149.4 (C-3′,3",5′,5"),136.5 (C-4′,4"),132.9 (C-1′,1"),104.5 (C-2′,2",6′,6"),87.7 (C-2,6),72.6 (C-4,8),56.8 (C-3′,3",5′,5"-OCH3),55.5 (C-1,5)。以上数据与文献[25]报道一致,故鉴定为丁香树脂酚(syringaresinol)。
化合物12白色粉末;ESI-MS:m/z387 ([M-H]-),分子式C21H24O7;1H NMR (600 MHz,CDCl3)δ:6.90 (1 H,d,J=2.7 Hz,H-3),6.89 (1 H,d,J=2.5 Hz,H-6"),6.82 (1 H,dd,J=8.1,2.1 Hz,H-2"),6.58 (2H,s,H-2′,6),5.64 (1 H,s,H-4′ or 4"OH),5.53 (1 H,s,H-4′ or 4"OH),4.73 (1H,d,J=4.7 Hz,H-2),4.71 (1H,d,J=4.7 Hz,H-6),4.27 (2H,m,H-4a,8a),3.90 (9H,s,C-3′,5′,5"-OCH 3),3.4 (2H,m,H-4b,8b),3.10 (2H,m,H-l,5);13C NMR (150 MHz,CDCl3)δ:147.1 (C-5′and C-3′),146.7 (C-5"),145.2 (C-1"),134.2 (C-1′),132.8 (C-4"),132.1 (C-4′),118.9 (C-2"),114.3 (C-3"),108.6 (C-6"),102.7 (C-2′ and C-6′),86.1 (C-2),85.8 (C-6),71.8 (C-8),71.6 (C-4),56.3 (C-5′-OCH3and C-3′-OCH3),55.9 (C-5" -OCH3),54.4 (C-5),54.1 (C-1)。以上数据与文献[26]报道一致,故鉴定为皮树脂醇(medioresinol)。
化合物13白色粉末;ESI-MS:m/z395 ([M+Na]+),分子式C20H20O7;1H NMR (500 MHz,CDCl3)δ:6.93 (1H,d,J=2.0 Hz,H-2"),6.91 (1H,d,J=1.6 Hz,H- 6′),6.89 (1H,dd,J=8.0,2.0 Hz,H-6"),6.88 (1H,dd,J=8.4,1.6 Hz,H-2′),6.80 (1H,d,J=8.0 Hz,H-5"),6.78 (1H,d,J=8.4 Hz,H-5),5.33 (dt,J=7.4,3.6 Hz,2H,H-3 and H-7),4.33 (1H,dd,J=6.9,1.3 Hz,Hb-1),4.04 (1H,dd,J=9.4,4.6 Hz,Ha-1),3.90 (3H,s,OCH3),3.90 (1H,m,H-8),3.91 (3H,s,OCH3),3.46 (1H,dd,J=8.8,3.4,H-4);13C NMR (125 MHz,CDCl3)δ:177.1(C-5),147.0(C-3′),146.8 (C-3"),145.6 (C-4′),145.3 (C-4"),132.4 (C-1′),132.3 (C-1"),118.4 (C-6′),118.1 (C-6"),114.7 (C-5′),114.4 (C-5"),108.2 (C-2"),108.1 (C-2′),84.7 (C-7),83.4 (C-3),72.7 (C-1),56.1 (OCH3),56.0 (OCH3)。以上数据与文献[27]报道一致,故鉴定为4-ketopinoresinol。
化合物14白色粉末;ESI-MS:m/z381 ([M+Na]+),分子式C20H22O6;1H NMR (500 MHz,CDCl3)δ:6.70 (1H,d,J=8.0 Hz,H-5′),6.68 (1H,d,J=7.9 Hz,H-5),6.63 (1H,d,J=2.0 Hz,H-2′),6.56 (1H,dd,J=8.0,2.0 Hz,H-6′),6.50 (1H,d,J=2.0 Hz,H-2),6.48 (1H,dd,J=7.9,2.0 Hz,H-6),4.13 (1H,dd,J=9.1,7.0 Hz,H-9′),3.89 (1H,dd,J=9.1,7.4 Hz,H-9),3.77 (3H,s,OCH3),3.76 (3H,s,OCH3),2.87 (1H,dd,J=14.0,5.4 Hz,H-7a),2.80 (1H,dd,J=14.0,7.0 Hz,H-7b),2.62~2.43 (4H,m,H-7,H-8,H-8′);13C NMR (125 MHz,CDCl3)δ:181.6 (C-9),149.0 (C-3 and C-3′),146.3 (C-4),146.2 (C-4′),131.3 (C-1),130.7 (C-1′),123.1 (C-6),122.3 (C-6′),116.3 (C-5),116.2 (C-5′),113.8 (C-2),113.2 (C-2′),73.0 (C-9′),56.5 (C-3-OCH3),56.4 (C-3′-OCH3),47.8 (C-8),42.5 (C-8′),39.0 (C-7),35.4 (C-7′)。以上数据与文献[28]报道一致,故鉴定为罗汉松脂酚(matairesinol)。
3.2 对DPPH自由基的清除活性
DPPH自由基是一种稳定的含氮自由基,结构中存在单电子。当化合物具有酚羟基时,可以提供氧原子,与自由基结构中的孤对单电子配对,从而减少电子数目,起到清除自由基的作用。使用清除DPPH自由基的方法,对牛筋果中酚性化合物1~14进行了体外抗氧化活性筛选,从表1可以看出化合物7~14在500 μM的初筛浓度下,对DPPH自由基的清除率达到了50%以上,说明其具有一定的抗氧化能力。进一步测定这几个化合物在不同浓度下的DPPH自由基清除率,牛筋果酚性物质对DPPH自由基的清除作用如图2所示,由图可以看出,化合物7~14在1~500 μM对DPPH自由基均有清除作用,且随浓度升高,清除作用增强。其中,化合物11和12清除自由基能力与阳性对照Trolox (64.42±4.65 μM)相当;而化合物13和14EC50分别为53.88±5.34和32.67±3.96 μM,优于阳性对照。对比化合物1~6,化合物7~14活性更好,应当是由于邻对位酚羟基及其个数增强了其自由基清除能力;此外,化合物13~14活性优于11~12,对比结构发现前两者包含有γ-内酯结构单元,而后两者是呋喃结构单元,这可能是由于γ-内酯结构单元结构单元显著提高了其生物利用度。
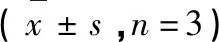
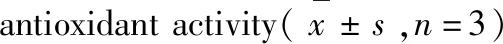

序号No.化合物Compound清除率Scavengerate(%)EC50(μM)1去甲丁香色原酮Noreugenin6.652-2柴胡色原酮ASaikochromoneA9.208-35,7-Dimethoxy-2-methylchromone1.631-42-Hydroxymethylalloptaeroxylin20.68-5羟苯乙酯Ethylparaben5.864-6苯丙酮Propiophenone5.498-7CephafortinB60.22-8去氢双松柏醇Dehydroconiferylalcohol53.93-9HawthornninC76.10125.4±26.510HawthornninD67.73133.6±31.111丁香树脂酚Syringaresinol93.3768.4±5.6512皮树脂醇Medioresinol92.0477.73±4.87134-Ketopinoresinol87.5553.88±5.3414罗汉松脂酚Matairesinol88.6832.67±3.96水溶性维生素ETrolox-64.42±4.65

图2 不同浓度样品对DPPH清除能力的影响Fig.2 Effects of different concentration samples on DPPH radical scavenging antioxidant activity
4 结论
本研究从采自我国海南的牛筋果中分离鉴定了14个化合物,其中10个化合物为首次从牛筋果中分离得到。此外,化合物13和14表现出显著的DPPH自由基清除能力,并开展了其抗氧化构效关系初步的研究,初步分析认为邻对位酚羟基及其个数与γ-内酯结构单元是是牛筋果中酚性化合物对DPPH自由基清除能力的主要活性位点。本文首次揭示了牛筋果中抗氧化的活性成分,为合理开发牛筋果的药用资源和新型抗氧化剂提供了科学依据。
