MicroRNA-129-5p在卵巢癌中表达的光声成像研究
2019-11-02张蓓蕾李艳红
张蓓蕾,吴 涛,姜 锋,李艳红,王 福,李 怡
(1.空军军医大学唐都医院妇产科,陕西 西安 710038;2.空军军医大学唐都医院普外科,陕西 西安 710038;3.西安电子科技大学生命科学技术学院,陕西 西安 710071)
MicroRNA(miRNA)是一类非编码的约22个核苷酸的小RNA,通过转录后水平调节基因的表达。miRNA通过与其靶mRNA序列的3′TR完全或不完全的碱基配对,导致miRNA降解或翻译抑制各种各样的生命过程,包括细胞增殖、代谢和致癌作用[1]。miRNA在多种癌症中可特异表达,一些过表达的miRNA起着致癌基因作用,一些表达下调的miRNA起着抑癌基因的作用[2]。研究发现miR-129-5p在上皮性卵巢组织中呈显著性差异表达,提示miR-129-5p在卵巢癌的发生发展中起着重要作用[3]。DNA甲基化是指在DNA甲基转移酶催化的作用下,DNA上的某些序列的胞嘧啶的第5位碳原子上被加上一个甲基基团,变成5-甲基胞嘧啶[4]。甲基化可以通过去甲基化药物,如DNA甲基转移酶抑制剂5-aza-2’-deoxycytidine(5-Aza-dC)来逆转,使基因重新表达。有研究已发现在癌症中,用5-Aza-dC处理后可以降低DNA的甲基化水平[5]。
鉴于miRNA在多种生物过程中的重要作用,已经开发了许多方法来检测miRNA的表达,例如Northern杂交、实时PCR和微阵列。然而,这些常规方法通常需要裂解或固定细胞,不能在体反映miRNA的活性[6]。以荧光蛋白、荧光素酶或分子信标等作为分子探针的分子影像技术为研究活体内基因的特异性表达提供了一种新的检测手段。在本研究中,我们设计了一种酪氨酸酶报告基因来监测卵巢癌中miR-129-5p的表达。酪氨酸酶(tyrosinase,TYR)是负责黑色素生产的主要酶,可以提供很强的光声成像的吸收对比度。我们通过黑色素体内外含量、酪氨酸酶活性、光声信号证明了酪氨酸酶报告基因监测miR-129-5p表达活性的可行性。
1 材料与方法
1.1 材料
酪氨酸酶TYR基因(NM_000372)质粒GV140-TYR购自上海吉凯公司;卵巢癌细胞SKOV3购自中国科学院上海细胞库,并培养在DMEM培养基中,补充有10%胎牛血清、1%谷氨酰胺、100mg/mL链霉素和100U/mL青霉素(invitrogen,CA);miRNA-129-5p寡核苷酸购自上海吉码公司;一步法cDNA合成试剂盒、SYBR Premix Ex TaqⅡ试剂盒购自日本TaKaRa公司;L-酪氨酸、左旋多巴(levodopa,L-DOPA)、5-Aza-dC全部购自中国碧云天公司。
1.2 方法
1.2.1 TYR和TYR-3xTS报告基因的构建
以质粒GV140-TYR为模板,通过PCR扩增TYR DNA,将TYR cDNA插入到pcDNA 3.1(+)载体的NheⅠ和BamH Ⅰ多克隆位点得到pcDNA3.1-TYR报告基因。为得到pcDNA3.1-TYR-3xTS报告基因,我们合成了一种与miR-129-5p 完全互补配对的靶序列(3xTS),并将其插入到pcDNA3.1-TYR载体的EcoR Ⅰ和Xho Ⅰ位点。最后,通过DNA测序确定了重组质粒pcDNA3.1-TYR和pcDNA3.1-TYR-3xTS。
1.2.2 细胞培养和转染
人源293细胞和人卵巢癌细胞系SKOV3培养在DMEM、10%胎牛血清和1U/mL青霉素/链霉素培养基中,并置于37°C下5%二氧化碳培养箱中。对于转染,将细胞接种在24孔板中并培养过夜。第2天,采用Lipofectamine 2000对质粒pcDNA3.1-TYR、pcDNA3.1-TYR-3xTS和miRNA-129-5p寡核苷酸共转。
1.2.3 实时定量PCR
用TRIzol试剂从细胞中分离提取总RNA。采用一步法cDNA合成试剂盒进行cDNA合成,然后使用SYBR Premix Ex Taq Ⅱ试剂盒在ABI 7700 PCR仪器上进行实时定量PCR。U6小核RNA(snRNA)用作内参。miRNA-129-5p和U6 snRNA引物序列如下:miRNA-9引物上游序列为5′-TCT TTG GTT ATC TAG CTG TAT GA-3′;U6上游序列为5′-CAG GGG CCA TGC TAA ATC TTC-3′;U6反向序列为5′-CTT CGG CAG CAC ATA TAC TAA AAT-3′。miRNA-129-5p反向引物是试剂盒中的通用引物(Uni-miR qPCR引物)。
1.2.4 细胞黑色素含量测量
将细胞用2mmol/L L-酪氨酸预处理24h,然后离心分离并用PBS洗涤3次。将细胞沉淀物进行超声处理并用100mL NaOH(1mol/L)在37℃下裂解,然后将细胞提取物转移到96孔板,每个样品的黑色素含量是采用多功能酶标仪采集它们在405nm处的吸光度测定。
1.2.5 细胞TYR活性测量
采用PBS洗涤96孔板中的细胞,并用50μL NaOH(1mol/L)裂解,然后加50μL 2mg/mL的L-DOPA到每个孔。将最终混合物在37℃下保温15min,采集它们在475nm处的吸光度。
1.2.6 体外细胞光声成像和图像分析
使用多光谱光声成像系统进行体外光声成像测定。转染了质粒或RNA的细胞收集在PCR管中,然后使用手持式光声成像探头获取光声在PCR管底部发出的信号,光声信号最终被超分辨率小动物光声成像系统(型号:MOST invision 128)收集。
1.2.7 小鼠在体光声和生物发光成像
所有实验动物操作严格依照空军军医大学颁发的《实验动物管理条例》。实验裸鼠(约4周)购自空军军医大学实验动物中心。将SKOV3卵巢癌细胞重悬于100mL PBS中,然后将SKOV3细胞和100mL基质胶(matrigel)植入小鼠的两侧。小鼠右侧用5-Aza-dC(2mg/kg)处理,左侧不处理。72h后,体内成像时,用2%异氟烷气体麻醉小鼠。光声成像采用和体外成像相同的方法进行。生物发光成像时,将D-荧光素(150mg/kg)腹腔注射入小鼠体内,采用小动物活体成像系统(型号:IVIS spectrum)成像。选定感兴趣区进行图像分析,使用Image J软件对光声信号强度进行定量分析或使用Living Imaging Software 4.1分析生物发光信号强度。
1.3 统计学方法

2 结果
2.1 基于TYR报告基因的miRNA成像系统的设计
如图1所示,将与miR-129-5p完全互补配对的靶序列(3xTS)插入TYR载体的3′TR中,产生CMV/TYR-3xTS报告基因。同时,不包含3xTS的CMV/TYR报告基因作为对照。通过转染将CMV/TYR-3xTS报告基因导入细胞,表达的TYR将催化黑色素合成,得到的基因产物黑色素可以作为光声成像的靶标。如果不存在miR-129-5p,细胞中的TYR将正常表达。相反,当内源产生或外源miR-129-5p在细胞中表达,miR-129-5p将与CMV/TYR-3xTS报告基因的3xTS结合,抑制TYR活性和黑色素生成,进而通过光声成像系统检测到的光声信号减少。

图1 基于酪氨酸酶的报告基因系统示意图
2.2 报告基因系统的验证
为了验证基于TYR的报告基因系统,向非黑色素细胞HEK293细胞(其miR-129-5p表达相对较低)转染了CMV/TYR质粒或CMV/TYR-3xTS质粒,或将质粒与miR-129-5p RNA共转染,观察它们的颜色和黑色素含量,如图2A中上排的图片所示,CMV/TYR转染或CMV/TYR-3xTS和NC共转染的细胞呈现深色,而CMV/TYR-3xTS和miR-129-5p共转染的细胞或293未转染的细胞显示浅色,表明外源miR-129-5p与CMV/TYR-3xTS的3xTS结合并抑制了TYR基因的表达。随后,采用L-酪氨酸(2mmol/L)处理CMV/TYR或CMV/TYR-3xTS转染的细胞,24h后它们的颜色显著增强,但是293未转染的细胞没有明显变化(见图2A中下排的图片)。为了量化分析这些细胞中的黑色素含量,在405nm处测其吸光度。除了293未转染细胞,L-酪氨酸在处理过细胞后,黑色素的产生都增加了(见图2B)。评估转染细胞中的酪氨酸酶活性,结果表明CMV/TYR转染或CMV/TYR-3xTS和NC共转染的细胞随着时间的推移酪氨酸酶活性增加,并且显著高于293未转染细胞或CMV/TYR-3xTS和miR-129-5p共转染组,在8小时时间点增加约1.8倍(见图2C)。
2.3 基于TYR的报告基因对miR-129-5p成像的特异性
为了研究TYR的报告基因的特异性,转染不同量(0、1、2、4μg)的CMV/TYR或CMV/TYR-3xTS质粒进入293细胞,然后收集细胞,检查它们的颜色和黑色素含量。将逐渐增加的质粒导入细胞后,颜色(见图3A)和黑色素产生(见图3B)明显逐渐增加。此外,通过检测在475nm处的吸收值,两转染组的TYR活性也是以剂量依赖性方式增加(见图3C)。然后我们检测细胞样品的光声信号,定量分析表明光声信号是根据CMV/TYR-3xTS质粒的增加而增加的,最终约增加4.6倍(见图3D)。

注:A为293细胞转染不同质粒后,收集细胞进行拍照;B为黑色素含量的测定;C为酪氨酸酶活性的测定;*P<0.05。

注:A为293细胞转染不同浓度的质粒后,收集细胞进行拍照;B为黑色素含量的测定;C为酪氨酸酶活性的测定;D为细胞样品的光声成像。*P<0.05,**P<0.01。
图3基于TYR报告基因的剂量-表达评估
Fig.3 Dose-Response Assessment of the TYR-Based Reporter Gene
相比之下,随着外源转染的miR-129-5p(0、5、10、20、40nmol/L)浓度的增加和固定量(4μg)的CMV/TYR-3xTS质粒导入293细胞中,细胞颜色越来越浅(见图4A)。此外,还观察到黑色素含量明显逐渐减少(见图4B),酪氨酸酶TYR活性(见图4C)和光声强度(见图4D)明显降低,表明外源导入的miR-129-5p与CMV/TYR-3xTS报告基因作用导致了TYR基因的翻译抑制,因此TYR的活性受到抑制。
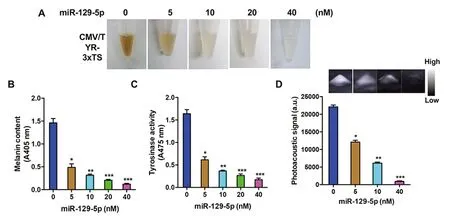
注:A为293细胞转染不同浓度的miR-129-5p后,收集细胞进行拍照;B为黑色素含量的测定;C为酪氨酸酶活性的测定;D为细胞样品的光声成像。*P<0.05,**P<0.01,***P<0.001。
图4TYR对外源miR-129-5p的抑制活性
Fig.4 Repressed Activity of TYR in Response to Exogenous miR-129-5p
2.4 在DNA甲基化调控作用下监测内源性miR-129-5p表达
为了监测DNA甲基化期间内源miR-129-5p的表达,将CMV/TYR-3xTS转染卵巢癌细胞SKOV3,并进一步用不同浓度(0、0.5、1.0、2.0μmol/L)的DNA甲基转移酶抑制剂5-Aza-dC处理细胞72h。结果显示随着5-Aza-dC剂量的增加,细胞颜色逐渐变浅(见图5A)。此外,随着不同剂量的5-Aza-dC处理后,黑色素含量(见图5B)、TYR活性(见图5C)和光声信号(见图5D)也逐渐减少。这些减少可能归因于5-Aza-dC激活了内源性miR-129-5p的产生,从而抑制TYR活性。为了证实我们的推测,我们采用实时定量PCR检测以确定5-Aza-dC处理后细胞中miR-129-5p的表达水平。同预期的一样,随着5-Aza-dC剂量的增加,miR-129-5p表达水平随剂量逐渐上调(见图5E)。

注:A为不同浓度的5-Aza-dC处理SKOV3细胞后,收集细胞进行拍照;B为黑色素含量的测定;C为酪氨酸酶活性的测定;D为细胞样品的光声成像;E为实时定量PCR检测miR-129-5p的表达。*P<0.05,**P<0.01。
图5监测用5-Aza-dC处理后的内源性miR-129-5p
Fig.5 Monitor Endogenous miR-129-5p Exposure to 5-Aza-dC Treatment
2.5 miR-129-5p的动物光声成像
为了采用基于TYR的报告基因系统对表观遗传调控过程中miR-129-5p的表达进行监测,我们共转染CMV/TYR-3xTS和内参质粒pGL3-control进入卵巢癌细胞SKOV3,然后收集5×106个转染后的细胞,皮下植入裸鼠两侧,其中用5-Aza-dC处理右侧细胞。在处理3天后,如图6A所示,用5-Aza-dC处理的小鼠右侧翼的光声信号显著降低。对感兴趣区域(region of interest,ROI)定量分析表明来自右侧的光声强度比左侧的强度低1.54倍(见图6B)。相比之下,在5-Aza-dC处理后、内参pGL3-control,都会表达荧光素酶,小鼠左右侧翼之间没有明显的的信号变化(见图6C、图6D)。为了确认光声信号的减少是由于体内miR-129-5p的激活,我们分离了来自小鼠两侧的组织并对miR-129-5p表达进行实时PCR分析(见图6E)。结果表明,来自小鼠右侧的miR-129-5p表达水平比左侧高约3.2倍,表明miR-129-5p在5-Aza-dC处理后被激活,从而导致光声信号减少。

注:A为小鼠光声成像;B为光声成像定量分析;C为小鼠生物发光成像;D为生物发光成像定量分析;E为实时定量PCR检测miR-129-5p的表达。*P<0.05。
图6表观遗传调控下miR-129-5p的体内成像
Fig.6 In Vivo Imaging of miR-129-5p during Epigenetic Gene Regulation
3 讨论
在本研究中,我们通过体内外实验成功地证明了使用酪氨酸酶报告基因和光声成像来监测miR-129-5p表达变化的可行性。由于miRNA在调节各种生物过程中(包括细胞增殖、分化和肿瘤发生发展)有非常重要的作用,基于酪氨酸酶报告基因的光声成像检测,将是一种有用的实时监测miRNA表达的工具。
3.1 酪氨酸酶是一种优良的光声成像探针
光声成像是一种新兴的分子成像模式,能够产生比现有光学成像模式更高空间分辨率(在组织穿透深度约5cm时高达500mm)的体内3D图像[7]。这种非侵入性成像模态背后的物理机制是光声效应(即从光到超声的转换)。光声成像还可以使用内源性或外源性光声造影剂实时提供疾病的功能和分子信息[8-9]。因此非常需要开发用于光声成像的新成像探针。黑色素具有宽的光学吸收光谱,在近红外波长处具有显著的吸收,这能提供良好的组织穿透深度[10-11]。由于这种独特的性质,黑色素已被证明是光声成像优良的内源造影剂[12-14]。鉴于酪氨酸酶可调控黑色素的合成,因此我们探索了使用酪氨酸酶作为光声成像的报告基因。本研究结果显示,在转染了酪氨酸酶报告基因后,293细胞中的黑色素含量和酪氨酸酶活性显著增加,且随着质粒浓度及作用时间的增加而逐渐增加,并且细胞中的光声信号也呈浓度梯度依赖性增强。结果表明,酪氨酸酶报告基因可成功用于光声成像。
3.2 酪氨酸酶报告基因成功监测miRNA的表达
目前,有报道各种荧光探针用于监测miRNA在肿瘤细胞中的表达[15-16]。尽管这些光学探针为miRNA成像提供了很好的表达方式,但是它们在深度成像方面受到极大的影响。此外,由于外部光源激发,荧光探针通常具有自发荧光背景,在活体动物中成像常受背景干扰[17-18]。因此,需要开发新型的分子探针来无创监测miRNA的表达。本研究中,我们通过将与miR-129-5p完全互补配对的靶序列(3xTS)插入酪氨酸酶基因载体的3′TR中,得到TYR-3xPT报告基因载体,从而可以无创地提供有关miRNA的在体信息。在用5-Aza-dC处理的SKOV3卵巢癌细胞中,来自CMV/TYR-3xTS报告基因的酪氨酸酶活性明显被剂量增加的miR-129-5p抑制。miR-129-5p调节的酪氨酸酶活性抑制,从而导致体外和体内黑色素含量和光声信号的明显降低。此外,在5-Aza-dC处理后,皮下裸鼠模型右侧也观察到光声信号的显著降低,表明miR-129-5p的表达被5-Aza-dC激活,从而通过与其靶序列结合最终抑制酪氨酸酶活性和光声信号。实时定量PCR结果证实了这一推测。
综上所述,本研究结果表明,基于酪氨酸酶的报告基因系统CMV/TYR-3xTS可用于监测DNA甲基化调控过程中miR-129-5p的表达,并可作为一种新型的报告基因系统用于非侵入性地监测生物体中其他miRNA的表达及miRNA介导的生物学过程。
