早期肠内营养支持治疗ICU重症肺炎患者的临床效果观察
2019-10-31刘英丽天津市职业病防治院300011
刘英丽 天津市职业病防治院 300011
重症肺炎是一种好发于老年人群的严重肺部感染性呼吸系统疾病。该病发病机制复杂,临床多因基础疾病较多、营养不良、微生物感染及营养不良等多种原因所致,具有发病率、病死率高特点。近年来多项研究证实,重症肺炎患者存在明显肠黏膜屏障功能障碍,易引起内毒素与肠道细菌移位,释放大量促炎因子而发生全身炎性反应和多器官功能障碍综合征,严重威胁患者生命健康[1]。而有效的肠内营养支持可有效保护患者肠黏膜屏障,改善其机体营养状态同时减少相应并发症和病死率。故本文尝试针对本院2016年4月—2018年9月收治的87例ICU重症肺炎患者实施不同肠内营养支持,以探讨早期肠内营养支持对其细胞免疫、营养状态及预后影响,并取得较为理想效果,现将具体结果报道如下。
1 资料与方法
1.1 一般资料 选取2016年4月—2018年9月期间在本院ICU病房接受治疗的87例重症肺炎患者作为观察对象,将其按随机数字表法分为研究组(n=45)与对照组(n=42)。研究组男24例,女21例,年龄61~84(70.2±7.5)岁,慢性健康状况评分系统Ⅱ(APECHEⅡ)评分15~23(18.84±4.27)分;对照组男22例,女20例,年龄62~86(70.8±7.1)岁,APECHEⅡ评分16~23(18.91±4.24)分。两组患者性别、年龄、APECHEⅡ评分比较差异无统计学意义(P>0.05),具有可比性。
1.2 纳入标准 (1)均符合《中国成人社区获得性肺炎诊断和治疗指南(2016年版)》中“重症肺炎”相关诊断标准;(2)营养风险筛查NRS评分≥3分;(3)胃肠道解剖完整且具有一定功能;(4)需进行机械通气;(5)研究经本院医学伦理委员会审核批准;(6)患者及其家属知情同意且签署《知情同意书》。
1.3 排除标准 (1)严重胃肠道、肝肾、心脑血管等脏器疾病;(2)严重代谢性、恶性肿瘤等消耗性疾病,或肺病肿瘤所致阻塞性肺炎;(3)严重免疫功能低下、免疫抑制或免疫缺陷;(4)处于围术期或严重创伤后急性期;(5)治疗前近4周内曾使用免疫调节剂或糖皮质激素类药物;(6)既往有功能异常或消化道手术史;(7)存在肠内营养禁忌证,或其他部位严重感染。
1.4 方法 两组患者入院后均临床给予抗感染、抗休克、化痰、氧疗、纠正内环境紊乱、胸部物理治疗、对症支持等内科综合治疗,并根据患者病情需要给予机械通气、气管插管、血管活性药物治疗,待其禁食24~48h后分别给予不同肠内营养支持治疗,均遵循“早期允许性低热卡”原则,临床均分别给予相同氮量0.2g/(kg·d)和相同热量125.52kJ/(kg·d)的肠外、肠内营养制剂[2]。
对照组患者在上述基础上给予完全肠外营养支持治疗,根据患者病情程度、身体状况通过中心静脉持续24h输注全营养混合液,其主要成分为氨基酸、糖、微量元素、维生素、脂肪乳剂、电解质等,购自于华瑞公司,配制于3L营养输液袋内,且按胰岛素∶糖为1∶4方式加入正规胰岛素,并根据血糖情况调整其胰岛素用量,总支持时间应在10d以上,10d后逐步停用。
研究组患者在上述基础上给予早期肠内营养支持治疗,根据患者病情程度、身体状况、胃肠功能通过鼻胃管或鼻空肠管进行鼻饲,24h持续选择鼻胃管或鼻空肠管进行肠内营养液匀速滴注;若患者合并糖尿病则选用瑞代,若无糖尿病合并症则选用瑞先,两种肠内营养制剂均购自华瑞公司;患者进食时,注意抬高患者头部20°~40°,若肠内营养制剂温度较低则采用电加温器加温后进食;营养支持第1天注意提供所需能力的40%,之后每天增加20%,第4天即可给予全量,其中不足部分经静脉补充。两组均连续支持治疗14d。
1.5 观察指标 (1)细胞免疫:采集患者4ml空腹肘静脉血后,应用流式细胞仪、免疫比浊法检测其免疫球蛋白A(IgA)、免疫球蛋白M(IgM)、免疫球蛋白G(IgG)水平和CD4+、CD4+/CD8+变化,应用流式细胞仪检测其;(2)营养状态:检测其血红蛋白(HGB)、前白蛋白(PAB)、白蛋白(ALB)水平变化;(3)对比其机械通气时间和呼吸机相关性肺炎(VAP)发生率。
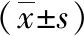
2 结果
2.1 两组治疗前后细胞免疫功能指标比较 治疗前,两组IgA、IgM、IgG、CD4+、CD4+/CD8+指标比较差异无统计学意义(P>0.05),治疗后,两组IgA、IgM、IgG、CD4+、CD4+/CD8+指标较治疗前比较明显上升,且研究组IgA、IgM、IgG、CD4+、CD4+/CD8+指标上升幅度明显大于对照组,差异有统计学意义(P<0.05)。见表1。

表1 两组治疗前后细胞免疫功能指标比较
注:与治疗前比较,aP<0.05;与对照组比较,bP<0.05。
2.2 两组治疗前后营养状态指标比较 治疗前,两组HGB、PAB、ALB水平比较差异无统计学意义(P>0.05),治疗后,两组HGB、PAB、ALB水平较治疗前比较明显上升,且研究组HGB、PAB、ALB水平上升幅度明显大于对照组,差异有统计学意义(P<0.05)。见表2。
2.3 两组治疗后预后情况比较 治疗后,研究组机械通气时间明显短于对照组,差异有统计学意义(P<0.05);研究组VAP发生率明显低于对照组,差异有统计学意义(P<0.05)。见表3。
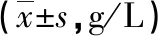
表2 两组治疗前后营养状态指标比较
注:与治疗前比较,aP<0.05;与对照组比较,bP<0.05。

表3 两组治疗后预后情况比较
注:与对照组比较,bP<0.05。
3 讨论
重症肺炎患者均临床存在严重肺部及全身感染,临床有10%~20%的重症肺炎患者需进入重症医学科(ICU)治疗[3]。而在ICU病房中重症肺炎患者均需进行有创机械通气,因此患者多处于应激状态、免疫功能低下而出现营养吸收障碍。相关数据表明,ICU 病房中进行有创机械通气的重症肺炎患者的营养不良率可达60%~80%,而营养不良治疗不当会引起呼吸肌萎缩,影响呼吸机的有效撤离和患者呼吸功能恢复,从而出现多脏器功能衰竭,甚至死亡。同时部分研究指出,重症肺炎患者进行有效营养支持干预后,其脱机成功率则可高达93%。因此临床给予积极抗感染、基础疾病治疗同时,给予有效营养支持已成为救治ICU重症肺炎的重要组成部分。
ICU重症肺炎患者处于应激状态,出现营养不良时极易导致机体免疫球蛋白水平和NK细胞活性降低,循环辅助T细胞的数量减少,CD4+、CD4+/CD8+指标明显下降,破坏患者免疫功能、肺功能及呼吸肌收缩功能,增加患者预后感染风险。因此,临床合理有效改善机体免疫功能和营养状态对促ICU重症肺炎患者恢复具有重要意义。临床营养支持方式主要包括肠内营养支持与肠外营养支持,其中肠内营养支持是指进入ICU病房治疗的24~48h内,在循环平稳状态下患者通过口服或管道吸收、分解营养物质,促使营养分子转化并被机体利用的生理性营养途径。肠外营养支持则是指通过静脉输入,将营养分子直接输注于血液中而被机体吸收利用[4]。与肠外营养支持比较,肠内营养支持更加符合人体胃肠生理,可有效保证人体最大免疫器官所需局部能源供应,及时补充机体所需营养同时,稳定机体内环境并提高机体免疫功能。本次结果显示,治疗后,研究组细胞免疫功能(IgA、IgM、IgG、CD4+、CD4+/CD8+)指标较治疗前及对照组比较明显更高;且研究组营养状态(HGB、PAB、ALB)指标水平较治疗前及对照组比较明显更高。结果说明,早期肠内营养支持治疗可有效提高ICU重症肺炎患者机体免疫力同时,改善其营养状态。
相关研究指出,肠内营养支持可有效改善并维护肠黏膜结构及功能,同时减少肠道菌群易位及应激性溃疡发生,还可有效维持其他脏器功能的正常运行;而长期肠外营养支持存在肝胆并发症、导管相关感染、大量肠道菌群和毒素易位引起脓毒症、多脏器功能衰竭等缺陷。 同时,Doig等[5]研究发现,早期肠内营养支持用于减少重症肺炎患者有创机械通气时间和VAS发生效果显著。本文结果显示,治疗后研究组患者机械通气时间明显短于对照组,且VAP发生率明显低于对照组。结果说明早期肠内营养支持治疗可明显缩短ICU重症肺炎患者机械通气时间、降低其VAS发生风险。
综上所述,临床针对ICU重症肺炎患者实施早期肠内营养支持治疗,可明显促进患者免疫功能恢复、营养状态改善,缩短其机械通气时间同时减少VAS发生,因此临床推广应用价值较高。
