酶法糖基化修饰对酪蛋白体外消化能力的影响
2019-10-29王小鹏赵新淮
王小鹏,赵新淮*
(1.河南农业大学食品科学技术学院,河南 郑州 450002;2.东北农业大学 乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
转谷氨酰胺酶(transglutaminase,TGase)途径蛋白质糖基化修饰反应(酶法糖基化修饰)是在TGase催化下,蛋白质(肽)的谷氨酰胺残基(酰基供体)和氨基糖的伯胺基团(酰基受体)发生共价交联反应,生成糖基化交联修饰产物,被修饰产物兼具蛋白质的大分子特性和糖类的亲水特性,表现出良好的溶解性、乳化性、胶凝性及热稳定性[1-2]。TGase途径糖基化可以在低温条件下、短时间内对食品蛋白质进行专一性修饰,生成结构明确的蛋白质修饰产物[3],避免了美拉德反应途径糖基化反应周期长、反应进程难以控制、副产物众多、有对健康不利产物生成等缺陷[4-6],是一种新型、安全的食品蛋白质糖基化修饰技术。
相对于TGase交联作用在食品工业中广泛应用[7-8],TGase催化蛋白质糖基化的研究起步较晚,目前仍处于基础研究阶段。2010年起,本课题组[9-11]利用TGase先后将氨基葡萄糖、壳寡糖、低聚壳聚糖、降解壳聚糖等连接到了酪蛋白、大豆分离蛋白、脱酰胺酪蛋白、脱酰胺大豆分离蛋白上,被修饰产物的持水性、胶凝性、流变学性质显著改善:相对于酪蛋白,氨基葡萄糖糖基化酪蛋白的持水性提高4.4 倍,吸油性提高1.5 倍;壳寡糖糖基化修饰后,大豆分离蛋白的乳化稳定性和泡沫稳定性分别增加34%和5.3%。近年来,人们在研究TGase途径糖基化对蛋白质理化性质和微观结构改善的同时,更多关注了这一新型糖基化修饰技术的应用前景。Gottardi[12]和Hong[13]等发现谷蛋白、火鸡肉蛋白水解物经TGase途径氨基葡萄糖糖基化修饰后,产物中美拉德反应中末期产物(AGEs)和二羰基化合物含量降低,被修饰产物的抗氧化、抗菌性显著增加;Yuan Fangzhou等[14]发现TGase途径氨基葡萄糖糖基化修饰可以改变虾原肌球蛋白的二级结构,以温和的方式降低虾制品导致的过敏反应。Xu Yujuan等[15]通过TGase途径氨基葡萄糖糖基化,有效提升了PSE(pale, soft and exudative)鸡胸肉的食用特性和经济价值。上述研究表明,TGase途径糖基化作为一种新兴的蛋白质修饰技术具有巨大的应用前景;然而,蛋白质经过糖基化修饰后,其消化性是否受到影响,是制约其工业化应用的关键,目前还没有研究涉及。
本研究利用TGase催化制备壳寡糖糖基化酪蛋白,十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)、反相-高效液相色谱(reverse phase-high performance liquid chromatography,RP-HPLC)证实糖基化修饰反应的发生;以水解度(degree of hydrolysis,DH)和三氯乙酸可溶性氮(trichloroacetic acid soluble nitrogen,TCA-SN)为指标分析糖基化修饰对蛋白质体外消化能力的影响;葡聚糖凝胶过滤色谱分析消化物中肽组分分子质量分布情况,以期科学评价TGase途径糖基化修饰对蛋白质消化性的影响,为新型蛋白质配料的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
酪蛋白、SDS、考马斯亮蓝R-250 美国Sigma公司;TGase(E.C. 2.3.2.13,1.1×102U/g) 江苏一鸣精细化工有限公司;葡聚糖凝胶G-25 美国GE Healthcare公司;壳寡糖(分子质量1 kDa,脱乙酰度90%) 浙江金壳药业有限公司;氨基葡萄糖盐酸盐、邻苯二甲醛 美国Amresco公司;胃蛋白酶(E.C. 3.4.23.1,4×104U/g)、胰蛋白酶(E.C. 3.4.21.4,1.2×105U/g) 上海国药集团化学试剂有限公司。
1.2 仪器与设备
2695 RP-HPLC系统 美国Waters公司;DYY-8C型电泳仪 北京六一仪器厂;Alpha 1-4中型冻干机德国Matin Christ公司;AKTA Purifier10蛋白纯化系统美国GE Healthcare公司;L-8800型氨基酸自动分析仪日本Hitachi公司。
1.3 方法
1.3.1 TGase途径壳寡糖糖基化酪蛋白(糖基化酪蛋白)的制备
参照Song Chunli等[10]的方法制备糖基化酪蛋白。酪蛋白溶液(50 g/L)与调整至中性的壳寡糖溶液均匀混合,酰基供体与酰基受体的物质的量比为1∶3,TGase添加量10 U/g(占酪蛋白比例计),pH 7.5,37 ℃反应180 min;灭酶后酸沉水洗,回调pH值至中性,冻干后即为糖基化酪蛋白。酪蛋白(不添加TGase)同样处理作为对照。
1.3.2 糖基化酪蛋白的SDS-PAGE验证
SDS-PAGE和考马斯亮蓝蛋白质染色参照Fan Yuting等[16]的方法,糖染色参照Zacharius等[17]的方法,略有改动。分离胶、浓缩胶分别为12%、4%。同时制备两块胶,对应位置点相同的样品,一块用于蛋白染色,一块用于糖染色,每孔上样15 μL,浓缩胶电压80 V,电流20 mA;待样品进入分离胶后,调整电压至120 V,电流35 mA。分别进行蛋白质染色与脱色、糖染色与脱色后,利用佳能50 D相机对胶片进行图像处理。标准蛋白分子质量为14.4~97.4 kDa。糖蛋白-辣根过氧化物酶用作阳性对照,同样处理的酪蛋白作为阴性对照。
1.3.3 糖基化酪蛋白中氨基葡萄糖导入量的RP-HPLC检测
1.3.3.1 样品处理
氨基葡萄糖导入量的检测参考Zhu Changyue等[11]的方法略有改动。取2 mL糖基化酪蛋白溶液(50 g/L)于安瓿瓶中,加入2.0 mL盐酸,100 ℃水解6 h。取0.3 mL水解液、0.7 mL硼酸缓冲溶液以及0.3 mL衍生试剂(0.5%邻苯二甲醛甲醇溶液),衍生后上机检测。
1.3.3.2 色谱条件
流动相A液:乙酸-乙酸钠缓冲溶液(0.2 mol/L,pH 3.6);流动相B液:甲醇溶液。色谱柱为C18(150 mm×4.6 mm,5 μm);流动相A-B(60∶40,V/V);进样量10 μL;流速0.5 mL/min,色谱柱温38 ℃;荧光检测器的激发波长337 nm,发射波长454 nm。
1.3.3.3 氨基葡萄糖标准曲线的绘制
配制1 g/L的氨基葡萄糖母液,稀释至0.5、1、2、5、10、20 mg/L,检测氨基葡萄糖的含量,绘制标准曲线。
1.3.4 蛋白质含量的测定
采用凯氏定氮法检测样品中的含氮量,利用转换因子6.38(酪蛋白)计算出样品中的蛋白质含量。糖基化酪蛋白中的蛋白质含量为:凯氏定氮法测出的样品中总氮量减去导入氨基葡萄糖所带入的氮含量,再乘以转换因子(6.38)。
1.3.5 必需氨基酸组成分析
样品酸水解后利用L-8800型氨基酸自动分析仪,按照设备操作说明书分析必需氨基酸含量。
1.3.6 糖基化酪蛋白的体外消化及水解动力学模型
糖基化酪蛋白的体外消化根据Tang Chuanhe等[18]的方法进行,并稍作修改。
1.3.6.1 胃蛋白酶水解
糖基化酪蛋白溶于去离子水中(50 g/L),调整溶液pH 1.9,加入胃蛋白酶(占蛋白质质量分数2%),37 ℃水解60 min;分别在0、10、20、30、40、50、60 min检测消化物的DH和TCA-SN,反应结束后迅速调整溶液pH 7,冻干。
1.3.6.2 胰蛋白酶水解
糖基化酪蛋白的胃蛋白酶水解物复溶于去离子水中(50 g/L),加入胰蛋白酶(占蛋白质质量分数6%),37 ℃水解120 min;分别在0、15、30、45、60、90、120 min时取样,沸水浴灭酶10 min后检测该时间点消化物的DH和TCA-SN。水解结束后沸水浴灭酶,调整水解物pH 7,冻干用于后续实验。酪蛋白同样水解处理。
1.3.6.3 糖基化酪蛋白水解程度的测定
参照赵新淮等[19]的方法计算蛋白质的DH,计算公式如下:

式中:6.38为酪蛋白的转换因子;8.2为每克酪蛋白中肽键总物质的量(mmol/g);M为待测样品水解前即存在的游离氨基含量,酪蛋白此值为0.57 mmol/g,糖基化酪蛋白此值为0.52 mmol/g。
参照Gauthier等[20]的方法进行TCA-SN测定。通过凯氏定氮法测得不同水解程度下样品中的总氮含量;取蛋白样品1∶1和质量分数20%的TCA溶液混合,充分振荡后10 000×g离心15 min,凯氏定氮法测定上清液中的氮含量。TCA-SN计算公式如下:

没有经过水解的蛋白样品利用TCA同样处理,其上清液中的氮含量作为空白扣除。
1.3.7 水解动力学分析
1.3.7.1 初始底物质量浓度对水解反应的影响
制备糖基化酪蛋白的胃蛋白酶水解物(水解时间60 min)。调整底物质量浓度至20、40、60、80 g/L,固定初始胰蛋白酶质量浓度为1.5 g/L,37 ℃条件下进行水解反应,分别反应0、30、60、90、120 min,测定得到DH随时间变化曲线。
1.3.7.2 初始酶质量浓度对水解反应的影响
制备两类糖基化酪蛋白的胃蛋白酶水解物(水解时间60 min),固定底物质量浓度为60 g/L。调整胰蛋白酶质量浓度分别为0.5、1.5、2.0 g/L,在37 ℃条件下进行水解反应,分别反应0、30、60、90、120 min,测定得到DH随时间变化曲线。
根据DH随时间的变化数据,利用1stOpt软件非线性回归拟合水解动力学方程。
1.3.8 两类糖基化酪蛋白消化物中的肽分子质量分布分析
糖基化酪蛋白消化物中的肽分子质量分布参照李畅[21]的方法进行分析。氧化型谷胱甘肽(612.6 Da)和天冬氨酸(133.1 Da)用作标准分子物质。
调整消化物质量浓度为50 g/L,上样量180 µL;去离子水洗脱,流速为0.3 mL/min;检测波长为215 nm和280 nm。分析各消化物紫外吸收强度随时间的变化趋势,根据标准分子物质的出峰时间计算消化物中肽分子质量的大致分布情况。
1.4 数据处理
本研究所有数据均为3 次独立重复实验的平均值;差异显著性分析使用SPSS 16.0软件进行,P<0.05,具有统计学意义;采用Excel 2010、Adobe Photoshop CS 5软件绘制图示;用1stOpt进行非线性拟合。
2 结果与分析
2.1 酪蛋白糖基化的SDS-PAGE验证

图1 酪蛋白及糖基化酪蛋白SDS-PAGE图Fig. 1 SDS-PAGE profiles of glycosylated and native caseinate stained for both protein and saccharide
由图1A可以看出,与酪蛋白(泳道1)相比,糖基化酪蛋白(泳道2)的α、β亚基谱带明显减少,而在分离胶顶端有明显的新谱带出现,表明有大分子的蛋白质共聚物生成。由图2B可以看出,在分离胶顶端出现大分子蛋白质聚合物的位置,出现了新条带,该条带具有明显的糖染色现象,表明糖基化酪蛋白中含有糖基。SDSPAGE表明,TGase催化酪蛋白与壳寡糖发生了糖基化反应,生成了大分子的糖蛋白共聚物。这直接证实了TGase催化壳寡糖连接到酪蛋白分子中。
美拉德反应途径糖基化产物的SDS-PAGE分析也有相似的谱图特征。Koch等[22]利用SDS-PAGE蛋白染色和糖染色实验,证实了乳清蛋白-柑橘胶美拉德反应产物中有糖蛋白的生成。Spotti等[23]研究了乳清蛋白-葡聚糖美拉德反应产物,发现修饰产物呈现出特异的蛋白染色和糖染色现象,且胶片上的条带呈现连续发散状,表明美拉德反应过程中有不同分子质量的糖基化交联产物生成。
2.2 氨基葡萄糖的导入量
2.2.1 氨基葡萄糖的标准曲线
利用RP-HPLC测定不同质量浓度氨基葡萄糖溶液对应的峰面积,可发现氨基葡萄糖质量浓度(x)与所测峰面积(y)呈线性关系,方程为:y=999 904x-59 368(R2=0.999 3)。线性关系良好,可以用于计算糖基化酪蛋白中氨基葡萄糖的导入量。
2.2.2 TGase途径糖基化酪蛋白中氨基葡萄糖的导入量
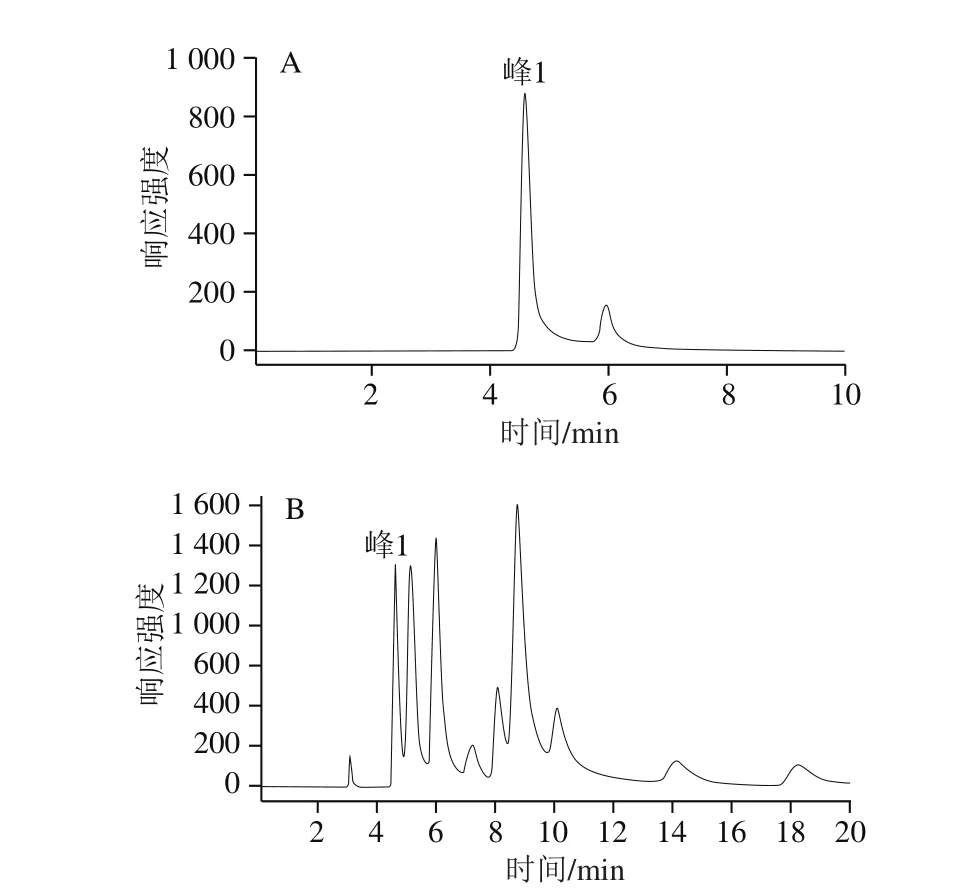
图2 氨基葡萄糖标准溶液(A)和糖基化酪蛋白水解物(B)的RP-HPLC分析谱图Fig. 2RP-HPLC pro fi les of OPA-derivatized glucosamine in standard solution (A) and glycosylated caseinate (B)
本研究采用RP-HPLC外标定量法对糖基化酪蛋白中氨基葡萄糖的导入量进行定量分析,以每千克酪蛋白中导入的氨基葡萄糖质量表示TGase催化的酪蛋白糖基化程度。由图2A可以看出,氨基葡萄糖标准品在4.6 min左右处出现峰1。在图2B中,壳寡糖糖基化酪蛋白的水解物也在4.6 min时出现了峰1,表明在该水解物中存在和氨基葡萄糖标准品水解物相同的组分,即糖基化酪蛋白中有氨基葡萄糖的存在。Jiang Shujuan等[24]率先利用RP-HPLC法分析了TGase途径糖基化大豆分离蛋白中氨基葡萄糖的导入量,发现1 mol大豆分离蛋白可以和3.3 mol的氨基葡萄糖共价交联。Wang Xiaojie等[3]利用TGase将氨基葡萄糖导入到了玉米醇溶蛋白中,1 g玉米蛋白可以结合97.48 mg氨基葡萄糖。本研究发现,TGase成功将壳寡糖连接到酪蛋白分子上,产物中氨基葡萄糖的导入量为6.86 g/kg酪蛋白。RP-HPLC分析结果进一步证实SDS-PAGE分析结论:在TGase催化作用下,壳寡糖和酪蛋白共价结合,生成壳寡糖糖基化酪蛋白,该修饰产物是一种糖蛋白。
2.3 糖基化修饰反应对酪蛋白的体外消化性的影响
2.3.1 胃蛋白酶水解
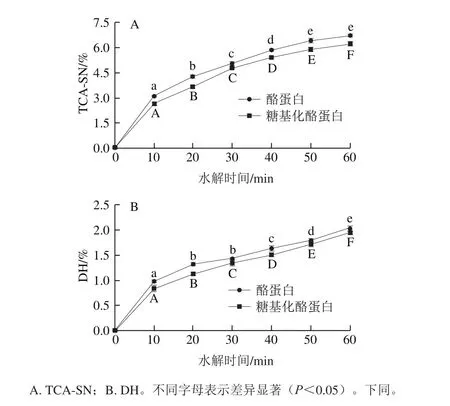
图3 酪蛋白及糖基化酪蛋白的胃蛋白酶水解曲线Fig. 3 TCA-SN and degree of hydrolysis of native and glycosylated casein via pepsin
由图3可知,随着水解时间的延长,糖基化酪蛋白和酪蛋白的水解程度逐渐上升,糖基化酪蛋白的胃蛋白酶消化能力低于酪蛋白。经胃蛋白酶水解60 min后,酪蛋白和糖基化酪蛋白的TCA-SN分别提高了6.73%和6.22%;当以DH为评价指标时,酪蛋白和糖基化酪蛋白的DH分别增加2.02%和1.93%。DH和TCA-SN分析结果均表明,糖基化酪蛋白的胃蛋白酶水解能力低于酪蛋白。
TGase途径糖基化修饰反应中,TGase在催化蛋白质和氨基糖共价结合的同时,还能够催化蛋白质发生分子内和分子间的交联反应,形成ε-γ-谷氨酰基-赖氨酸异肽键。新形成的异肽键降低了肽链的柔性,使蛋白质分子结构更加的致密,疏水性氨基酸的数量减少,暴露程度降低,导致胃蛋白酶消化能力下降[25]。与此同时,糖基化反应所引入的糖基又会使得蛋白质亲水性增加,分子结构部分伸展,这有利于蛋白质水解[26]。本研究中,在两种因素的共同作用下,糖基化酪蛋白的胃蛋白酶消化能力稍低于酪蛋白。
2.3.2 胰蛋白酶进一步水解
利用胰蛋白酶对糖基化酪蛋白的胃蛋白酶水解物进一步水解,结果如图4所示,两种水解物的DH随时间的延长持续增加,反应前15 min DH增加较快,随后反应速度放缓。经胰蛋白酶水解后,酪蛋白胃蛋白酶消化物的TCA-SN(图4A)从6.73%增加到41.88%,糖基化酪蛋白胃蛋白酶消化物的TCA-SN从6.22%增加到38.74%;以DH为评价指标(图4B),在120 min的水解时间内,酪蛋白胃蛋白酶消化物的DH从2.02%增加到14.57%,糖基化酪蛋白胃蛋白酶消化物的DH从1.93%增加到13.76%。这些结果表明,胰蛋白酶对两种蛋白质的水解作用效果强于胃蛋白酶;糖基化酪蛋白胃蛋白酶消化物的胰蛋白酶消化性低于酪蛋白的胃蛋白酶消化物。
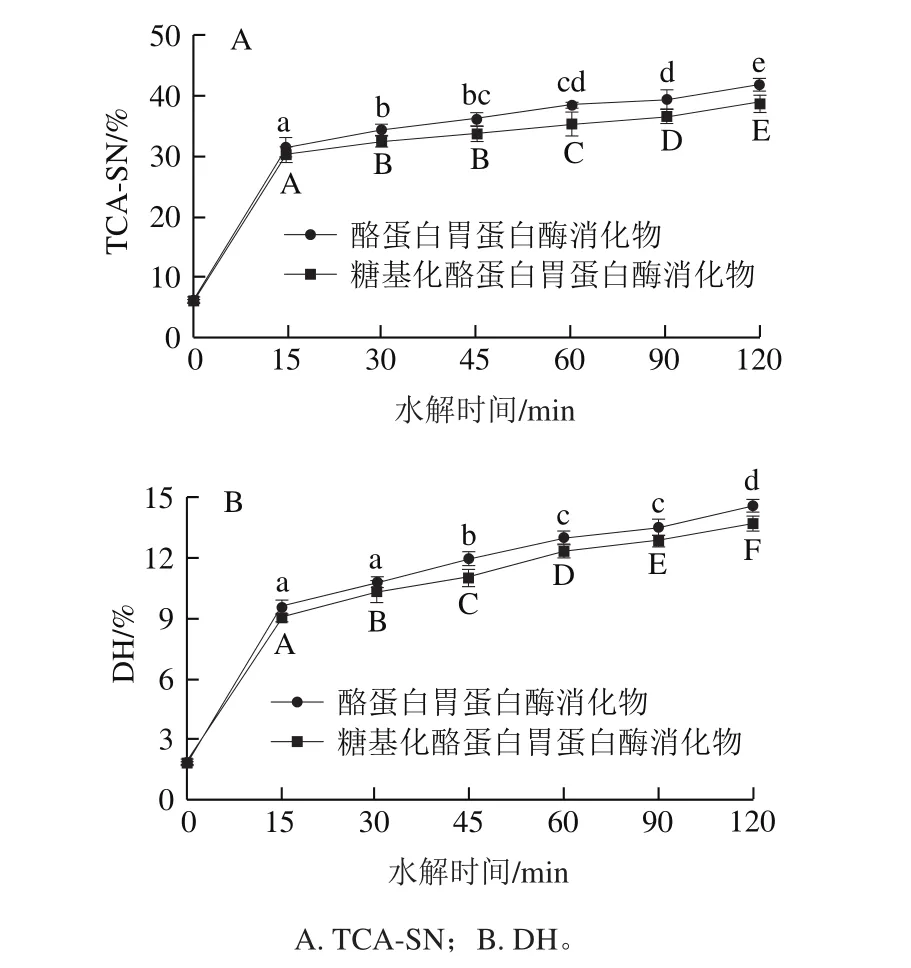
图4 酪蛋白及糖基化酪蛋白的胰蛋白酶水解曲线Fig. 4 TCA-SN and degree of hydrolysis of glycosylated and native casein via typsin
在TGase途径糖基化修饰反应中,赖氨酸残基参与分子内和分子间交联,新形成的异肽键中赖氨酸残基的分子构象发生改变,无法被胰蛋白酶识别;此外,交联反应形成的大分子聚合物使蛋白质分子结构更加密,进一步降低了胰蛋白酶的作用效果[27]。而糖基的导入会使被修饰产物的亲水性增加,蛋白质结构松散,有利于胰蛋白酶作用,付淼[28]发现壳寡糖的导入量(占蛋白质含量)为12.8 g/kg时,糖基化大豆分离蛋白的体外消化能力尚低于大豆分离蛋白,而当壳寡糖的导入量增加到30.8 g/kg时,修饰产物的体外消化能力高于大豆分离蛋白。
2.4 水解动力学模型的建立
糖基化酪蛋白经胃蛋白酶水解后水解程度太低(60 min后DH仍小于2%),且实验误差较大,故本研究仅分析了胰蛋白酶对糖基化酪蛋白胃蛋白酶水解物的水解动力学曲线,并建立该过程的水解动力学模型。
2.4.1 水解动力学模型建立
根据前人的研究结果[29],水解酶限制性水解蛋白质符合如下模型:
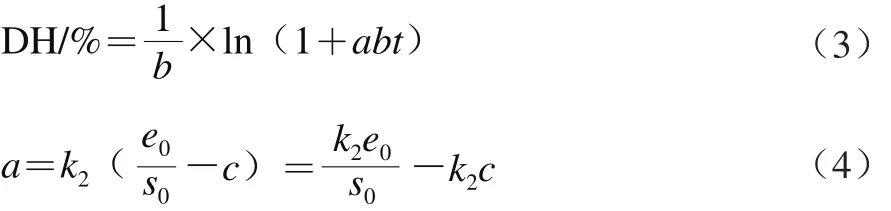
式中:a、b为DH动力学常数;k2为反应速率常数;e0、s0分别为初始酶质量浓度/(g/L)和初始底物质量浓度/(g/L);c为常数。
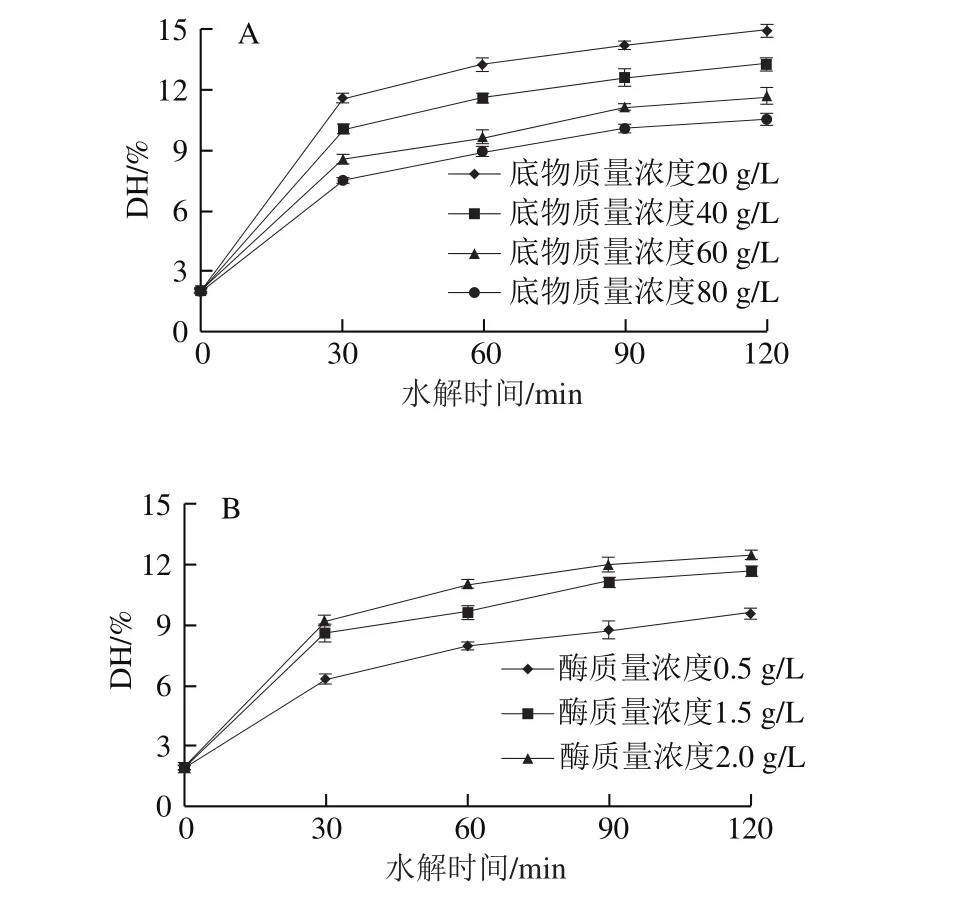
图5 初始底物质量浓度(A)及初始酶质量浓度(B)对DH的影响Fig. 5 Effect of initial enzyme (A) and substrate concentrations (B) on degree of hydrolysis
根据图5结果,利用1stOpt软件非线性回归拟合动力学参数a、b的值。由表1可知,动力学参数a随着初始底物质量浓度(s0)的增加而减小,随着蛋白酶初始质量浓度(e0)的增加而增大,而动力学参数b接近一个常数,本实验中b值取平均数0.42。
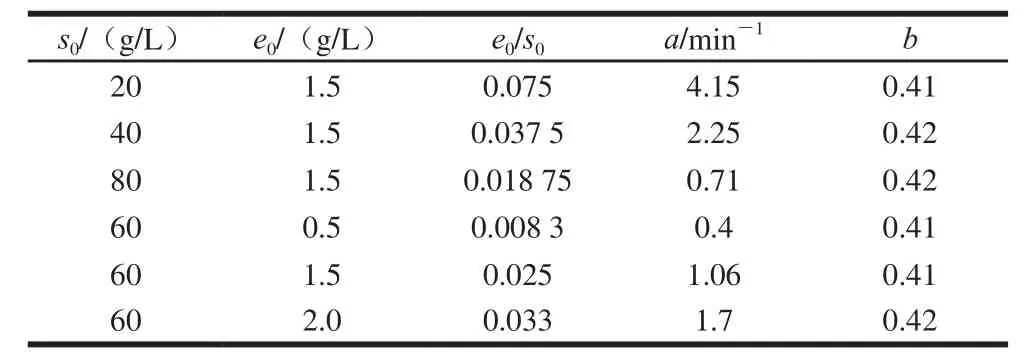
表1 不同水解条件下非线性回归拟合动力学参数Table 1 Estimated parameters using non-linear regression under different hydrolysis conditions
根据式(2)可知,在恒温水解反应过程中,a值与e0/s0呈线性关系。由图6可得:

结合式(3)计算得出:k2=58.794,c=3.73×10-3,即在胰蛋白酶水解糖基化酪蛋白胃蛋白酶水解物的反应速率常数k2为58.79 min-1。将动力学参数代入式(3)的方程,则该反应的水解动力学模型为:

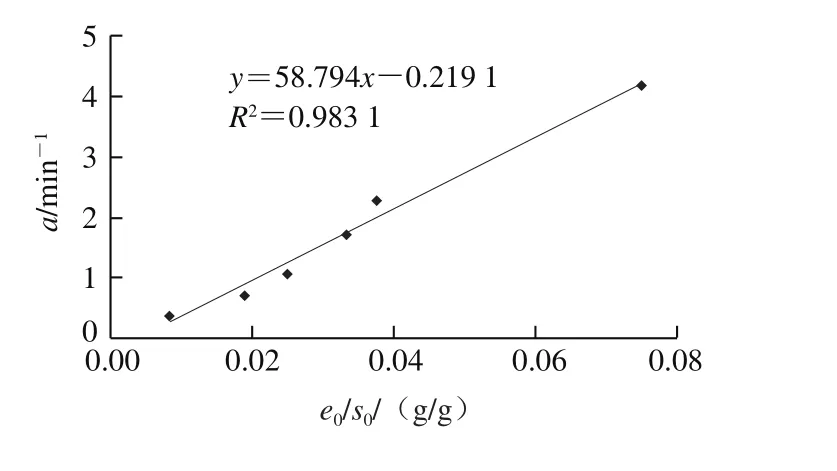
图6 动力学参数a随e0/s0的变化趋势Fig. 6 Variation in kinetic parameter a at different e0/s0 levels
从式(6)可以看出,糖基化酪蛋白胃蛋白酶消化物的DH随着反应时间的延长而增加,初始蛋白酶浓度的增加会增加水解程度,而初始底物浓度的增加则会导致其DH的降低。
2.4.2 水解动力学模型验证
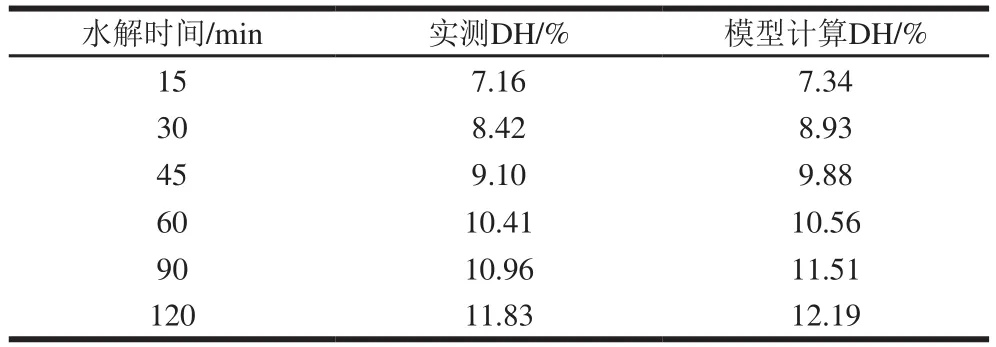
表2 水解动力学模型的验证Table 2 Validation of tryptic hydrolysis of the peptic digest of glycosylated casein
利用动力学模型计算出的数据与实际水解测量结果进行对比,可以验证模型的适用性。将图5B中实际检测的胰蛋白酶水解数据(扣除胃蛋白酶水解产生的DH),和水解动力学方程(3)~(6)计算出的结果相比对(表2),实测值和模型计算DH的平均相对误差为4.4%,动力学模型计算结果与实测DH结果吻合度较好。因此,该动力学模型可以用来评价糖基化酪蛋白胃蛋白酶消化物的胰蛋白酶的水解过程。
2.5 糖基化酪蛋白消化物的肽分子质量分布
本研究利用凝胶过滤色谱(Sephadex G-25)对糖基化酪蛋白及酪蛋白消化物中的肽分子质量分布情况进行了初步分析。结合标准分子质量物质的出峰时间,两种消化物的肽分子质量分布情况如表3所示,糖基化酪蛋白消化物含有较多的大分子物质(≥612.6 Da)。TGase对蛋白质进行糖基化修饰的同时,也催化蛋白质发生分子内和分子间交联反应,生成大分子的聚合物,以及糖与蛋白质的交联产物[30]。交联反应改变了蛋白质的结构,影响了消化酶的识别位点,修饰产物的消化性降低,体外模拟消化后形成了较大分子质量的肽段。其他研究也有类似结论,Romano等[31]发现在TGase作用下,白豆粉蛋白质交联生成新的异肽键,所形成的大分子聚合物结构更加致密,体外消化性降低,消化产物中大分子质量物质的含量明显高于对照物。

表3 酪蛋白及糖基化酪蛋白消化物的肽分子质量分布Table 3 Molecular mass distribution of the digests of native and glycosylated casein
3 结 论
本实验通过SDS-PAGE和RP-HPLC分析,证实TGase能够催化酪蛋白和壳寡糖发生糖基化交联修饰反应,修饰产物为糖基化酪蛋白;体外模拟消化结果表明,糖基化修饰反应对酪蛋白的消化性产生了一定不利影响;糖基化酪蛋白水解物中更多大分子质量肽段的存在,进一步证实了糖基化修饰反应对酪蛋白消化性的抑制作用。本研究可为TGase途径蛋白质糖基化修饰技术的工业化应用提供理论支持和技术参考。
