蛹虫草培养基多糖的提取及抗肿瘤活性研究
2019-10-29包建忠陈秀兰
孙 叶 ,包建忠 ,刘 红 ,马 辉 ,张 甜 ,陈秀兰 *
(1.江苏里下河地区农业科学研究所 ,江苏 扬州225007;2.扬州大学 动物科学技术学院,江苏 扬州 225009;3.扬州循天岭生物科技有限公司,江苏 扬州 225007)
蛹虫草(Cordyceps militarisL Link),俗称北冬虫夏草,是虫草属的模式种。蛹虫草子实体采收后的培养基富含菌丝体和子实体残留以及其他代谢物质[1],可作为原料直接用于酿造食品[2]、饲料[3-4]、肥料等开发;二次发酵可生产杀虫真菌制剂等产品;蛹虫草培养基的综合利用能变废为宝,为企业增加效益。目前蛹虫草培养基活性物质的提取分离[5-8]是研究的热点,蛹虫草大米培养基多糖提取方法有浸提法、热回流水提法、超声波提取、微波提取等,在此基础上,还发展了酶提等方法[9-12]。目前小麦培养基的生产规模在不断扩大,但小麦培养基多糖提取与开发的研究相对较少。
药用真菌多糖的抗肿瘤活性已被广泛认可[13-14],蛹虫草子实体或菌丝体提取物具有调节免疫系统,抗肿瘤,抗衰老,抗感染,降血糖、血脂,治疗艾滋病等作用[14-19],蛹虫草培养基多糖是否也有这些功效还有待研究。肝癌是现代社会恶性程度和发病率较高的恶性肿瘤,针对肝癌的药物、保健品开发十分重要。有研究证明蛹虫草水提物可通过线粒体途径抑制HepG2肝癌细胞和 MCF-7人乳腺癌细胞的生长[20],高纯度虫草素有直接抗HepG2肝癌细胞的作用[21-22],蛹虫草的其他活性物质对HepG2肝癌细胞是否也有相同作用值得研究探讨。MTT法被公认为是抗肿瘤药物大规模粗筛的有效方法,用MTT法研究蛹虫草多糖抗肿瘤效果已有一定进展[23-25]。本实验首次以蛹虫草小麦培养机为原料,通过热回流水提法正交试验确定多糖的最佳提取工艺,并利用MTT法研究不同提纯处理的培养基多糖对肝癌细胞的抑制作用,并与蛹虫草子实体多糖进行比较,研究结果对蛹虫草小麦培养基多糖的开发利用有一定的参考价值。
1 材料与方法
1.1 材料与仪器
1.1.1 材料 蛹虫草培养基由扬州循天岭生物科技有限公司提供。试验用细胞株:HepG2肝癌细胞(上海中科院)。
无水乙醇、氯仿、正丁醇等均为国药分析纯,胎牛血清、DMEM高糖细胞培养基及0.05%胰酶细胞消化液购自Gibco公司,青霉素链霉素混合液及四甲基偶氮唑蓝(MTT)购自Sigma公司,顺铂冻干粉每支10 mg购自上海源叶生物技术有限公司,二甲基亚砜(DMSO)购自AMRESCO公司。
1.1.2 设备 TGL-16M低温高速离心机,上海沪湘仪公司产品;RE-201D旋转蒸发器,郑州特尔仪器设备有限公司产品;CU600型电热恒温水箱,上海越平科学仪器有限公司产品;电热恒温鼓风干燥箱,上海一恒科技有限公司产品;BS124S电子天平,赛多利斯科学仪器北京有限公司产品;SOW-25DI冷冻高速微粉机,山东三清不锈钢设备有限公司产品;Ps-250万能破碎机,南京威利朗食品机械有限公司产品;RY-NSG-20LC超声波提取浓缩机,海锐元机械设备有限公司产品;Thermo Multiskan Go全波长酶标仪,赛默飞世尔科技公司产品;Telstar Lyoquest-55冻干机,西班牙泰事达公司产品;LKTC-B1-T水浴恒温振荡器,常州国华电器有限公司产品。
1.2 方法
1.2.1 小麦培养基的获得 小麦、蚕蛹粉和营养液(葡萄糖15 g,蛋白胨10 g,磷酸二氢钾1 g,硫酸镁1 g,VB1 1 mg,加水定容至法/三级 mL,pH值自然),按质量比(25∶2∶50)加入玻璃瓶中,封口,高温高压121℃灭菌60 min,放凉备用。培养基无菌环境下接蛹虫草菌种B6,培养子实体,子实体采收后,培养基烘干至含水质量分数小于10%后,密封保存备用。
1.2.2 水热回流提取法提取蛹虫草粗多糖 取2 g一定目数蛹虫草培养基粉末,用蒸馏水热回流重复提取数次,合并滤液,用旋转蒸发仪进行减压浓缩至1 g∶10 mL,冷却后加入3倍量乙醇使其沉淀,离心后倾出上清液,沉淀加少量水溶解,加入2倍量乙醇使其沉淀,将最后沉淀物用蒸馏水溶解,并定容于50 mL容量瓶中,用苯酚硫酸法[26]测定蛹虫草多糖含量。单因素试验设计:①培养基物料大小的影响。固定提取温度为80℃,提取时间120 min,提取2次,料液比(1 g∶20 mL),物料大小设定为 20、40、60、80、100、200目,6个水平。②料液比影响。固定培养基目数为60目,提取温度为80℃,提取时间120 min,提取 2 次,料液比(g/mL)设定为 1∶10、1∶15、1∶20、1∶25,4个水平。③提取温度的影响。固定培养基目数为60目,提取时间120 min,提取2次,料液比设定为 1 g∶20 mL, 提取温度设为 60、80、100 ℃,3 个水平。④提取时间的影响。固定培养基目数为60目,提取温度为80℃,提取2次,料液比设定为1 g∶20 mL, 提取时间设定为 60、120、180 min,3 个水平。⑤提取次数的影响。固定培养基目数为60目,浸提温度为80℃,提取时间为120 min,料液比设定为 1 g∶20 mL,设定提取次数为 1、2、3 次,3 个水平。每水平3次重复。
1.2.3 超声波水提法提取蛹虫草粗多糖 取2 g蛹虫草二茬培养基粉末,室温20℃,用倍量体积蒸馏水于超声提取器中超声提取数次,合并滤液,用旋转蒸发仪进行减压浓缩至1∶10(g/mL),冷却后加入3倍量乙醇使其沉淀,离心后倾出上清液,沉淀加少量水溶解,加入2倍量乙醇使其沉淀,将最后沉淀物用蒸馏水溶解,并定容于50 mL容量瓶中,用苯酚硫酸法测定蛹虫草多糖含量。单因素试验设计:①料液比影响。固定培养基目数为60目,超声波时间为 60 min,浸提 2次,料液比(g/mL)设定为1∶10、1∶15、1∶20、1∶25,4 个水平。②超声波时间的影响。固定培养基目数为60目,超声波提取2次,料液比设定为 1 g∶20 mL,超声波时间为 30、60、90 min,3个水平。③提取次数的影响。固定培养基目数为60目,超声波时间为60 min,料液比设定为1 g∶20 mL,设定提取次数为 1、2、3 次,3 个水平。每水平3次重复。
1.2.4 不同乙醇体积分数对粗多糖得率的影响利用热回流水提法单因素试验获得的最佳工艺提取粗多糖浓缩液,设定醇沉体积分数为50%、60%、70%、80%、90%,5个水平3次重复,沉淀过夜,4000 r/min常温离心,倾出上清液,冷冻干燥,获得粗多糖质量,计算粗多糖得率。
1.2.5 热回流水提法提取蛹虫草培养基粗多糖正交试验设计 在单因素试验的基础上,利用L9(34)正交试验设计方案优化水热回流提取法提取蛹虫草二茬草培养基多糖最佳工艺参数,因素水平设计见表1。

表1 正交试验因素水平表Table1 Factors and levels in orthogonal design
1.2.6 蛹虫草培养基去脂去蛋白质多糖A和去脂粗多糖B、水提醇沉粗多糖C的获得 称量60目的蛹虫草培养基5 g,3次重复,1 g∶10 mL乙醇去脂处理,离心去乙醇后40℃烘干,料液比1 g∶25 mL,100℃热回流提取3次、提取时间90 min、体积分数80%乙醇、醇沉,离心倾出上清液,沉淀溶于少量蒸馏水,加2倍体积乙醇,醇沉离心,重复1次,沉淀用无水乙醇、丙酮、乙醚各清洗1次,获得沉淀一半冷冻干燥获得去脂粗多糖B;一半溶于少量蒸馏水,saverage(氯仿∶正丁醇=4∶1,体积比)去蛋白质 5 次,加3倍无水乙醇,离心,沉淀冷冻干燥,获得去脂去蛋白质多糖A。
称量60目培养基5 g,3次重复,料液比1 g∶25 mL,100℃热回流提取3次、提取时间90 min、体积分数80%乙醇、醇沉,离心倾出上清液,沉淀溶于少量蒸馏水,加2倍体积乙醇,醇沉离心,重复1次,沉淀用无水乙醇、丙酮、乙醚各清洗1次,沉淀干燥获得水提醇沉粗多糖C。
1.2.7 蛹虫草子实体不同处理获得提纯多糖 称量蛹虫草B6菌种培养的100目子实体粉5 g,3次重复,质量比1∶10乙醇去脂去脂处理,离心去乙醇后 40 ℃烘干,料液比 1 g∶25 mL,60、80、100 ℃热回流提取3次、提取时间90 min、体积分数80%乙醇、醇沉,离心倾出上清液,沉淀溶于少量蒸馏水,加2倍体积乙醇,醇沉离心,重复1次,沉淀用无水乙醇、丙酮、乙醚各清洗 1 次,saverage(氯仿∶正丁醇=4∶1,体积比)去蛋白质5次,加3倍无水乙醇,离心,沉淀用无水乙醇、丙酮、乙醚各清洗1次,沉淀冷冻干燥获得去脂去蛋白质多糖D、E、F。
采用菌种B6培养的100目蛹虫草子实体粉5 g,3次重复,料液比1 g∶25 mL,80℃热回流提取3次、提取时间90 min、体积分数80%乙醇醇沉,离心倾出上清液,沉淀溶于少量蒸馏水,加2倍体积乙醇,醇沉离心,重复1次,沉淀用无水乙醇、丙酮、乙醚各清洗1次,沉淀干燥获得子实体水提醇沉粗多糖G。
1.2.8 MTT比色法测定提取多糖抗肿瘤活性 配置加体积分数10%牛血清的DMEM培养基,培养肝癌Hepg2细胞至对数生长期,用体积分数0.05%胰酶消化,加含体积分数10%牛血清的DMEM培养液吹打成细胞悬液,调整细胞浓度至1.0×104每孔后,接种于96孔板中,每孔接种200 μL细胞悬液,37℃,体积分数5%CO2培养箱中孵育24 h后,弃培养液,给药组分别加入200 μL质量浓度分别为0.25、0.5、1、2.5、5 mg/mL 的药物 A、B、C、D、E、F、G, 对照组则加入等体积的完全培养基,阳性对照加质量浓度为20 μg/mL顺伯,每组设6个复孔,置于37℃、5%CO2条件下培养 24、48、72 h。每孔加入 10 μL浓度为5 mg/mL MTT试剂培养4 h。小心弃去上清液,每孔加入 100 μL DMSO,振荡 10 min,再用酶标仪测定OD492,由测得的吸光度计算抑制率。

式(1)中,I为抑制率;OD0为对照组 OD 值;OD1为给药组OD值。
1.2.9 数据处理 试验数据用统计学方法进行处理,单因素、二因素方差分析、正交试验结果的极差分析、方差分析、图表制图采用SPSS 19.0、Excel软件制作分析。
2 结果与分析
2.1 粗多糖提取单因素试验
2.1.1 物料颗粒大小、提取温度对热回流水提法提取粗多糖含量的影响 由表2可知,采用热回流水提法提取蛹虫草培养基粗多糖,物料大小从20~60目,粗多糖质量分数增加明显,差异显著;60~100目后粗多糖含量趋于平稳,无显著差异,200目粗多糖质量分数明显降低。
粗多糖质量分数随着提取温度提高而增加,提取温度80℃时粗多糖质量分数较提取温度60℃时有明显提高且差异显著,但较提取温度100℃时粗多糖质量分数无显著差异。
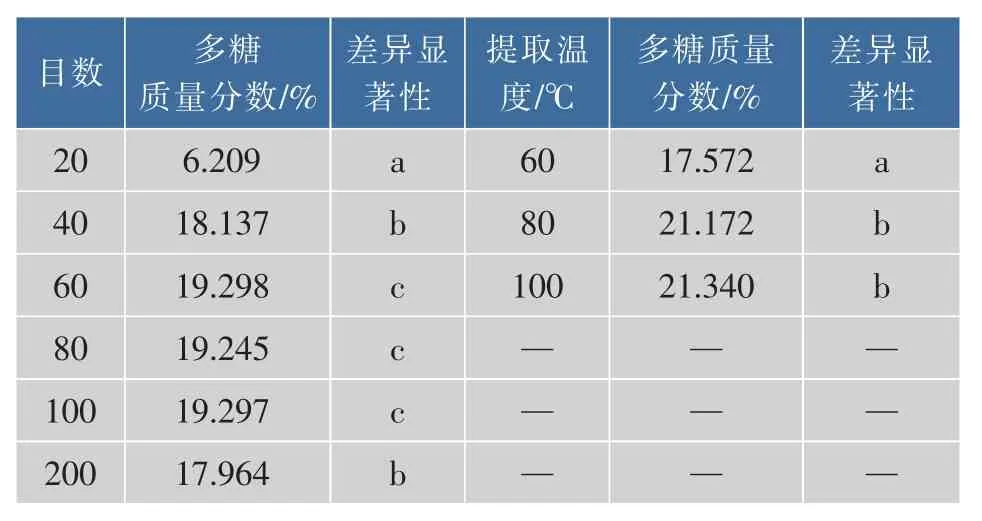
表2 物料大小、提取温度对粗多糖质量分数影响Table2 Effect of diameter of materials and extraction temperature on the content of coarse polysaccharide
2.1.2 时间对热回流水提法和超声波水提法提取粗多糖含量的影响 由表3可知,物料大小60目、提取温度为80℃、提取2次、料液比1 g∶20 mL、热回流提取法的提取时间为120 min时粗多糖得率最高,较提取时间为60 min和180 min,有显著差异。
物料大小60目、提取2次时、料液比1 g∶20 mL,室温超声波水提法提取时间30 min粗多糖质量分数较高,与提取时间60 min处理有显著差异,与提取时间90 min处理无显著差异。在料液比、物料大小、提取时间同为60 min时,热回流水提法提取粗多糖质量分数明显高于超声波水提法。

表3 提取时间对粗多糖质量分数影响Table3 Effect of extraction time on the content of coarse polysaccharide
2.1.3 料液比对热回流水提和超声波水提粗多糖质量分数的影响 由表4可知,热回流水提法,提取时间为120 min、物料大小60目、提取温度为80℃、提取2次,料液比为1 g∶20 mL时粗多糖质量分数最高,较料液比1 g∶10 mL 和 1 g∶15 mL 有显著差异;与料液比为1 g∶25 mL时粗多糖质量分数无显著差异。
超声波水提法,提取时间30 min、物料大小60目、室温提取2次,料液比为1 g∶25 mL时粗多糖质量分数最高,较其他处理差异显著。
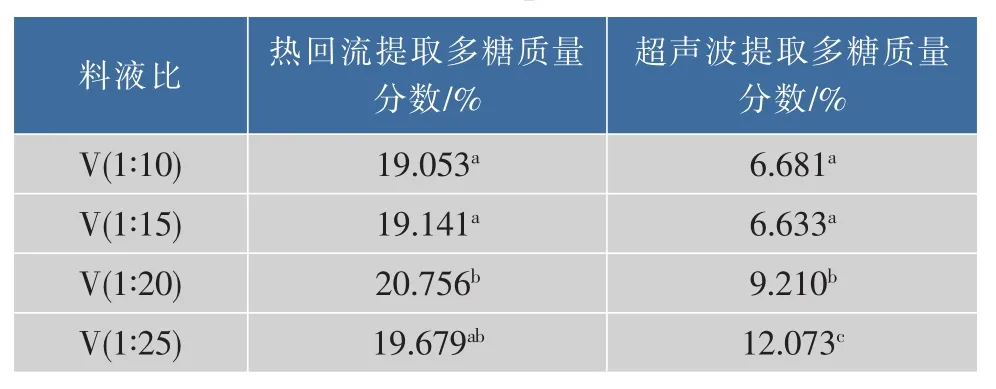
表4 料液比对粗多糖质量分数影响Table4 Effect of ratio of materialto solvent raw(w/v) on the content of coarse polysaccharide
2.1.4 热回流水提和超声波水提提取次数对粗多糖质量分数的影响 由表5可知,在料液比1 g∶20 mL、物料大小60目,提取温度为80℃、提取时间120 min,热回流提取3次时粗多糖质量分数较高,较提取2次处理无显著差异,与提取1次处理有显著差异。
在料液比1 g∶20 mL、物料大小60目、提取时间30 min时,室温超声波提取3次时粗多糖质量分数最高,较提取1次和提取2次粗多糖质量分数有显著差异。

表5 提取次数对粗多糖质量分数影响Table5 Effect of extraction number on the content of coarse polysaccharide
2.1.5 乙醇浓度对热回流水提培养基粗多糖得率的影响 由表6可知,热回流法提取蛹虫草培养基多糖,醇沉浓度越高,粗多糖得率越高,醇沉体积分数60%~70%时,粗多糖得率无显著差异,醇沉体积分数90%时,粗多糖得率最高,达25.146%,与其他处理有显著差异。
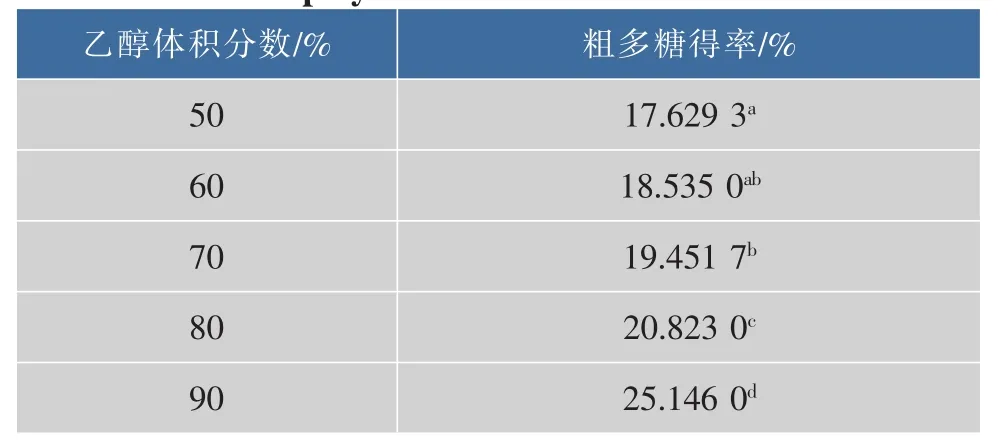
表6 醇沉浓度对粗多糖得率的影响Table6 Effect of extraction number on the content of coarse polysaccharide
2.2 正交试验优化提取工艺
由方差分析可知,影响提取多糖含量的因素中提取温度、提取次数、提取时间、料液比对提取蛹虫草二茬草培养基粗多糖的提取率具有显著的影响,4个因素的主次关系是:提取温度>提取时间>提取次数>料液比。通过邓肯多重比较和边际均值的直观图和经济成本的考虑,确定提取蛹虫草培养基粗多糖的最佳工艺为A3B2C1D3,即提取温度为100℃、提取3次、提取90 min、料液比1 g∶25 mL。该工艺为正交试验8号处理,多糖质量分数平均值为34.724 g/hg,为正交试验所有处理中最高,提取工艺优良得到了验证(表 7、8,图 1)。2015 年王雪等[10]利用超声波—酶法所得蛹虫草大米基质多糖的得率为30.27%,数据偏高是因为小麦培养基多糖组成复杂,既有菌丝体多糖、子实体多糖、小麦淀粉,也有虫草生长过程中转化的产生的多糖。已有除淀粉的相关研究[5],本研究认为培养基淀粉具有一定的营养价值,除淀粉工艺需要从产品安全性、营养价值和开发成本综合考虑。
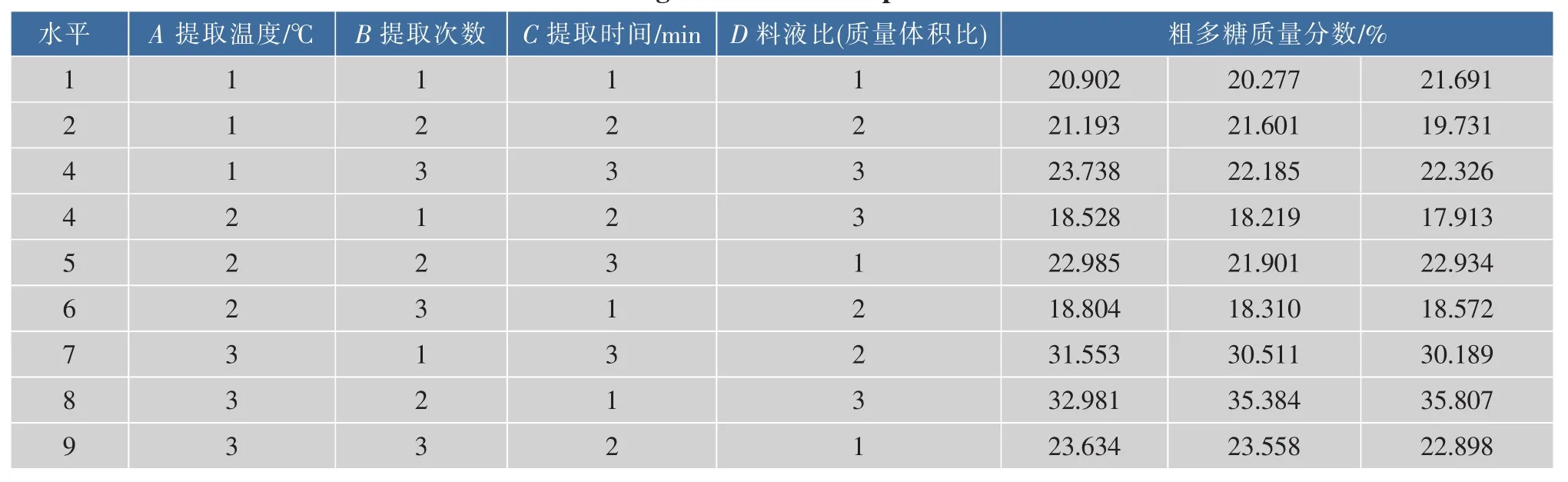
表7 正交表L9(34)及实验结果Table7 Orthogonal table and experimental results
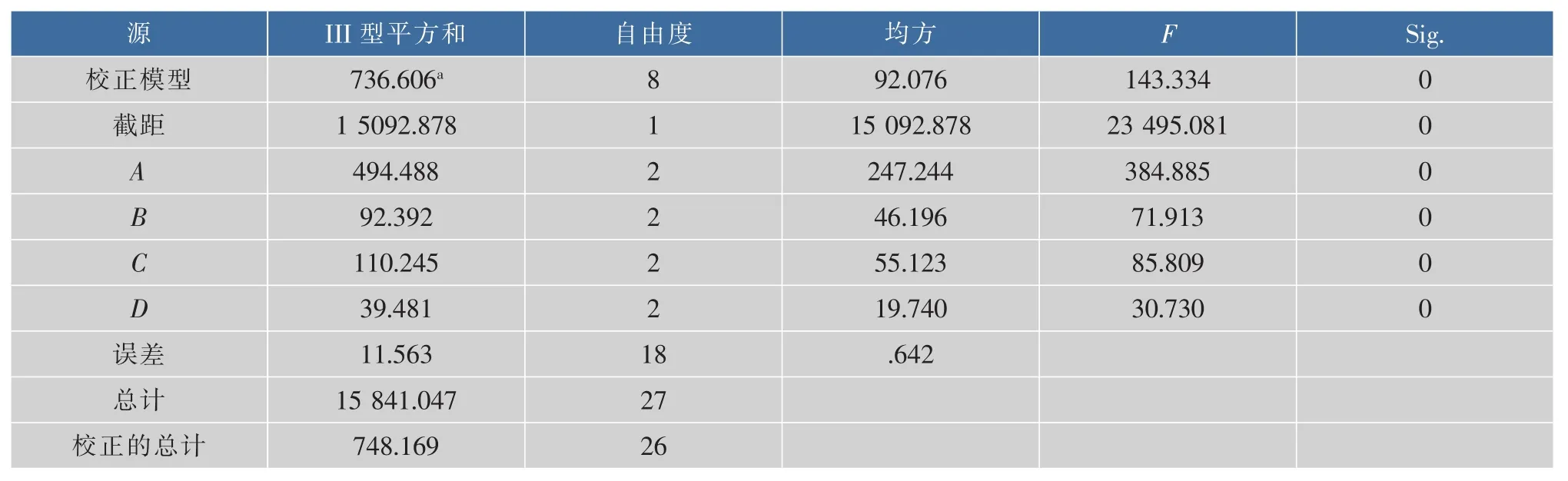
表8 正交试验结果方差分析Table8 Analysis of variance of orthogonal experiment
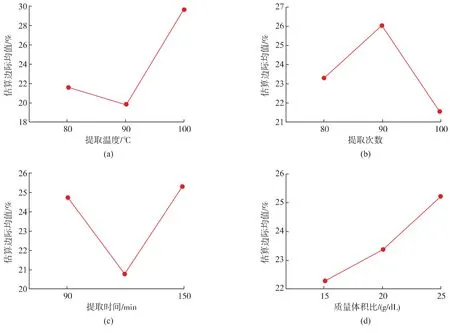
图1 不同处理的粗多糖质量分数的估算边际均值Fig.1 Mean estimate the marginal average about content of coarse Polysaccharide of different treatments
2.3 蛹虫草培养基提取多糖和子实体多糖对Hepg2肿瘤细胞的生长抑制作用
采用MTT法测定蛹虫草培养基、子实体多糖提取物对Hepg2肿瘤细胞的生长抑制作用,实验结果如图2、3所示。①药物质量浓度5 mg/mL时,所有药物对Hepg2肿瘤细胞的抑制率与培养时间呈正相关;培养72 h后,培养基脱脂脱蛋白多糖A的抑制率为83.02%,培养基脱脂多糖B的抑制率为75.388%,培养基粗多糖C的抑制率为30.612%;100℃热回流水提蛹虫草子实体脱脂脱蛋白质多糖F72 h培养后,对Hepg2细胞抑制率平均值达到92.974%,超过了对照SB对Hepg2细胞抑制率,80℃热回流水提蛹虫草子实体多糖G72 h培养后,对Hepg2细胞抑制率平均值为67.09%,子实体多糖对肝癌细胞的抑制率与水提温度呈正相关。②质量浓度为2.5~5 mg/mL,作用时间为72 h,多糖A对HepG2肝癌细胞的抑制率好于多糖B,而质量浓度为0.25~1 mg/mL的抑制率则相反,但绝对值较低。③药物质量浓度 2.5 mg/mL 时,D、E、F、G,在48、72 h培养后,对Hepg2细胞抑制率均为正效应;药物F、G,在48、72 h培养后,所有质量浓度对Hepg2细胞抑制率均为正效应。④药物质量浓度1~0.25 mg/mL 时,24 h 培养后 D、E、F、G 对 Hepg2 细胞抑制率均为负效应。⑤除D外,所有药物培养72 h后,对Hepg2细胞抑制率与浓度呈正相关。
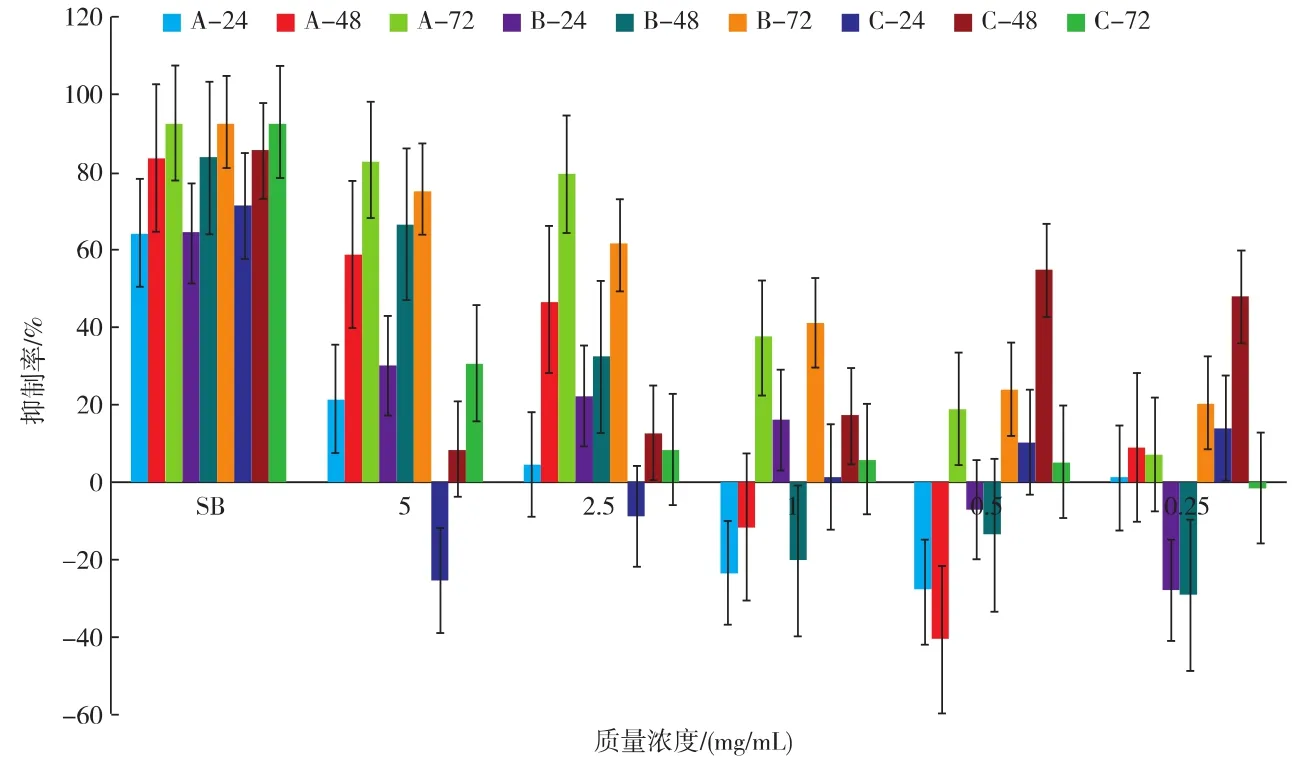
图2 蛹虫草培养基提取物及对照SB对Hepg2肿瘤细胞的平均抑制率Fig.2 Production of mean estimate the marginal about different treatments
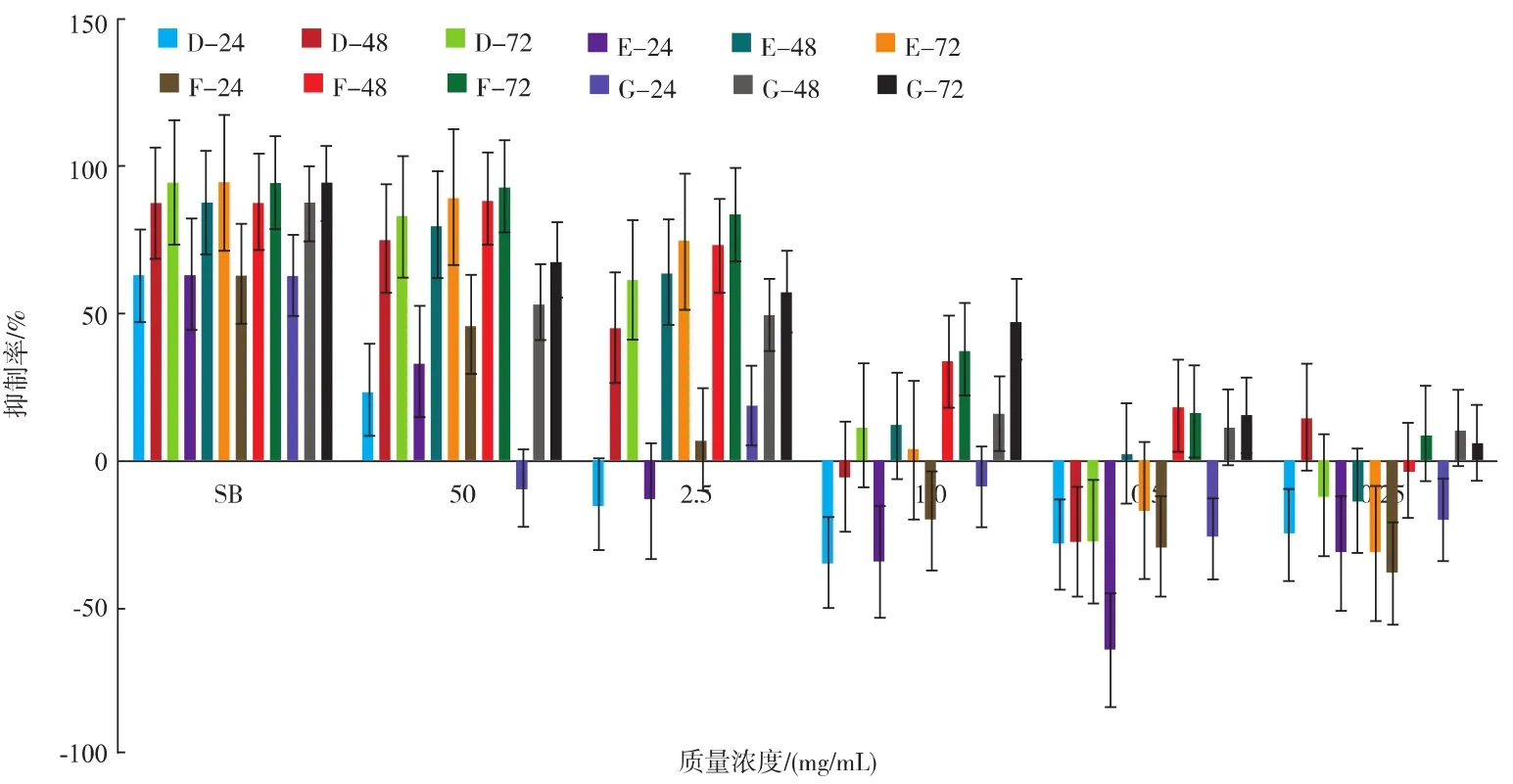
图3 蛹虫草子实体提取物及对照SB对Hepg2肿瘤细胞平均抑制Fig.3 Production of mean estimate the marginal about different treatments
由表9可知,培养72 h后,多糖A和F质量浓度为5、2.5 mg/mL时,对Hepg2细胞抑制率差异显著,质量浓度为1~0.25 mg/mL时,对Hepg2细胞抑制率差异不显著;但多糖A和F各自不同质量浓度处理对Hepg2细胞抑制率差异显著,且抑制率与多糖质量浓度呈正相关。
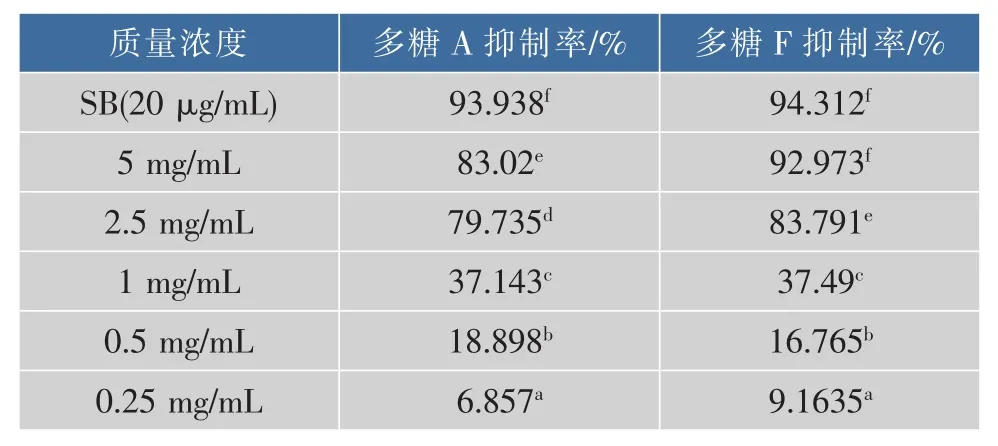
表9 培养72 h后多糖F和多糖A对Hepg2肿瘤细胞的平均抑制率Table9 Average inhibition rate of against HepG2 tumor cell of F and A polysaccharide A after 72 h training
蛹虫草子实体多糖抗肿瘤研究较多,效果也比较肯定。蛹虫草基质多糖研究证明蛹虫草基质多糖对酒精诱导的小鼠急性、亚急性肝损伤有明显的保护作用[27],抗肿瘤作用的相关研究尚少见报道。JING等[28]从蛹虫草分离出一种新的低分子多糖(CMP-1),作用于 HepG2肝癌细胞 48 h后,IC50值为0.1763 mg/mL。本试验多糖复合物 A、B、D、E、F、G在浓度小于1 mg/mL时,作用于HepG2肝癌细胞48 h后,抑制率均未超过50%,可以推测多糖成分的纯化,一定程度上有利于对肿瘤抑制率的提高。同时葛晓宇[29]发现纯化获得质量浓度为2 mg/mL的蛹虫草子实体酸性多糖(F2),培养48 h后,对HepG2肝癌细胞的抑制率达到27.9%。本试验质量浓度为2.5 mg/mL培养基脱脂脱蛋白质多糖(A),作用于HepG2肝癌细胞48 h,制率达73.238%,培养72 h后抑制率达79.735%,培养基提纯多糖表现出较高的抑制率。
3 结语
多糖的提取、分离和纯化是相对复杂的工艺,多糖纯度越高,提取成本越高。自然提取多糖产品开发需要综合考虑开发产品的功效、成本和安全,本试验旨在为最大限度提高产品的性价比提供一定的参考。本研究对蛹虫草小麦培养基通过热回流水提取法、超声波提取多糖单因素试验进行比较,得出热回流水提法提取多糖效果较优,这与以往研究结果[5-7]一致。本试验以蛹虫草小麦培养基为原料,通过热回流水提法正交试验结合提取成本优化粗多糖提取工艺。结果表明提取温度100℃、料液比1∶25、提取3次、每次提取时间90 min,为蛹虫草小麦培养基粗多糖最佳提取工艺。不同提纯处理后获得的培养基多糖通过MTT试验检测其对HepG2肝癌细胞抑制率,结果表明质量浓度为5 mg/mL、培养时间72 h时,培养基提纯多糖表现出较高的抑制率,培养基脱脂脱蛋白质多糖A对HepG2肝癌细胞抑制率>脱脂多糖B>未脱脂脱蛋白质粗多糖C;多糖抑制率与浓度和作用时间呈正相关,在一定范围增加粗多糖的浓度和作用细胞时间,有利于对肿瘤细胞抑制率的提高。
