响应面法优化青春双歧杆菌增殖培养基
2019-10-29朱蒙蒙李国莹顾秋亚余晓斌
朱蒙蒙 ,李国莹 ,顾秋亚 ,余晓斌 *
(1.江南大学 生物工程学院,江苏 无锡214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122)
双歧杆菌是动物消化道内具有益生作用的优势菌,促进消化和矿物质的吸收,维持肠道微生物平衡,改进免疫系统反应和提高对病原菌的抵抗力,降低癌症、肥胖、糖尿病等疾病的风险,调节血脂及血清胆固醇水平,治疗炎症、自身免疫反应、过敏,抗肿瘤,抗衰老等[1-3]。青春双歧杆菌(B.adolescentis)是青年个体肠道中的优势菌,婴儿出生2~3 d后青春双歧杆菌开始增殖,5 d后达到最高峰并占绝对优势,在肠道内菌群中占99%。但随着人的年龄增高,青春双歧杆菌在人体内逐渐减少,体弱多病的老人肠道内该菌几乎消失,而健康的人仍能保持一定的青春双歧杆菌在肠道内存在。这也反映出人体肠道内青春双歧杆菌的数量乃是检验人是否健康的一个指标[4]。由于双歧杆菌的严格厌氧,营养条件要求苛刻[5],生长缓慢,对酸性环境抵抗力差,很难保持较高的活菌数。据报道,双歧杆菌活菌数保持在106CFU/mL(或106CFU/g)以上才能有保健功效[6],因此选择增殖培养基是提高活菌数的重要手段之一。
目前提高双歧杆菌培养液活菌数主要通过改善培养基组分实现。如改变培养基原有成分添加量[7],或者培养基中添加增殖因子如低聚糖、氨基酸等[8-10],或者植物浸出液培养基中添加碳源、氮源等成分[11-13]。大量文献[14-17]采用正交试验对双歧杆菌培养基中碳源、氮源、无机盐、增殖因子等因素交互作用进行有限的优化,但这些方法的不足在于仅能比较各因素已选定水平的优劣,无法提供未考察区域的信息[8]。MEENA等[18]采用响应面优化培养条件、碳源、氮源含量等,混合培养双歧杆菌和嗜酸乳杆菌;ABDUL等[19]采用响应面优化培养基中脱脂奶粉、酵母膏、葡萄糖,提高B.pseudocatenulatumG4生物量等,更加精确地确定培养基组分。
本研究中以青春双歧杆菌为实验对象,MRS(Man Rogosa and Sharpe Medium)为基础培养基,由低聚果糖和葡萄糖的复配代替葡萄糖,正交试验优化复合氮源中胰蛋白胨、牛肉膏、酵母粉的含量,然后确定合适的碳氮总量和碳氮比,选择合适的缓冲盐浓度,最后用Box-Benhnken Design(BBD)试验优化培养成分,在提高活菌数的同时缩短培养时间,为双歧杆菌增殖培养奠定一定的理论与实验基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种 青春双歧杆菌(B.adolescentis)为本实验室保藏。
1.1.2 培养基 脱脂乳培养基:10 g/dL脱脂奶粉,1 g/dL葡萄糖;MRS培养基:胰蛋白胨10.0 g,牛肉膏 5.0 g,酵母粉 5.0 g,葡萄糖 20.0 g,K2HPO4·3H2O 2.0 g, 柠檬酸铵 2.0 g, 乙酸钠 5.0 g,MgSO4·7H2O 0.2 g, 吐温-801.0 mL,MnSO4·H2O 0.05 g,L-半胱氨酸盐酸盐0.5 g,蒸馏水1000 mL,pH 6.5,121℃灭菌20 min;固体培养基:MRS培养基+2 g/dL琼脂。
1.2 仪器与设备
超净工作台:苏州空气净化设备厂产品;鼓风干燥箱:上海实验仪器有限公司产品;紫外可见-分光光度计:上海尤尼柯仪器有限公司产品;PHS-3C酸度计:上海精科仪器有限公司产品;电子天平:常熟市百灵天平仪器有限公司产品;厌氧装置:日本三菱公司产品。
1.3 方法
1.3.1 菌种活化 将甘油管保藏的菌种涂布于固体培养,37℃厌氧培养36 h,用接种环挑取单菌落接种于脱脂奶粉培养基37℃厌氧培养36 h;以体积分数2%接种量,取上述菌液于新鲜MRS培养基,37℃厌氧培养24 h,活化2次后备用。
1.3.2 吸光度和pH测定 菌体密度(A600nm)由紫外-可见分光光度计测定,pH由PHS-3C酸度计测定。1.3.3 活菌计数 采用稀释涂布法,以10倍梯度稀释,选取适当稀释度均匀涂布于固体培养基,37℃厌氧培养48 h后,计数[20]。
1.3.4 培养基优化 先考察复配碳源(葡萄糖和低聚果糖质量比为 3∶1、2∶1、1∶1、1∶2、1∶3)、复配氮源组分、碳源总量(4、5、6 g/dL)与碳氮质量比(3∶1、2∶1、1∶1、1∶2、1∶3)、缓冲盐体系质量浓度(0、4.5、9.0、13.5、18.0 g/L)对青春双歧杆菌生长的影响,再通过Box-Benhnken试验设计和响应面分析确定最佳培养基组分,试验编码与水平见表1。
1.4 生长曲线的比较
经活化的菌种以体积分数5%的接种量分别接种于MRS和增殖培养基,37℃厌气培养,每隔4 h取样测得吸光度A600nm,以培养时间为横坐标,相应的A600nm为纵坐标,绘制生长曲线[15],同时测得培养基pH。

表1 试验编码与水平Table1 Factors and levels of central composite design(g/L)
2 结果与分析
2.1 各因素对青春双歧杆菌增殖的影响
2.1.1 碳源对青春双歧杆菌生长的影响 碳源是影响微生物生长和代谢的最主要的因素之一。乳酸菌代谢产物主要是有机酸,其主要的元素为碳。葡萄糖是双歧杆菌培养基中最主要的底物,低聚糖是一类双歧因子,能够促进双歧杆菌体外生长[21],两者复配作为最终碳源,对青春双歧杆菌具有增殖作用。由图1可以看出:当葡萄糖与低聚果糖质量之比为 1∶1 时活菌数最大,达到 6.3×108CFU/mL,MRS培养基中氮源碳源总量为2 g/dL,因此2种糖的添加质量浓度均为10 g/L。

图1 青春双歧杆菌在复配碳源中活菌数Fig.1 Viable count of B.adolescentis with compound carbon sources
2.1.2 氮源的正交优化 双歧杆菌的生长需要复杂的氮源底物,丰富的氮源对其生长有较大的影响[11]。由表 2 得极差值RA>RC>RB,即胰蛋白胨促进青春双歧杆菌生长能力最强,其次是酵母粉、牛肉膏,得到最优的氮源组合是A3B2C3,而由A600nm结果可知,培养基氮源组合8的菌体密度最高,即A3B2C1,因此需要作进一步的验证。
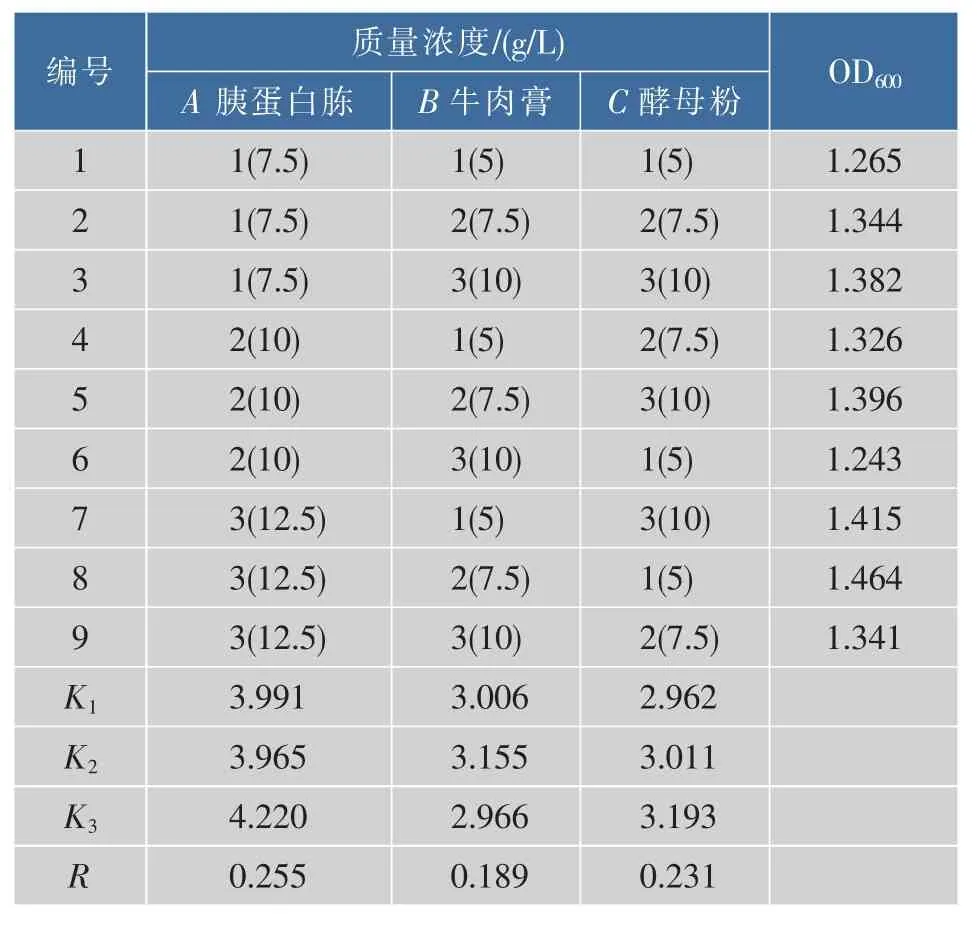
表 2 氮源 L9(34)正交试验Table2 Orthogonal test L9(34) of nitrogen source
经验证方案A3B2C3的A600nm为1.476,比组合8(A3B2C1)的试验结果高,所以确定最优的氮源组合是A3B2C3,即胰蛋白胨、牛肉膏和酵母粉的质量比为5∶3∶4,MRS 培养基中氮源质量浓度为 2 g/dL,因此三者的添加质量浓度分别是8.33、5.0、6.67 g/L。
2.1.3 碳氮总量与碳氮比对青春双歧杆菌生长的影响 碳氮总量和碳氮比会对微生物的生长产生不同的影响。从图2可以看到,当培养基中的碳氮总量为6 g/dL,碳氮质量比为1∶1时,青春双歧杆菌的菌体密度最大,因此确定碳氮质量浓度为6 g/dL,碳氮比为 1∶1。
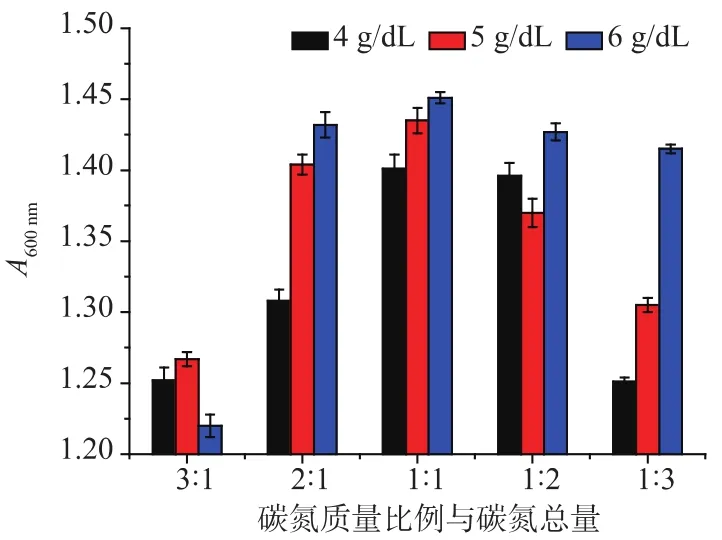
图2 不同碳氮总量和比例下的青春双歧杆菌菌体密度Fig.2 Density of B.adolescentis with different concentration and proportion of carbon and nitrogen sources
2.1.4 缓冲盐对青春双歧杆菌生长的影响 双歧杆菌代谢途径中采用果糖-6-磷酸途径进行己糖发酵,产生乙酸、乳酸和少量的甲酸[22],这些有机酸使得培养基pH值不断降低,对细胞本身形成酸胁迫,抑制菌体的生长。缓冲盐体系能够与酸性物质中和,对稳定pH和降低对菌体生长的抑制方面起着很大的作用。结果表明:随着缓冲盐质量浓度的增加,菌体密度越来越大随后保持不变,所以缓冲盐质量浓度选用13.5 g/L,即柠檬酸铵、K2HPO4·3H2O、乙酸钠分别为 3、3、7.5 g/L。

图3 不同缓冲盐质量浓度下的青春双歧杆菌菌体密度Fig.3 Density of B.adolescentis with different concentration buffer salt
2.2 响应面优化增殖培养基配方
2.2.1 响应面试验设计 综合上述试验结果,以碳源、氮源、缓冲盐为自变量,OD600为响应值,根据Box-Benhnken Design(BBD)试验设计原理,设计中心组合试验。试验方案及结果见表3。
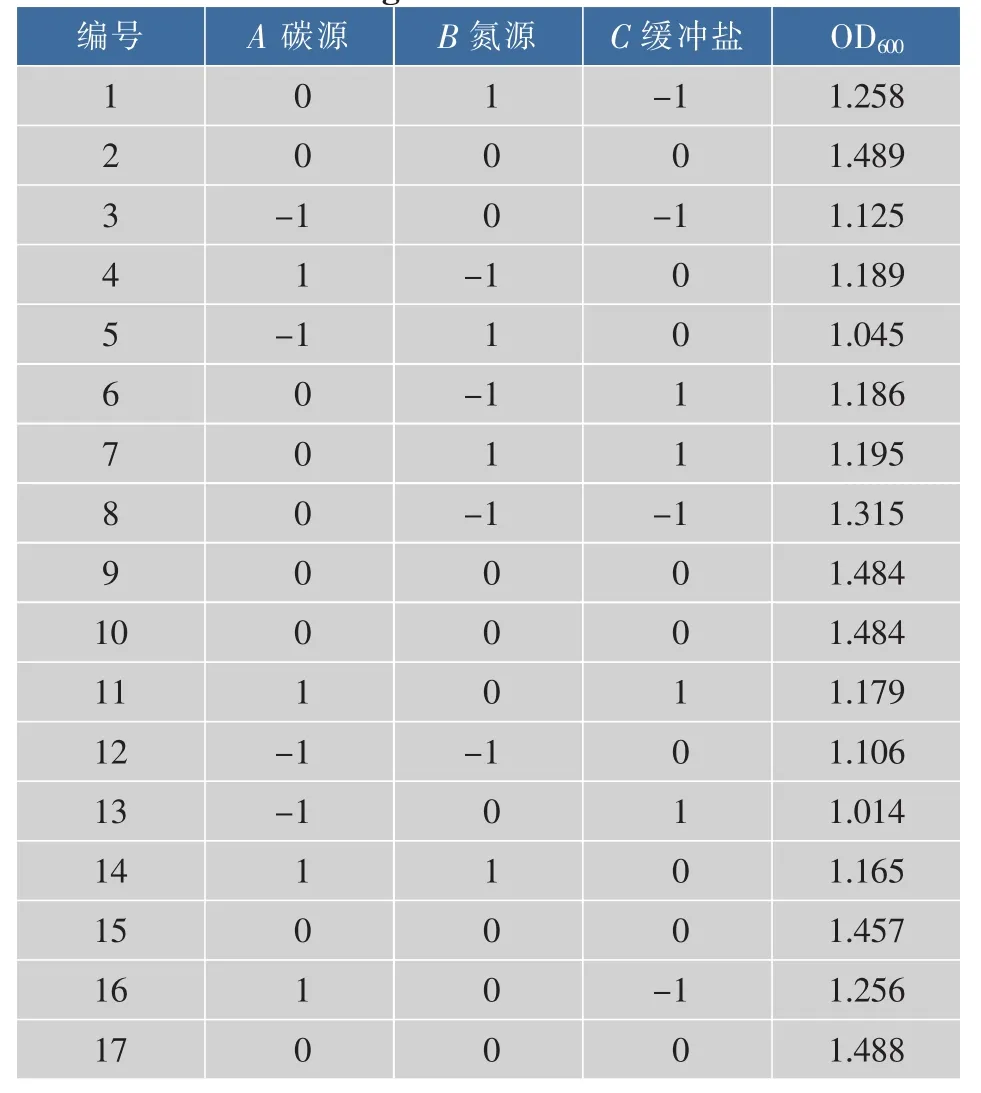
表3 Box-Benhnken试验设计与结果Table3 Test design and results of Box-Benhnken
利用Design Expert 8.06软件进对表3中数据进行多元二次回归拟合,得到青春双歧杆菌菌体密度(Y)与培养基中的碳源(A)、氮源(B)、缓冲盐(C)的多项回归方程为:Y=1.48+0.062A-0.017B-0.047C+0.009AB+0.008AC+0.017BC-0.22A2-0.13B2-0.11C2。
2.2.2 Box-Benhnken方差分析 通过表4方差分析可得,该模型极显著(P<0.001),失拟项P=0.2114不显著。模型确定系数R2=0.9954,矫正系数R2adj=0.9895,说明模型和试验设计相比拟合性比较高,很好地反应青春双歧杆菌菌体密度与培养基中碳源、氮源、缓冲盐的关系。模型中一次项A、C极显著,B显著;交互项AB、BC、BC均不显著;二次项A2、B2、C2均处于极显著水平。
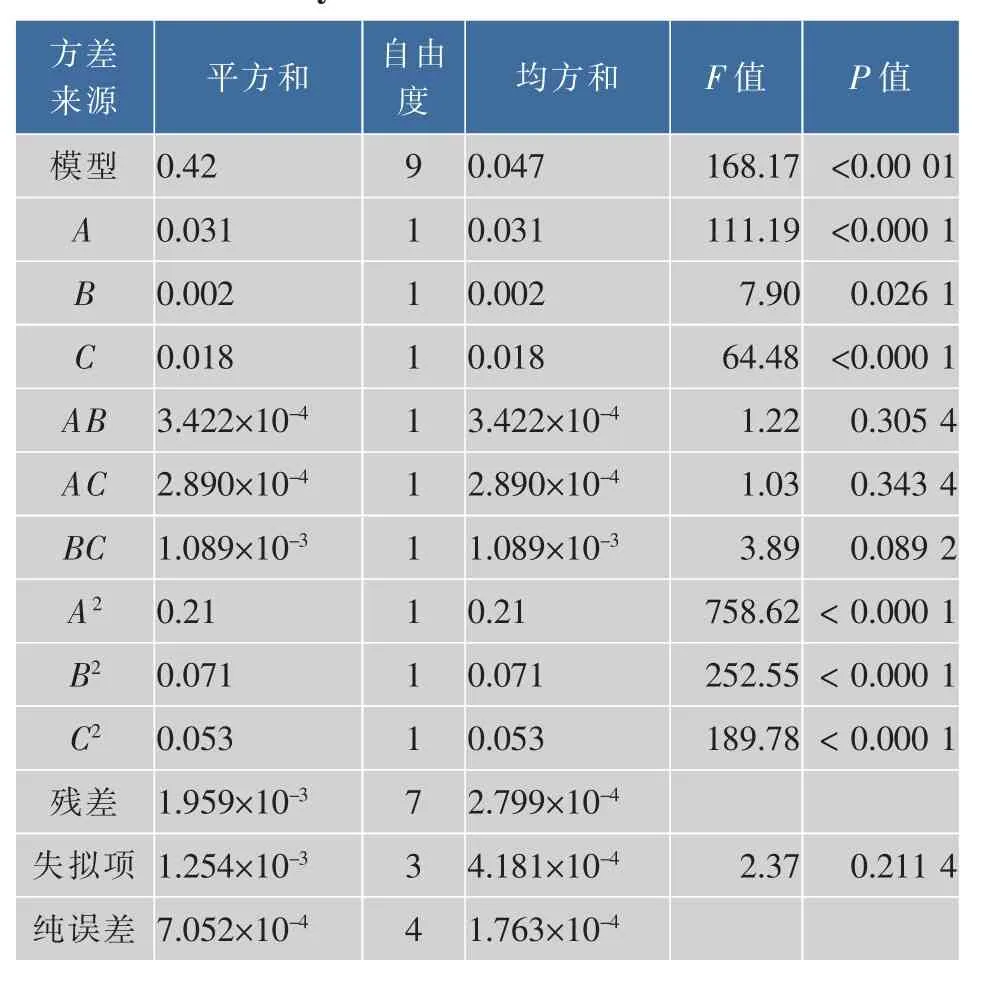
表4 Box-Benhnken方差分析Table4 Analysis of variance for Box-Benhnken
2.2.3 响应面分析 利用Design Expert 8.06绘制出响应面图及其等高线图(图4~6)。其中等高线的形状代表两两因素交互作用的强弱,圆形代表两因素间的交互作用弱,椭圆则反之;等高线密集表明对响应值影响较大,稀疏则表明影响较小。通过方程可得,二次项的系数均为负值,其所表征的抛物面开口向下,具有极大值点。经软件分析得到青春双歧杆菌增殖培养基的最佳培养基配方:葡萄糖15.85 g/L、低聚果糖15.85 g/L、胰蛋白胨12.04 g/L、牛肉膏7.23 g/L、酵母粉9.63 g/L、柠檬酸铵2.75 g/L、K2HPO4·3H2O 2.75 g/L、乙酸钠 6.875 g/L、吐温-80 1.0 mL、MgSO4·7H2O 0.2 g/L、MnSO4·H2O 0.05 g/L、L-半胱氨酸盐酸盐0.5 g/L。青春双歧杆菌在该培养基成分下进行5次平行试验,得到OD600的平均值为1.476,与预测值1.490拟合率达99.06%,优化模型合理可靠。
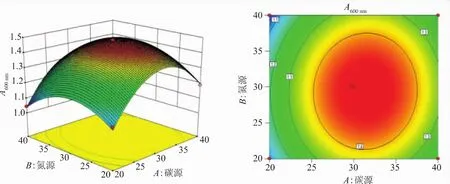
图4 碳源与氮源对青春双歧杆菌生长影响的响应面图和等高线Fig.4 Response surface and contour plots for the effect of carbon source and nitrogen source on the growth of B.adolescentis
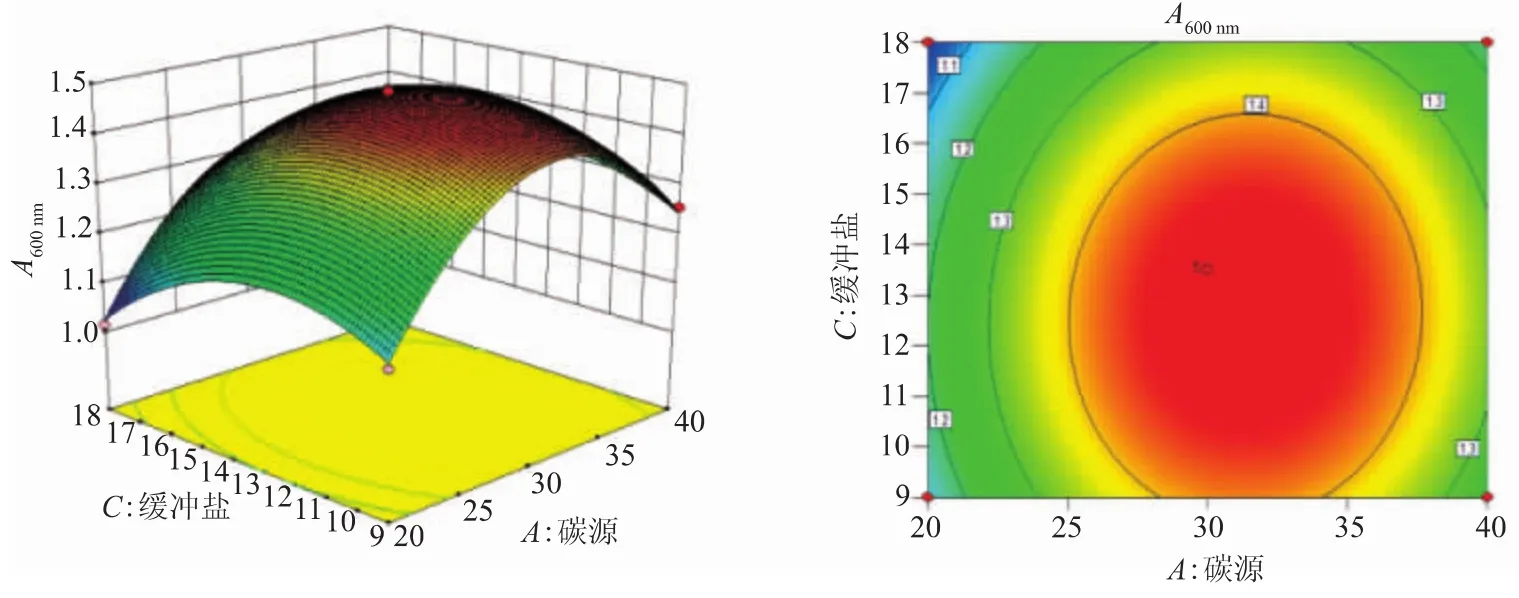
图5 碳源与缓冲盐对青春双歧杆菌生长影响的响应面图和等高线Fig.5 Response surface and contour plots for the effect of carbon source and buffered salt on the growth of B.adolescentis
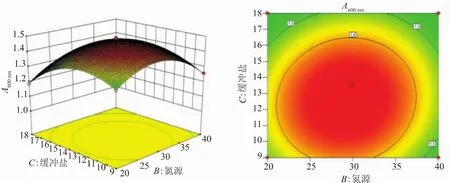
图6 氮源与缓冲盐对青春双歧杆菌生长影响的响应面图和等高线Fig.6 Response surface and contour plots for the effect of nitrogen source and buffered salt on the growth of B.adolescentis
2.3 青春双歧杆菌的生长曲线和pH的变化
从图7中可以看出,青春双歧杆菌在增殖培养基中没有明显的延滞期,28 h达到稳定期,比优化前缩短近12 h,此时活菌计数,培养基中活菌数达到8.9×109CFU/mL,是优化前的1.73倍;在对数期,微生物的代谢产生大量的有机酸使得pH快速降低,在28 h后基本趋于稳定,与优化前相比pH降低速度过快并没有对菌体生长造成抑制。

图7 青春双歧杆菌生长曲线和pH变化Fig.7 Growth curves and pH changes of B.adolescentis
3 结 语
利用响应面法对青春双歧杆菌增殖培养基进行优化,得到增殖培养基配方:葡萄糖15.85 g/L、低聚果糖15.85 g/L、胰蛋白胨12.04 g/L、牛肉膏7.23 g/L、酵母粉 9.63 g/L、柠檬酸铵 2.75 g/L、K2HPO4·3H2O 2.75 g/L、乙酸钠 6.875 g/L、吐温-801.0 mL、MgSO4·7H2O 0.2 g/L、MnSO4·H2O 0.05 g/L、L-半胱氨酸盐酸盐0.5 g/L。青春双歧杆菌在增殖培养基中28 h达到稳定期,比优化前缩短12 h,活菌数达到8.9×109CFU/mL,是优化前的1.73倍,在缩短培养时间的同时也提高了发酵液的活菌数。
