重组果聚糖蔗糖酶的发酵优化及应用
2019-10-29段绪果
唐 煜 ,陈 晟 ,段绪果 ,吴 敬 , 吴 丹 *
(1.食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122;2.江南大学,江苏 无锡 214122;3.江南大学工业生物技术教育部重点实验室,江苏 无锡214122)
果聚糖蔗糖酶是一种果糖基蔗糖转移酶,属于糖苷酶家族GH68。果聚糖蔗糖酶具有转糖基和水解活性,大部分果聚糖蔗糖酶具有广泛的受体专一性,在转糖基过程中是以蔗糖作为其优先选择的底物供体,以木糖、蔗糖、乳糖等为受体,催化来自于蔗糖的果糖残基到受体上从而生成木蔗糖、低聚乳果糖和低聚果糖等产物。由于低聚果糖、低聚乳果糖等低聚糖对人体健康有益[1],因此,果糖基转移酶的生产越来越受到人们的关注。目前已经发现多种细菌可以产果聚糖蔗糖酶,如丁香假单胞杆菌(Pseudomonassyringae)[2]、多黏芽孢杆菌(Bacillus polymyxa)[3]、枯草芽孢杆菌(Bacillus subtilis)[4]、运动发酵单胞菌(Zymomonasmobilis)[5-6]、淀粉液化芽孢杆菌(Bacillus amyloliquefaciens)[7]、地衣芽孢杆菌(Bacilluslicheniformis)[8]、粘性放线菌(Actinomycesviscosus)[9]、肠膜明串珠菌(Leuconostocmesenteroides)[10]等。不同的细菌产果聚糖蔗糖酶的能力也各有差异,所产果聚糖蔗糖酶对受体的专一性及酶转化获得的产物性质也有较大区别。
低聚乳果糖(lactosucrose,LS)是一种三糖(见图1),由β-D-半乳糖苷、α-D-葡萄糖苷和 β-D-呋喃果糖苷残基组成,可以被看作是一分子乳糖与一分子果糖的缩合物,或者是一分子半乳糖与一分子蔗糖的缩合物,其化学名称应为β-D-半乳糖基蔗糖,但习惯上,人们将其称为低聚乳果糖。低聚乳果糖是一种功能性低聚糖,易溶于水,甜度约为蔗糖的70%,几乎不被生物体消化和吸收,是双歧杆菌的有效增殖因子,其增值效果比其他功能性低聚糖如低聚果糖、低聚半乳糖等更好[11-12]。低聚乳果糖同时具有低热量、低龋齿、降低血液中的胆固醇、改善血脂、促进钙吸收等特殊的生理功能,可作为一种功能保健食品。国内对低聚乳果糖做了初步研究[13],还没有工业化生产的报道,而在日本低聚乳果糖已经进入市场多年。由于其具有广阔的应用前景,近年来低聚乳果糖的研究开发受到了极大的重视。
利用微生物来源的酶制备低聚乳果糖具有成本低、稳定性高、提取方便等特点。使用果糖基转移酶将蔗糖分解产生的果糖基转移至乳糖还原性末端的C1羟基上从而合成低聚乳果糖的方法,目前应用比较广泛的是节杆菌产的β-呋喃果糖苷酶以及纳豆芽孢杆菌产的果聚糖蔗糖酶(levansucrase)[14]。目前,国内外尚少见利用Bacillus flexus来源的果聚糖蔗糖酶生产低聚乳果糖的报道。本文主要针对前期构建的一株重组短小芽孢杆菌进行研究,摸索出不同条件对制备果聚糖蔗糖酶的影响,并对不同条件下其生产低聚乳果糖的能力进行探索。
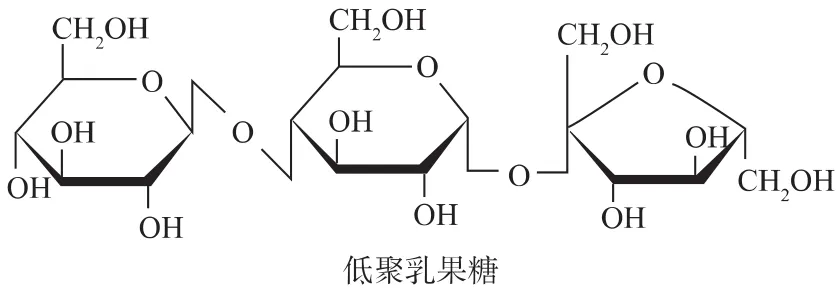
图1 低聚乳果糖结构Fig.1 Structure chart of lactosucrose
1 材料与方法
1.1 菌株
带有源自于弯曲芽孢杆菌Bacillus flexus果聚糖蔗糖酶基因lsc的重组短小芽孢杆菌B.brevis/pNCMO2-lsc为本实验室保藏。
1.2 培养基以及主要试剂
TM液体种子培养基(g/L):葡萄糖 10,多聚蛋白胨10,牛肉浸粉5,酵母粉2,微量元素液10 mL/L。其 中 微 量 元 素 液 组 成 为(g/L):FeSO4·7H2O 1,MnSO4·4H2O 1,ZnSO4·7H2O 0.1。卡那霉素的终质量浓度为 30 μg/mL。
发酵基础培养基(g/L):同种子培养基。
试剂:蛋白胨、酵母粉购自英国Oxoid公司,新霉素购自上海生工生物工程有限公司,α-乳糖、蔗糖等试剂购自国药集团化学试剂有限公司。
1.3 摇瓶发酵产果聚糖蔗糖酶
将保存在-80℃冰箱中的菌种以体积分数2%的接种量接种至种子培养基,37℃、200 r/min培养10 h。然后,以体积分数5%接种量转接至已加入基础发酵培养基,37℃、200 r/min培养至48 h。将发酵液离心取上清,获得重组酶的粗酶液。
1.4 酶活力测定方法
首先将粗酶液使用pH 7.0、浓度为20 mmol/L的磷酸盐缓冲液稀释一定倍数,取1 mL已稀释的酶液滴入1 mL 40 g/dL质量浓度的蔗糖溶液并震荡均匀,置于30℃水浴锅中催化反应20 min,最后煮沸30 min灭酶。反应后的溶液经适当处理使用高效液相色谱测定酶活。采用Agilent 1200高效液相色谱仪,示差检测器为安捷伦G1362A,色谱条件为流动相:纯水;流速:0.5 mL/min;色谱柱:Hi-Plex Ca 8 μm 300 mm×7.7;柱温:80 ℃。
一个果聚糖蔗糖酶活力单位(U)定义:在pH 7.0,温度30℃时每分钟转移1 μmol的葡萄糖所使用的酶量。
1.5 菌浓(OD600)的测定
取适量新鲜发酵液,稀释至适宜浓度,使用分光光度计在600 nm波长处测定吸光值,OD600=稀释倍数×OD600读数。空白为去离子水所测得的OD600值。
1.6 单因素实验
分别使用不同的氮源、碳源和金属离子作为唯一变量配制发酵培养基进行发酵产酶,其次研究不同温度对发酵产酶的影响,根据菌体生物量和果聚糖蔗糖酶产量分析最优产酶条件。
1.7 正交试验
选取4个因素分别为氮源(工业酵母粉∶棉籽粉=2∶1),碳源(葡萄糖∶蔗糖=1∶1),钙离子和温度,各取3个水平,其中碳源氮源皆为质量比,进行L9(34)正交实验,研究最优产酶条件。
1.8 果聚糖蔗糖酶制备低聚乳果糖工艺优化
1.8.1 加酶量和反应时间对低聚乳果糖转化率的影响 在初始反应温度35℃,起始pH 7.0,蔗糖和乳糖质量浓度均为200 g/L的情况下,加酶量分别控制为 0.5、1、2、3、4、5 U/g 底物, 设置水浴摇床温度为30℃、转速150 r/min,从第2小时开始每隔2 h取样煮沸终止反应,直至反应达到平衡。产物用HPLC进行检测。
1.8.2 温度对低聚乳果糖转化率的影响 在起始pH 7.0,蔗糖和乳糖质量浓度均为200 g/L的情况下,加酶量为2 U/g底物,转速150 r/min,使反应温度分别为 25、30、35、40、45、50 ℃,在反应进行到 8 h时取样煮沸终止反应,直至反应达到平衡。产物用HPLC进行检测。
1.8.3 pH对低聚乳果糖转化率的影响 在起始温度为35℃时,蔗糖和乳糖质量浓度均为200 g/L的情况下,加酶量为2 U/g底物,转速150 r/min,使反应 pH 分别为 5.0、5.5、6.0、6.5、7.0、7.5、8.0,在反应进行到8 h时取样煮沸终止反应,直至反应达到平衡。产物用HPLC进行检测。
1.9 低聚乳果糖测定方法以及产率的计算
1.9.1 低聚乳果糖测定方法 低聚乳果糖产物中的低聚乳果糖、蔗糖、乳糖以及单糖的量采用HPLC来确定。采用Agilent 1200高效液相色谱仪,示差检测器为安捷伦G1362A,色谱条件为流动相:纯水;流速:0.5 mL/min; 色谱柱:Hi-Plex Ca 8 μm 300 mm×7.7;柱温:80℃。采用外标法,根据保留时间和峰面积确定相应低聚乳果糖的浓度。示差检测确定样品中低聚乳果糖等糖的峰面积,确定他们的含量并计算获得转化率。
1.9.2 低聚乳果糖转化率的计算

式(1)中,R为转化率;m0为底物总质量;m1为生成低聚乳果糖的质量。
2 结果与分析
2.1 氮源对B.brevis产果聚糖蔗糖酶的影响
2.1.1 氮源种类对B.brevis产果聚糖蔗糖酶的影响 由于B.brevis几乎不利用无机氮源,使用无机氮源会导致菌体生长缓慢以及酶产量很低[15],故采用有机氮源来研究氮源对菌体产酶的影响,以TM培养基为起始培养基,分别以17 g/L的工业酵母粉、工业蛋白胨、鱼粉蛋白胨、大豆蛋白胨、牛肉浸膏、酪蛋白、棉籽粉、多聚蛋白胨、玉米浆粉等取代TM中的氮源,配制发酵培养基,在32℃下进行发酵产酶。实验结果如图2所示,采用工业酵母粉和棉籽粉时菌体生长较旺盛且重组酶的产量也达到较大值,故使用工业酵母粉和棉籽粉作为复合氮源进行下一步实验。
2.1.2 不同氮源配比对B.brevis产果聚糖蔗糖酶的影响 将总氮源质量浓度定为17 g/L,分别以工业酵母粉、棉籽粉、不同质量配比的工业酵母粉与棉籽粉(1∶1、1∶2、2∶1) 作为唯一氮源在发酵培养基中进行发酵产酶培养。如图3所示,在所用不同比例的工业酵母粉和棉籽粉的复合氮源时,以工业酵母粉∶棉籽粉质量比例为2∶1时产酶能力最强,且菌体生物量也较高。故选择总氮源含量17 g/L,工业酵母粉与棉籽粉比例为2∶1的复合氮源做进一步研究。
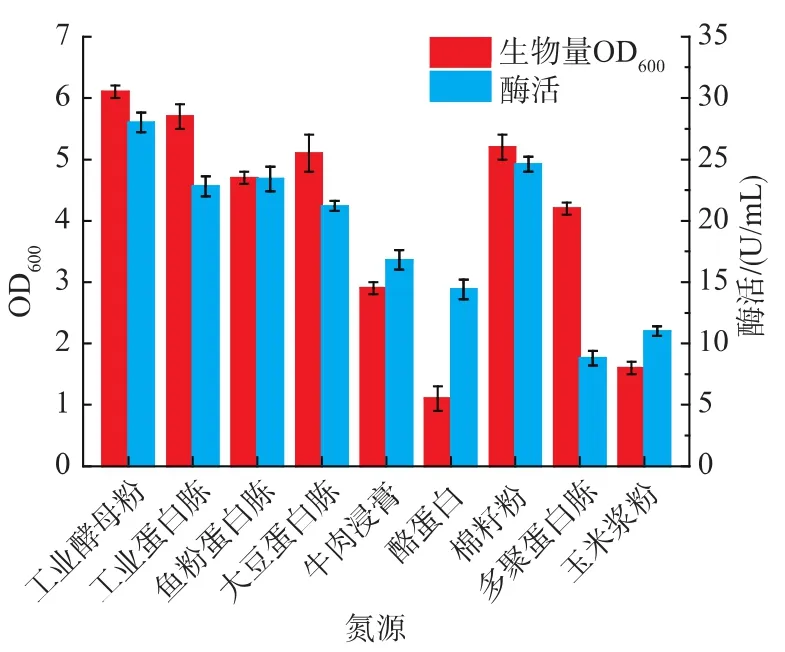
图2 不同氮源对B.brevis生长和产酶的影响Fig.2 Effect of different nitrogen source on cell growth and enzyme production of B.brevis
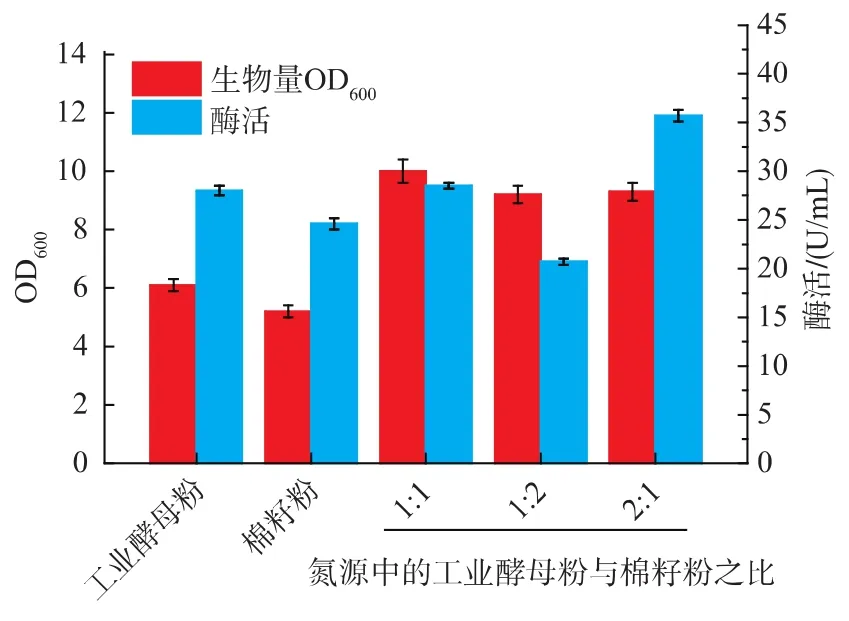
图3 不同氮源配比对B.brevis生长和产酶的影响Fig.3 Effect of different nitrogen proportion on cell growth and enzyme production of B.brevis
2.1.3 复配氮源质量浓度对B.brevis产果聚糖蔗糖酶的影响 将工业酵母粉:棉籽粉比例定为2∶1,研究不同总氮源浓度(5、10、20、30、40 g/L)对果聚糖蔗糖酶产量的影响(图4),当质量浓度在5~30 g/L时,氮源浓度增加,生物量和酶活也上升,并在质量浓度为30 g/L时酶活达到最大值。当质量浓度为40 g/L时酶活开始减小。产生这种现象可能的原因是较高的氮源浓度会抑制重组酶的表达。因此,选择30 g/L质量浓度的工业酵母粉与棉籽粉质量比例为2∶1的复合氮源做进一步研究。
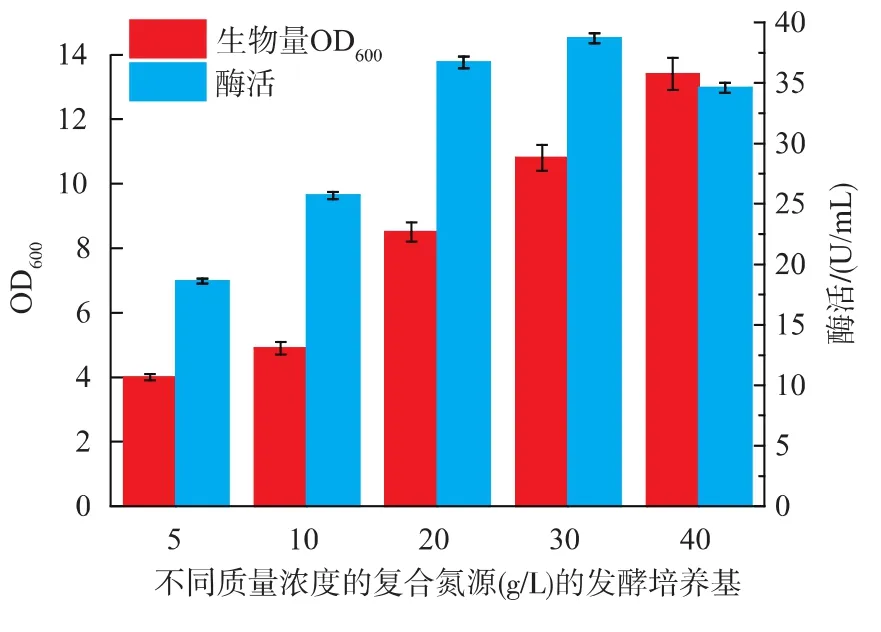
图4 不同质量浓度的复合氮源对B.brevis生长和产酶的影响Fig.4 Effect of different nitrogen concentration on cell growth and enzyme production of B.brevis
2.2 碳源对B.brevis产果聚糖蔗糖酶的影响
2.2.1 碳源种类对B.brevis产果聚糖蔗糖酶的影响 以上述优化好的复合氮源为唯一氮源,10 g/L的葡萄糖、果糖、蔗糖、淀粉、甘油、和糊精作为唯一的碳源配制培养基并于32℃下发酵产酶。由图5可知,以蔗糖和葡萄糖为唯一碳源时,培养基中菌体的生物量最高,且对产酶的促进最明显。故选用蔗糖和葡萄糖作为碳源做进一步研究。

图5 不同碳源对B.brevis生长和产酶的影响Fig.5 Effect of different carbon source on cell growth and enzyme production of B.brevis
2.2.2 碳源质量浓度对B.brevis产果聚糖蔗糖酶的影响 选取单一碳源发酵中效果较好的蔗糖和葡萄糖进行浓度和复配优化。将种子液分别接种于5、10、20、30 g/L 葡萄糖,5、10、15、20 g/L 蔗糖以及10 g/L葡萄糖+10 g/L蔗糖的复配培养基中进行发酵产酶培养。如图6所示,在10~30 g/L葡萄糖质量浓度和在10 g/L葡萄糖+10 g/L蔗糖的复配碳源中菌体的生物量都较高,而10 g/L葡萄糖+10 g/L蔗糖的复配碳源产酶能力最强,考虑到实际应用中的经济因素,故选择20 g/L葡萄糖做进一步研究。

图6 不同葡萄糖和蔗糖质量浓度以及配比对B.brevis生长和产酶的影响Fig.6 Effect of different concentration and proportion of sucrose and glucose on cell growth and enzyme production of B.brevis
2.3 金属离子对B.brevis产果聚糖蔗糖酶的影响
由于金属离子是生理活性物质的重要组成成分,且可以调节生理活性,因此它会对重组菌产果聚糖蔗糖酶产生较大的影响。一般在浓度较低时,这些金属离子对菌的生长和酶的表达具有促进作用,相反,浓度较高时则表现出抑制作用。为了考察不同金属离子对重组B.brevis外生产果聚糖蔗糖酶的影响,本实验在发酵培养基中添加了终浓度为1 mmol/L的不同种类的金属离子取代TM中的金属离子混合液进行发酵产酶。由图7可知,Cu2+不仅不能提高酶活,反而使菌体生长受到抑制,酶活更是受到严重抑制,而Mg2+、Co2+和Fe2+作为金属离子添加剂时,菌体生长也受到一定程度抑制,且酶活也受到一定程度的抑制;只有Ca2+不但可以促进菌体的生长,且酶活有较明显的提高。而BELGHITH等[16]的研究的芽孢杆菌研究表明Fe2+对酶活有较大的提高,可知微生物来源不同的果聚糖蔗糖酶受金属离子的种类和浓度的影响也不同。因此选择Ca2+做进一步研究。
2.4 培养温度对B.brevis产果聚糖蔗糖酶的影响
温度通常是间接的影响微生物的代谢活动,但是其影响程度通常也较为明显。在适宜的温度范围内,微生物的代谢活动会较为旺盛。为考察培养温度对菌体的影响,接种后将发酵培养基置于23、25、27、30、33、37℃温度下进行摇瓶发酵。由图8所示,温度在23~33℃时,菌体量随温度的升高而增大,而酶活在27℃时果聚糖蔗糖酶的产量达到最大值61.7 U/mL,27℃即为最适产酶温度。

图7 不同金属离子对B.brevis生长和产酶的影响Fig.7 Effect of different metal ions on cell growth and enzyme production of B.brevis

图8 培养温度对B.brevis生长和产酶的影响Fig.8 Effect of temperature on cell growth and enzyme production of B.brevis
2.5 正交试验
根据上述实验结果,选取对B.brevis产果聚糖蔗糖酶影响较大的4个因素氮源(工业酵母粉∶棉籽粉=2∶1),葡萄糖,钙离子和温度,各取 3 个水平,进行L9(34)正交实验,实验设计如表1所示,得出的实验结果如表2。
由表2中正交实验结果中极差R值得出:4个因素对B.brevis产果聚糖蔗糖酶的影响大小依次是A(氮源)>D(葡萄糖)>C(钙离子)>B(温度),根据直观分析得到最优组合为A3B2C1D3。即氮源总质量浓度为40 g/L,葡萄糖质量浓度为20 g/L,钙离子浓度为0.5 mmol/L,温度为30℃,在此条件下酶活可达62.1 U/mL。

表1 正交试验因素水平设计Table1 Factors and levels of orthogonal test

表2 正交实验结果与分析Table2 Results and analyze of the orthogonal
2.6 果聚糖蔗糖酶制备低聚乳果糖的初步研究
2.6.1 加酶量和反应时间对低聚乳果糖转化率的影响 酶转化过程中加酶量不仅影响最终的低聚乳果糖产量,还会影响反应达到平衡的时间。本研究在转化过程中特定时间点取样,测定反应体系中低聚乳果糖的含量并绘制低聚乳果糖转化率变化的曲线。结果如图9所示,加酶量为0.5 U/g底物时,前期反应速率较低,反应进行10 h达到平衡,低聚乳果糖转化率为 31.89%。而加酶量为 1、2、3、4、5 U/g底物时,在2~6 h时,他们的转化率比较接近,在24.41%~29.98%之间。在6 h之后,加酶量为3、4、5 U/g底物的样品中,低聚乳果糖的转化率缓慢增加,并接近平衡点,而加酶量为1、2 U/g底物的样品在6 h之后低聚乳果糖的转化率仍然继续增加,在反应进行到8 h时可达到平衡。其中加酶量为2 U/g底物的样品中低聚乳果糖的转化率可达到37%。产生上述现象的原因可能是由于加酶量过低时导致其催化能力不足,酶反应速率较低。而加酶量过高时,酶的水解活性大于其转糖基活性,并且水解产物葡萄糖对低聚乳果糖的合成产生抑制作用,从而降低低聚乳果糖的最终转化率。在对不同加酶量的产物检测中,发现随着反应时间的推移,转化率有下降的趋势,此时可检测到少量蔗果三糖的生成。因此,为了在尽可能短的反应时间内达到最高的转化率,选用2 U/g底物的加酶量为最佳。

图9 加酶量和反应时间对低聚乳果糖转化率的影响Fig.9 Effect of enzyme concentration and reaction time on the yield of lactosucrose
2.6.2 温度对低聚乳果糖转化率的影响 见图10,在不同温度下低聚乳果糖的转化率差别较大。在35℃时,低聚乳果糖的转化率最高,可达到38.3%。在低于35℃时,转化率随着温度的升高而升高,温度过低时,酶活会受到抑制。而温度高于35℃之后,转化率随着温度升高开始下降,可能是由于温度升高,有部分果聚糖蔗糖酶失活。故选择最适反应温度为35℃。

图10 温度对低聚乳果糖转化率的影响Fig.10 Effect of temperature on the conversion rate of lactosucrose
2.6.3 pH对低聚乳果糖转化率的影响 pH会影响酶的生理活性从而影响到低聚乳果糖的转化率。见图11,在pH 6.0时低聚乳果糖的转化率为39.1%,为不同pH情况下的最高值。此外,在pH 6.0~7.0这个范围内时,转化率都维持在较高值。

图11 pH对低聚乳果糖转化率的影响Fig.11 Effect of pH on the conversion rate of lactosucrose
3 结语
综上所述,对重组菌产果聚糖蔗糖酶的发酵条件进行优化,确定其发酵产酶的最适培养基为:氮源(工业酵母粉∶棉籽粉=2∶1,质量比)为 40 g/L、葡萄糖为20 g/L、CaCl20.5 mmol/L,最适产酶温度30℃。在最优条件下发酵培养,果聚糖蔗糖酶的酶活可达62.1 U/mL,是国内外报道的最高水平。利用该重组果聚糖蔗糖酶转化蔗糖-乳糖制备低聚乳果糖,在蔗糖和乳糖质量浓度均为200 g/L情况下,确定其最适转化条件:反应温度35℃,pH 6.0,加酶量为2 U/g底物,低聚乳果糖转化率可达39.1%,为国内外报道的较高水平。
