三聚甲醛强降解菌的筛选鉴定及其对聚甲醛废水的生物强化
2019-10-29叶姜瑜李大荣陆榆丰窦建军
叶姜瑜,李大荣,陆榆丰,李 媛,窦建军
(1.重庆大学 城市建设与环境工程学院,重庆400045;2.重庆融极环保有限公司,重庆400000)
聚甲醛(Polyoxymethylene)是世界五大通用塑料之一,由于硬度大、刚度好、耐疲劳度高且自带润滑性,有“超钢、夺钢”之称[1],被广泛应用于日用轻工、汽车、建材、农业、医疗器械等领域[2-4]。中国煤化工企业近年来发展迅速,很多煤化工企业建立了聚甲醛生产项目。不过,聚甲醛生产中产生的废水含有甲醛、三聚甲醛(s-Trioxane,TOX)、二氧五环、甲缩醛和酚类等有害物质,具有盐分高、化学需要量(COD)高等特征,很难生物处理至达标排放,对环境和人体有极大的危害,成为亟待解决的问题。目前针对聚甲醛废水常见的处理方法有石灰法,高级氧化法如Fenton氧化法、湿式氧化法、臭氧催化氧化法,复合工艺法等[5]。但这些方法将产生大量化学污泥、条件要求苛刻、运行成本较高、工艺管理困难,因此应用受限。普通生物法虽然能克服以上缺点,但由于甲醛、TOX等有毒物质的抑制作用,许多微生物活性丧失,无法实现有效生物降解。
目前针对聚甲醛废水中甲醛成分降解研究较多,且已分离出对甲醛具有代谢作用菌株,如产青霉素菌Penicillium chrysogenum[6]、蒙氏假单胞菌Pseudomonas monteilii[7]、红串球菌Rhodococcus erythropolis[8]、恶臭假单胞菌Pseudomonas putida[9]等。不过,对聚甲醛废水主要污染物之一TOX的生物降解研究仍较少,到目前为止仍少见TOX降解菌株的报道。我们驯化分离了一株以TOX为碳源的细菌,将其与甲醛降解菌群复合后进行了聚甲醛废水的生物强化研究,结果表明其对聚甲醛类污水有良好的处理效果,可作为复合菌剂的组成成分。
1 材料与方法
1.1 菌源和水样
菌株分离于某化工厂聚甲醛污水厂调节池底泥;活性污泥取自曝气池;聚甲醛废水取自于调节池。污水水质为:COD 3413 mg/L,HCOONa 3000~3500 mg/L,甲醛 135~250 mg/L,TOX 130~240 mg/L,DOX 37 mg/L,CH3OH 110 mg/L。
1.2 培养基
基本无机盐培养基(g/L):KH2PO40.7,K2HPO40.85,(NH4)2SO41.2,MgSO4·7H2O 0.1,CaCl20.01,FeSO4·7H2O 0.001,1×105Pa 灭菌 20 min。
LB 培养基(g/L):蛋白胨 10,氯化钠 10,酵母浸出粉 5,于 pH 7.0,1×105Pa 灭菌 20min。用于菌株富集扩培。
TOX降解菌培养基:基本无机盐培养基高压灭菌后加入一定量0.2 μm滤膜灭菌的TOX溶液。
1.3 菌株来源
TOX降解菌的分离纯化:取10 mL底泥与污水混合物,加至LB培养基,于恒温摇床30℃培养24 h;取5 mL所得扩培菌液,加至100 mL含TOX浓度为100 mg/L的LB培养基中,恒温摇床30℃培养48 h,取菌液5 mL,如此反复接种所得菌液4~5次,每次接种LB培养基按梯度降低100 mg/L酵母粉,同时增加100 mg/L TOX,最后一次TOX浓度达500 mg/L;选择最终菌液样品于含400 mg/L TOX的LB固体培养基上稀释涂布,并挑取所得菌落划平板,培养48h;反复划平板得到纯菌株,-20℃下甘油保种备用。
甲醛降解菌:重庆大学城市建设与环境工程学院微生物分子生态学实验室保存菌株麦芽糖假丝酵母(Candidamaltosa)和恶臭假单胞菌(Pseudomonsa putida)[10]。
1.4 菌株鉴定
形态学观察:观察菌株在LB固体培养基上形成的单菌落形态特征,包括菌落颜色、边缘平整度和表面湿润性等。用解剖针挑取少许培养皿上的菌落,混合于载玻片的无菌水滴中,光学显微镜下观察其个体形态特征。
革兰染色:对细菌进行革兰染色:包括初染、媒染、脱色、复染等4个步骤,于光学显微镜下进行鉴别。
分子生物学鉴定:对单菌株进行基因组提取(参照细菌DNA提取试剂盒步骤);对所得基因组采用细菌16S rDNA通用引物27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和 1 492R(5’-CGGYTACCTTGTTACGACTT-3)[11]进行扩增,将所得产物送与南京金斯瑞生物科技有限公司测序;利用NCBI软件中的BLAST对实验菌株的16S rDNA序列与GenBank数据库中的已知序列进行同源性比较[12]。
1.5 环境因子对微生物生长影响的测定
菌株生长曲线测定:将活化后的分离菌株按体积分数1%接种于TOX质量浓度为100 mg/L的LB液体培养基;定时取样测定菌液OD600值。
pH值对菌株生长的影响:恒温培30℃培养,分别配制 pH 值梯度为 4、5、6、7、8 和 9,TOX 质量浓度为100 mg/L的LB培养基,按1%接种菌液,定时取样测定OD600值。以时间为横坐标,OD600为纵坐标,绘制菌株生长曲线。
温度对菌株降解TOX的影响:设置20、25、30、35℃和40℃5个温度梯度,于TOX浓度为400 mg/L的基本无机盐培养基中加入体积分数为5%离心后的纯菌体,24 h后取样测定TOX降解率。
NaCl浓度对菌株生长的影响:以TOX质量浓度为100 mg/L的LB培养基为基质,分别配制NaCl质量浓度为 1、1.5、2、3 g/L 和 4 g/L 的培养基,按体积分数1%接种菌株,定时取样测定OD600值,以时间为横坐标,OD600为纵坐标,绘制菌株生长曲线。
菌株对不同质量浓度TOX的降解实验:以前期实验最优条件为基础,配制TOX质量浓度分别为100、200、400、600、800、1100 mg/L 和 1500 mg/L不同梯度基本无机盐培养基,菌液按体积分数2%离心(10000 r/min)并接种,以时间为横坐标,TOX降解率为纵坐标绘制曲线。
以上均使用250 mL三角锥形瓶,摇床转速为180 r/min。
1.6 指标测定
COD测定:HACH消解法[13];甲醛测定:乙酰丙酮分光光度法;TOX测定:参照侯丽等[14]的顶空色谱毛细柱法方法。
1.7 聚甲醛废水生物强化实验
建立A、B、C和D共4组平行小试反应器。各反应器有效容积为3.5 L,启动前均加入等量经该污水驯化后的活性污泥。A组:未加其他菌剂;B组:加入TOX降解菌;C组:加入甲醛降解菌;D组:同时加入TOX降解菌与甲醛降解菌。统一进水,曝气,定时取样测定各出水CODcr、甲醛和TOX。其中TOX降解菌和甲醛降解菌分别由TOX质量浓度为100 mg/L的LB培养基和甲醛质量浓度为100 mg/L的LB培养基摇床培养16 h后所得;各系统菌液按体积分数2%离心(10000 r/min)后投加;D组单菌与甲醛降解菌投加比例为1∶1。
2 结果与讨论
2.1 TOX强降解菌的分离鉴定及生长曲线
通过底泥富集驯化、分离,获得几株TOX降解菌株。其中一株Q1优势菌生长良好,其菌落形态米白色,表面干燥,边缘光滑齐整,中间凹陷,菌落较厚(图1);显微镜形态呈杆状:革兰染色阳性(G+)。对该菌株进行16S rDNA基因测序,其结果与GenBank数据库比对,该菌被确定为与最高同源性98%的甲基营养型芽孢杆菌(Bacillus methylotrophicus)相同。对其进行生长曲线测定,结果表明,接种4 h内,OD600值上升较为平缓,为该菌适应期;随后进入对数期,菌株呈现快速增长;16 h进入稳定期初期,此时活性较好,被确定为接种期。

图1 菌株B.methylotrophicus的形态学特征Fig.1 Morphological identification of B.methylotrophicus
2.2 环境因子对B.methylotrophicus生长的影响
聚甲醛污水中污染物质(如TOX、二氧五环等)组分及含量都有很大的不确定性,COD变化大,且正常生产情况下水质偏酸性、工段投加大量NaOH等原因,使得聚甲醛废水含盐质量分数为1.5~2.5 g/L,属于高盐类工艺废水。环境因子pH值、温度和离子浓度等对菌株B.methylotrophicus生长的影响见图2~4。
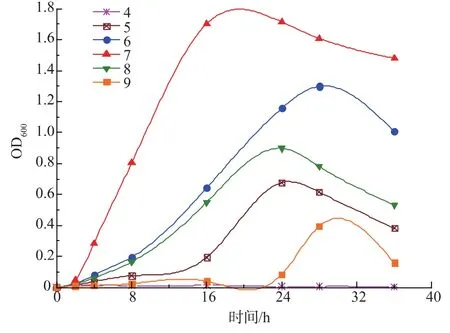
图2 pH值对菌株B.methylotrophicus生长的影响Fig.2 Effects of pH on activities of B.methylotrophicus

图3 温度对B.methylotrophicus降解TOX的影响Fig.3 Effects of temperature on degradation of B.methylotrophicus to TOX
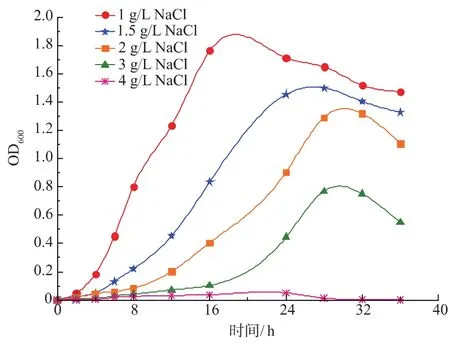
图4 NaCl质量浓度对菌株B.methylotrophicus生长的影响Fig.4 Effects of NaCl concentration on activities of B.methylotrophicus
由图2可知,菌株对pH变化较敏感,酸碱对该菌的影响都较大。培养基pH值为7时,菌株进入稳定期时间提前至16 h,此时OD600峰值相对最高,确定其最佳生长pH为7。而当温度为30℃时,该菌有最高的TOX降解率91.63%(图3),表明该菌株属于中温微生物类型。由图4可看出,盐离子浓度对该菌的影响较大,随着NaCl质量浓度的提高,菌株适应期逐渐加长、稳定期种群数量下降。当NaCl质量浓度为1、1.5 g/L和2 g/L时,生长曲线表明该菌有较好的适应性;NaCl质量浓度超过3 g/L以后,菌株生长受到较明显抑制,稳定期时种群数量明显下降。生产性聚甲醛废水的盐浓度应在该菌耐受范围内。
2.3 菌株B.methylotrophicus对不同浓度TOX的降解
B.methylotrophicus对TOX的降解效率见图5。当TOX质量浓度为100~400 mg/L时,菌株能迅速适应底物,并以TOX作为碳源实现快速降解,在24 h内TOX降解率可达90%左右;随着底物浓度的逐步提高,菌株适应期随之变长,但600 mg/L以下都有较好的降解率;当TOX质量浓度提升至1200 mg/L时,在40 h内TOX降解率仅为21.84%,表明TOX对该菌已表现出明显的抑制性,对菌株表现出极大毒性,初步判定菌株B.methylotrophicus对TOX降解的耐受浓度为1200 mg/L。

图5 不同TOX质量浓度下菌株B.methylotrophicus的降解率Fig.5 Degradation of B.methylotrophicus to different TOX concentration
2.4 聚甲醛废水的生物强化处理
聚甲醛废水COD的主要构成为HCOONa、甲醛、TOX和醇类等,其中甲醛与TOX为主要有毒物质。对该污水生物强化处理后反应系统最终出水水质及降解率见表1,其降解趋势见图6。
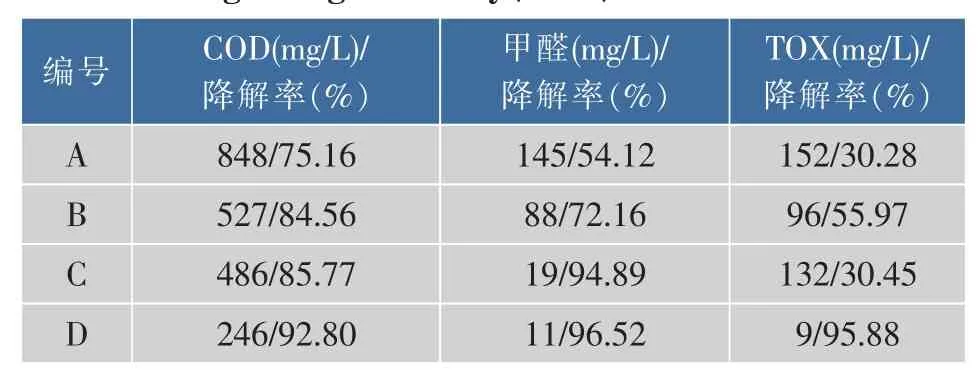
表1 各系统出水污染物浓度及其降解率(60 h)Table1 Concentration of pollutants in effluents and its degrading efficiency(60 h)

图6 反应系统中COD降解时的甲醛、TOX浓度变化Fig.6 Variation of formaldehyde,TOX and COD in Systems
由图6可知,系统启动后,各组COD均呈下降趋势,其中A组较为平缓,B、C组次之,D组最快;A组最终出水的COD降解率仅为75.16%,而D组最终降解率达92.80%(表3)。此外,各系统COD均随甲醛、TOX的降低而降低,对照组A的甲醛和TOX降速都极为缓慢,而B组的甲醛、TOX降解速率与降解率均有一定提高,其降解率分别为72.16%和55.97%,但TOX相对A组降解率仅提高了25.69%。C组的甲醛降解率高达94.89%,但对TOX降解率仍极低为30.45%,相对A组变化也不大。而D组由于同时加入了甲醛降解菌与TOX降解菌B.methylotrophicus,其甲醛和TOX的降解率都有明显提高,达96.52%和95.88%,同时COD降解率也提高至92.80%,其各项指标均远优于A、B、C组。
本研究显示,当仅加入B.methylotrophicus时,由于受到其他如甲醛等物质的抑制作用,并不能发挥其最佳活性将TOX完全降解(如图6 B);仅加入降甲醛混合菌时,虽甲醛去除率高,但缺少TOX的降解菌,TOX的质量浓度较高,仍然抑制了活性污泥中的其他微生物群落,致使其COD降辐相对B组变化不大(如图6(c));当同时加入TOX降解菌与甲醛降解菌时,菌株之间展示出良好的协同作用,实现了甲醛、TOX的同步快速降解,消除了抑制微生物的毒性物质,从而其他COD降解菌种群逐渐增强、COD随之大大降低。总体看来,各处理组出水水质优劣为:D组(TOX降解菌+甲醛降解菌)>C组(甲醛降解菌)>B组(TOX 降解菌)>A 组(对照组)。因此,无论是B.methylotrophicus,还是甲醛降解菌单独的生物强化,均只能实现单一有毒物质的部分降解,只有多菌株生物强化后协同降解聚甲醛废水的有毒底物,才能真正有效地实现聚甲醛废水的生物处理。
3 结 语
本研究以TOX作为单一碳源分离了一株编号为Q1的TOX降解菌,经形态与分子生物学鉴定为甲基营养型芽孢杆菌(B.methylotrophicus),其在100 mg/L TOX的LB培养基中培养16 h进入稳定期,最佳生长pH和温度分别为7℃和30℃,NaCl耐受度低于3%,TOX耐受度低于1200 mg/L。在对聚甲醛废水的生物强化处理中,该菌和甲醛降解菌同时加入的处理效果要优于其他组合,表明该生物强化菌剂消除了抑制微生物群落的主要毒性物质,促进了聚甲醛降解微生物种群的增殖和对有毒废水COD的有效降解,对聚甲醛废水的处理工程具有重要的应用价值。
