麻花秦艽不同组织部位可培养内生菌群结构及其与龙胆苦苷含量的相关性
2019-10-29曹倩倩黄春萍
陈 昕 ,李 琪 ,2,曹倩倩 ,黄春萍 *,2
(1.四川师范大学 生命科学学院,四川 成都 610068;2.农田生态服务能力建设四川省高校工程中心,四川 成都610068)
植物内生菌包括真菌、细菌和放线菌,主要存活于健康植物组织内部,但不引发宿主植物表现出明显感染症状的微生物类群[1-2]。植物内生菌可产生与宿主植物相同或者相似的具有生物活性的代谢产物,包括萜类、芳香类、多肽类等化合物[2-4]。同时,这些活性成分通常具有抗肿瘤、抑菌和杀虫等作用,且代谢产物丰富,是新型药物的潜在资源[5-6]。药用植物内生菌多样性的研究对进一步探索内生菌与宿主植物间的生态关系、反应宿主植物的生存环境和生长状态、生物学资源的开发等具有重要意义。
麻花秦艽(Gentiana stramineaMaxim)为龙胆科龙胆属多年生草本植物,在我国有2000多年的种植历史,广泛分布于四川西北地区、青海大部分地区和甘肃、西藏、宁夏部分地区[7],是我国三级重点保护野生药材之一[8-9],具有退虚热、止痹痛、清湿热、祛风湿的功效,可用于治疗中风半身不遂、风湿痹痛、骨节酸痛、筋脉拘挛、骨蒸潮热、湿热黄疸、小儿疳积发热等症状[7]。秦艽具有环烯醚萜类、黄酮类、生物碱和其他化学成分,以环烯醚萜为其特征成分[10-11],这些活性成分含量在其不同组织中存在明显的差异[12]。内生菌复杂的群落结构是秦艽植物环境的一个重要组成,对其生长具有明显的影响,如:次级代谢产物的积累、药材质量、药材道地性等等[13-14]。同时,内生菌和植物之间密切的共生关系使内生菌能影响植物有效成分的合成,或者内生菌自身便合成某些有效成分[15]。
然而,目前对麻花秦艽植物资源的研究主要集中在其化学成分、资源开发和药理药效等方面[16-18],对该植物内生菌群结构的研究报道非常有限。另一方面,随着对秦艽植物需求量猛增,长期采挖和环境恶化,使野生秦艽资源遭到严重的破坏,最终制约了秦艽植物资源的健康发展。秦艽内生菌多样性及其相关研究对于探索秦艽与其内生菌之间的互动机制、反映秦艽的生长状态和生存环境、开发具有超常生态和医学功能的生物资源等均具有重要意义。本研究中将通过对麻花秦艽根、茎、叶和花等不同组织部位中的可培养内生菌的数量和组成等结构进行分析,探讨麻花秦艽可培养内生菌结构与其主要药效成分龙胆苦苷含量之间的关系,以期为秦艽内生菌的资源情况及内生菌生物活性成分研究奠定理论基础。
1 材料与方法
1.1 实验材料
1.1.1 样品来源 麻花秦艽于2015年夏季采自四川理县米亚罗(31°14′—31°19′N,102°53′—102°57′E,海拔 2458~4619 m)。
1.1.2 培养基 牛肉膏蛋白胨培养基[19](g/L):牛肉膏 3,蛋白胨 10,氯化钠 5,琼脂 20,pH 7.0~7.2;马丁(Martin)培养基[19](g/L):葡萄糖 10,蛋白胨 5,磷酸二氢钾1,琼脂20,1/3000孟加拉红100 mL/L,临用前加0.03%链霉素稀释液100 mL/L,自然pH。
1.2 方法
1.2.1 样品处理 取麻花秦艽植株用自来水冲洗,去除表面的泥土,室温晾干。将清洗的秦艽根、茎、叶、花用灭菌手术刀切成1 cm见方的小块(段、片),切掉表层。然后转到无菌操作台上进行消毒:无菌水漂洗2次,75%乙醇浸泡2 min,0.01%汞浸泡4 s,无菌水冲洗3次[20],以备内生菌分离纯化用。
1.2.2 菌株的分离纯化 将处理后的各组织置于灭菌研钵中,加入9 mL无菌水,研磨成匀浆菌悬液,将制备的菌悬液10倍梯度依次稀释至1×10-1~1×10-5,分别取 100 μL涂布于牛肉膏蛋白胨培养基和马丁氏培养基,每个处理重复3次。细菌置于37℃培养,真菌置于25℃培养。在同样培养条件下放置相应空白培养基,同时吸取1.2.1中样品处理时最后一次无菌水冲洗液各100 μL涂布牛肉膏蛋白胨和马丁平板做相应的对照培养,若培养后无细菌或真菌长出,证明表面消毒彻底[21-22]。培养2~3 d后,培养基中可见有菌落形成,计算菌落数。根据菌落形态、颜色等的大小、形状、边缘、光泽、质地、颜色和透明程度等挑取单菌落转接(划线)入对应的培养基中纯化培养[23]。
1.2.3 内生菌的鉴定 按照文献[20]方法对细菌进行常规形态鉴定。根据《真菌鉴定手册》[24],对真菌进行常规形态鉴定。细菌和真菌总DNA的提取分别采用康为世纪(北京)生物科技有限公司细菌和真菌基因组DNA提取试剂盒按标准操作流程进行。按照文献[1,17]方法,采用27F/1429R引物扩增细菌16S rRNA基因片段。按照文献[25]方法,采用ITSI/ITS4扩增真菌18S rRNA基因片段。得到的PCR产物用1%琼脂糖凝胶电泳检测,条带回收后由擎科生物有限公司进行序列测定。测序得到的核苷酸序列在NCBI上GenBank中进行BLAST分析,采用MEGA 4软件对序列进行相似性分析,并以Neighborjoining方法构建系统发育树,用Bootstrap(1000次重复)进行检验。
1.2.4 龙胆苦苷相对含量检测 麻花秦艽主要药用成分龙胆苦苷的检测按照文献[26]的方法采用HPLC检测。麻花秦艽各组织部位龙胆苦苷的含量见表1。
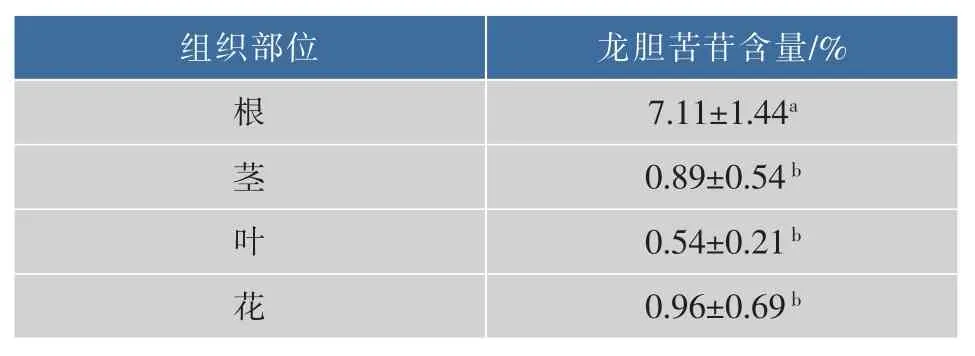
表1 麻花秦艽根、茎、叶、花中龙胆苦苷相对含量(n=3)Table1 Gentiopicrin contents in roots,stems,leaves and flowers of Gentiana straminea Maxim(n=3)
1.3 数据处理
采用SPSS17.0统计软件进行单因素方差分析,多重比较采用最小显著差异法(LSD)。微生物数量与龙胆苦苷含量的相关关系采用Pearson法。数据整理、计算与作图均采用Microsoft Excel 2013软件。
2 结果与讨论
2.1 麻花秦艽不同组织部位可培养内生菌数量
通过稀释涂布法,对麻花秦艽各组织部位可培养内生细菌和内生真菌进行检测,结果见表2。根中的可培养内生细菌和真菌的数量最高,分别为(8.77±0.71)×105cfu/g 和(2.00±1.05)×104cfu/g;茎中的可培养内生细菌显著性低于其他组织,并且从茎和花中没有分离到可培养内生真菌。内生菌的种类和数量会受到不同分离部位的影响[26],同时大量的研究发现药用植物内生菌与其活性成分存在一定的相关性[27-29]。麻花秦艽不同分离部位龙胆苦苷含量存在显著性差异(表1),这可能是导致其各部位内生菌数量存在显著性差异的主要原因(表3)。
2.2 麻花秦艽可培养内生细菌的鉴定
从麻花秦艽的不同组织中共分离到内生细菌10 株(QJ1~QJ10),其形态特征见表 4。
表2 麻花秦艽不同组织部位内生细菌与内生真菌数量(±s)Table2 Quantity of the endophytic bacteria and fungi in the different parts of Gentiana straminea Maxim(±s)cfu/g
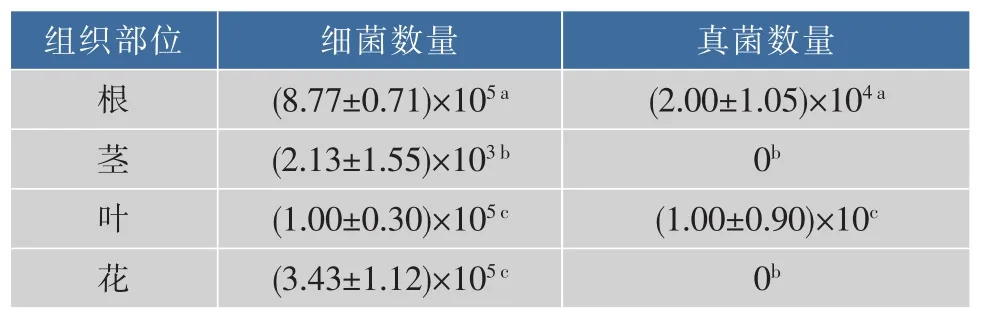
表2 麻花秦艽不同组织部位内生细菌与内生真菌数量(±s)Table2 Quantity of the endophytic bacteria and fungi in the different parts of Gentiana straminea Maxim(±s)cfu/g
注:不同小写字母表示内生细菌或内生真菌的数量在不同组织部位中差异性显著(P<0.05)。
组织部位真菌数量细菌数量根(2.00±1.05)×10 4a 0 b 茎(8.77±0.71)×10 5a(2.13±1.55)×10 3 b叶(1.00±0.30)×10 5c (1.00±0.90)×10 c花(3.43±1.12)×10 5c 0 b
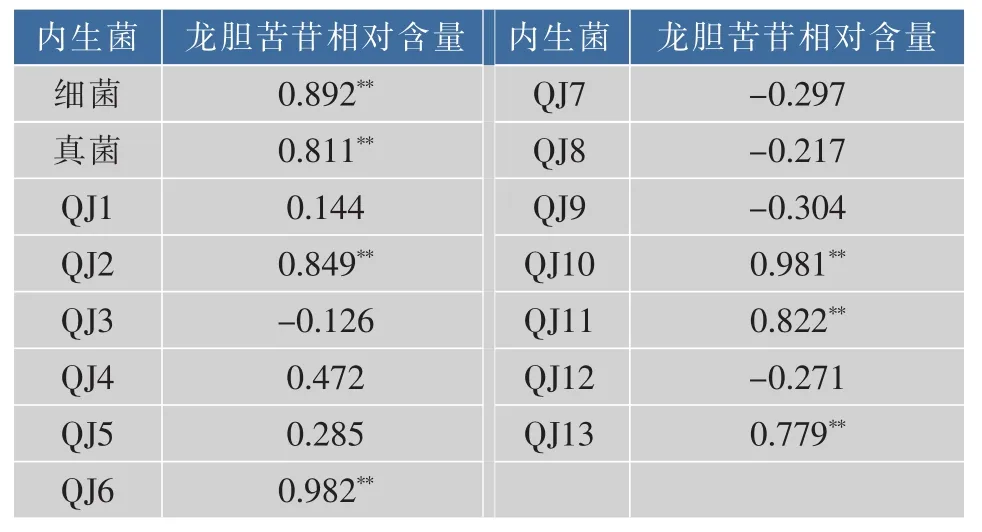
表3 可培养内生菌数量与龙胆苦苷相对含量的相关性分析Table3 Correlation analysis of quantity of the cultivable endophytes and content of gentiopicrin of Gentiana straminea Maxim

表4 麻花秦艽可培养内生细菌形态与培养特征Table4 Morphological and cultured characteristics of culturable endophytic bacteria in Gentiana straminea Maxim
对菌株QJ1~QJ10进行16S rDNA基因测序,测序结果在GenBank进行同源性比对,结果见表5。菌株QJ1与伯克霍尔德菌(Burkholderiasp.,登录号KJ004488.1)的同源性为 99%;QJ4与短小杆菌(Curtobacteriumoceanosedimentum,登 录 号JF460771.1)的同源性为100%;QJ5与假单胞菌(Pseudomonassp.,登录号 KM253123.1)的同源性为99%;QJ6与拉恩菌(Rahnellasp.,登录号KT580643.1)的同源性为 99%;QJ7与假单胞菌(Pseudomonassp.,登录号 JQ511859.1)的序列同源性为97%以上,构建系统发育树(图1)后,分别位于同一系统发育分支上;QJ8与新鞘氨醇单胞菌(Novosphingobiumsp.,登录号 KM252978.1)的序列同源性为 100%;QJ10与假单胞菌(Uncultured pseudomonassp.,登录号 GU201572.1)的序列同源性为99%。另外,QJ2和杜擀菌(Duganellasp.,登录号KF424273.1)的序列同源性最大,但只有90%;QJ3与不可培养细菌(Uncultured bacterium,登录号DQ984599.1)和黄单胞菌(Xanthomonadaceae bacterium,登录号JN872548.1)的序列同源性为最大,但均只达 93%;QJ9 与泛菌(Pantoeasp.,登录号JN853256.1)的序列同源性最大,但只达88%。综合同源性比对结果并结合其培养特征,菌QJ1、QJ4、QJ6和QJ8分别属于伯克霍尔德菌、短小杆菌、拉恩氏菌、新鞘氨醇单胞菌,而菌株QJ5、QJ7和QJ10均属于假单胞菌属。此外,在本研究中菌株QJ2、QJ3和QJ9的16s rDNA序列与GenBank中已报道序列一致性低于97%,这显示出麻花秦艽内生细菌微生物种群可能存在新的物种资源[22]。
2.3 麻花秦艽可培养内生真菌分离鉴定
从麻花秦艽的不同组织中共分离到内生真菌3株(QJ11~QJ13),其形态特征见表6。
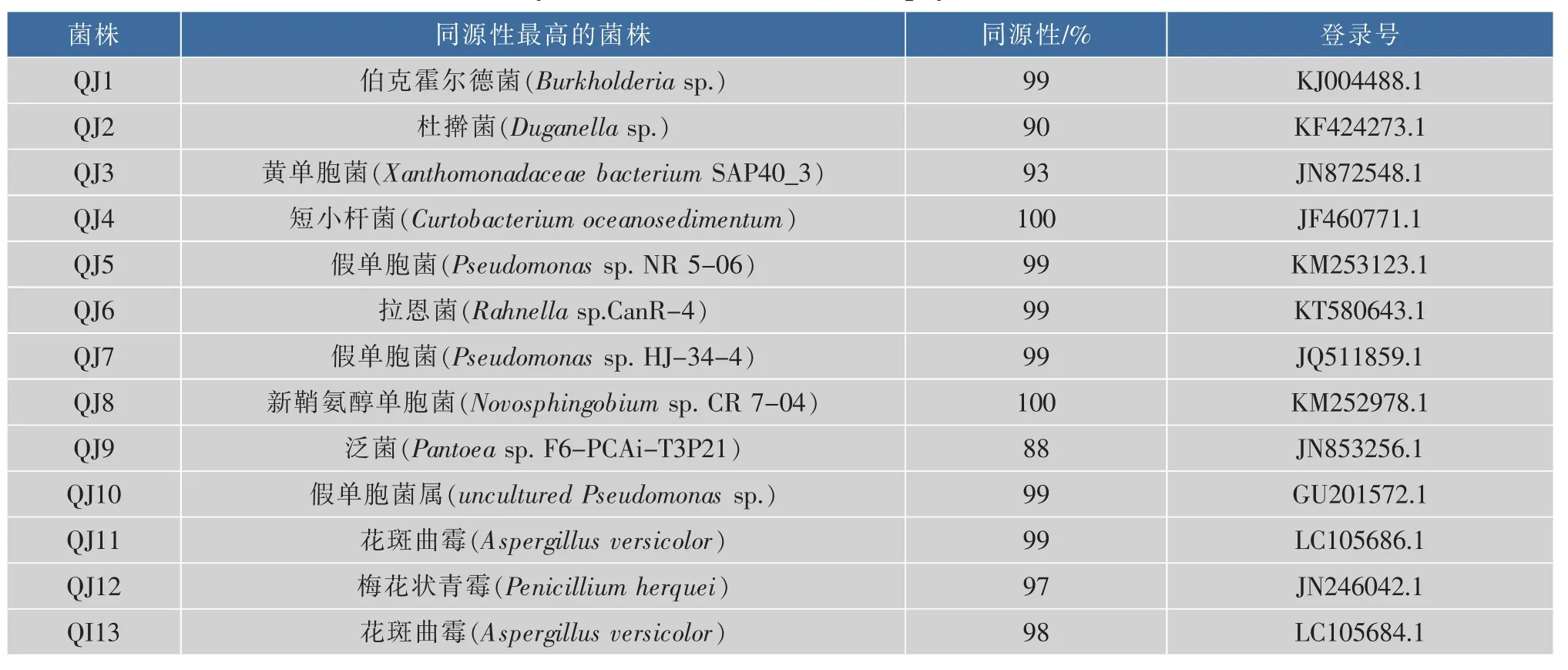
表5 麻花秦艽可培养内生菌测序比对结果Table5 Result of blast by Genbank of culturable endophyes in Gentiana straminea Maxim

图1 麻花秦艽内生细菌的系统发育分析Fig.1 Phylogenetic tree of the endophytic banterium of Gentiana straminea Maxim

表6 麻花秦艽可培养内生真菌形态与培养特征Table6 Morphological and cultured characteristics of Culturable endophytic fungus in Gentiana straminea Maxim
对菌株QJ11~QJ13进行ITS基因测序,并在GenBank中进行同源性比对,结果见表5,菌株QJ11与花斑曲霉(Aspergillus versicolor,登录号LC105686.1)的同源性达99%,构建系统发育树(图2),二者位于同一系统发育分支上。综合同源性比对结果和QJ11与花斑曲霉在发育树系统中的位置,并结合形态特征,菌株QJ11应属于花斑曲霉。菌株QJ12与梅花状青霉(Penicillium herquei,登录号JN246042.1)的序列同源性达97%,构建系统发育树(图2)后,二者位于同一系统发育分支上。菌株QJ13与不可培养真菌(uncultured fungus,登录号KM233157.1)的同源性最大,达98%,同时与花斑曲霉(Aspergillus versicolor,登录号 LC105684.1)的序列同源性也达97%,构建系统发育树(图2)后,三者位于同一系统发育分支上。

图2 麻花秦艽内生真菌系统发育分析Fig.2 Phylogenetic tree of the endophytic fungus of Gentiana straminea Maxim
2.4 麻花秦艽可培养内生菌在各组织部位中的分布
从麻花秦艽中共分离纯化得到10株细菌和3株真菌。初步鉴定,内生真菌有2个属、细菌有8个属,它们在各组织部位的分布见表7。麻花秦艽根、茎、叶和花中含有不同种类和数量的内生菌。麻花秦艽茎中内生菌分离得到7属,叶部分离得到7属,根部分离得到8属,花部分离得到3属。其中,根中的内生菌种类最多,而花中的内生菌种类最少。菌株QJ2在不同组织部位中均有发现且数量最多,为麻花秦艽内生菌中的优势属,其包括的数量所占比例为59.9%。菌株QJ11是真菌中占内生菌总数量比例最高的属,其包括的数量所占比例为86.7%。其余菌株QJ7和QJ9仅在茎中分离得到,菌株QJ10仅在根中分离得到,菌株QJ12仅在叶中分离得到,菌株QJ11和QJ13仅在根中分离得到。
对不同组织部位分离出的内生菌数量进行分析可知,在麻花秦艽根中以菌株QJ2和QJ5为优势属,其所包括数量分别占该组织部位内生细菌总数的81.3%和6.2%,在麻花秦艽茎中以QJ2和QJ3为优势属,占该组织部位内生细菌总数的46.0%和36.3%,在麻花秦艽叶中以QJ2和QJ3为优势属,占该组织部位内生细菌总数的42.9%和22.0%,在麻花秦艽花中以QJ2和QJ3为优势属,占该组织部位内生细菌总数的41.9%和36.3%。
表7 麻花秦艽可培养内生菌在各组织部位中的分布(±s)Table7 Distribution of endophytes in Gentiana straminea Maxim at the different parts(±s) cfu/g

表7 麻花秦艽可培养内生菌在各组织部位中的分布(±s)Table7 Distribution of endophytes in Gentiana straminea Maxim at the different parts(±s) cfu/g
菌株叶茎根Q J 1(1.33±0.58)×10 4 00(6.33±4.16)×10 3(3.41±2.01)×10 5 Q J 2(8.90±0.85)×10 4(1.18±0.75)×10 3 Q J 3(1.67±0.58)×10 4(4.57±2.21)×10 4(9.30±1.13)×10 2(1.53±0.28)×10 4 Q J 4(1.77±0.35)×10 4(1.30±0.61)×10 4(1.40±0.61)×10 4(2.83±1.46)×10 2(2.60±0.62)×10 4 Q J 50(3.67±1.15)×10 4 0(0.71±0.23)×10 2 Q J 6(9.67±1.17)×10 3(8.67±1.53)×10 3 0 Q J 70 0(0.20±0.10)×10 2 0 Q J 8(0.19±0.04)×10 2 0(4.43±2.50)×10 3(0.92±0.45)×10 4 Q J 9(0.62±0.15)×10 2 00 Q J 10(1.90±0.66)×10 3 00 0(8.00±3.46)×10 3 Q J 11 00 0 Q J 12 00 00(0.10±0.09)×10 2(1.20±0.79)×10 3 Q I 13 00 0花0
3 结语
近年来关于秦艽内生菌的报道较少,并且主要集中在从秦艽组织中分离纯化一些代谢产龙胆苦苷的微生物菌株。比如:赵强[13]从秦艽的根中分离得到1株产龙胆苦苷的内生真菌根霉QJ18,对QJ18的发酵条件进行优化,筛选出较优的碳源、氮源、温度和pH条件。徐婉如[30]对产龙胆苦苷的秦艽内生真菌进行诱变育种,筛选得到的突变株QJ18-UV-23和QJ18-H-25的龙胆苦苷产量分别是未突变菌株的1.362倍和1.148倍。此外,曾宪军等[15]从麻花秦艽中分离得到了1株产龙胆苦苷的内生真菌腐皮镰刀菌Gj-01,通过发酵培养后积累龙胆苦苷的量为4.13 mg/L。另一方面,内生菌的分布规律可能与宿主本身的特性及内生菌的种类相关,因此在宿主的不同器官中具有不同的分布和结构[31]。在其他药用植物中的研究表明不同组织部位中内生菌多样性存在差异[32-33],比如:对西洋参内生菌多样性研究结果显示西洋参根部的内生菌种类最多,为13属26种,而叶中内生菌最少,仅为9属16种。南药植株高良姜不同组织中内生细菌多样性指数存在显著差异,以根茎最低,叶最高[34]。但是,目前尚没有从不同组织部位去研究秦艽内生菌结构的相关报道。本研究从根、茎、叶、花中共得到细菌10株,经鉴定归属于2门8属;真菌3株,归属于2属。其中茎部分离得到7属,叶部分离得到7属,根部分离得到9属,花部分离得到3属。实验结果探明了麻花秦艽可培养内生菌在其不同组织部位的分布规律。
同时,药用植物活性成分生物合成与植物内生菌的分布有紧密联系,而内生菌群也同样受植物体内活性成分的影响,两者之间存在显著相关性[34-35]。通过研究麻花秦艽可培养内生菌及其优势菌株的数量与龙胆苦苷含量之间的相关性,弄清了可培养内生菌结构与麻花秦艽有效成分龙胆苦苷之间的相关关系。不仅内生细菌和内生真菌数量分别与麻花秦艽植株中龙胆苦苷的含量成极显著正相关(P<0.01), 而且 优 势 内 生 菌 QJ2、QJ6、QJ10、QJ11 和QJ13的数量也分别与麻花秦艽植株中龙胆苦苷的含量成极显著正相关(P<0.01,表7)。根据已有研究报道,内生菌对植物活性成分的产生和积累途径的影响主要有两种方式:一是内生菌能产生外源性诱导子,能快速、专一和选择性地诱导药用植物代谢过程中特定基因的表达,调控药用植物活性成分的生物合成[36];二是由于具有相同活性产物合成途径的相关基因或者在共同生活环境中直接接触而传递遗传物质[37-38]。易培养、生长速度快、生长周期短的自身合成药用植物活性成分的微生物的研究和开发有希望成为解决秦艽资源紧缺和合理开发利用秦艽资源的有效途径之一[15]。本课题组在后续研究中发现细菌QJ3和QJ9的发酵液对大肠杆菌、志贺菌和沙门菌均具有较强的抑制作用,化合物的分离纯化及鉴定工作在进一步研究中,以期获得较高活性或者新的化合物。
目前,关于内生菌对药用植物活性成分的影响仍处在初步探索阶段,相关的研究将为内生菌对药用植物活性成分积累的调控作用提供实践基础。因此,本研究通过对麻花秦艽不同组织部位中进行可培养内生菌的分离与鉴定,为麻花秦艽内生菌资源进行进一步的开发奠定了良好的基础。通过研究麻花秦艽内生菌与其活性成分之间的相关性,有助于深入认识药材活性成分的形成。同时也为药用植物活性成分的生产管理奠定理论和实践基础,如在秦艽的栽培管理中,接种合适的菌肥和提高其内生菌总数量对秦艽活性物质含量的提高将有积极的促进作用。
