生物转化合成N-乙酰神经氨酸的关键因素
2019-10-29朱德强詹晓北吴剑荣郑志永赵忠胜王永远
朱德强,詹晓北,吴剑荣,郑志永,赵忠胜,王永远
(江南大学,糖化学与生物技术教育部重点实验室,江苏 无锡 214122)
唾液酸(Sialic acid)是一类含有9个碳原子并具有吡喃糖结构的酸性氨基糖,又称为神经氨酸,系统名为5-氨基-3,5-二脱氧-D-甘油-D-半乳壬酮糖。唾液酸最初是由Blix和KlenK从颌下腺粘蛋白和脑糖脂中提取出来的,随着3-脱氧-D-甘油-D-半乳壬酮糖(KDN)的发现,唾液酸的定义得到拓展,迄今为止已经发现了50多种[1]。唾液酸在自然界中分布广泛,多发现于后口动物及某些细菌中。唾液酸常常占据细胞膜表面糖链的末端,在细胞粘附、信号传导和细胞分化等生理活动中起到重要作用[2]。N-乙酰神经氨酸(Neu5Ac)是最常见的一种唾液酸,也是多种唾液酸合成的前体物质,与人类健康关系密切[3];Neu5Ac还是抗病毒药物的潜在前体物质,用于治疗H1N1和H5N1流感。此外,Neu5Ac也有很大的营养价值,它能促进婴儿的大脑发育,对维持早产儿脑功能和健康有积极作用[4]。
在前期的研究中,我们构建了一株重组大肠杆菌(E.coliSA-04/pDTrc-AB),通过将GlcNAc-2-epimerase(bAGE)[5-6]和 sialic acid synthase(cNeuB)[7-8]的共表达、GlcNAc跨膜运输系统的修饰以及Neu5Ac分解代谢途径的敲除,使得该重组大肠杆菌能够以胞内磷酸烯醇式丙酮酸(PEP)为能量来源,以GlcNAc为单一底物,生物转化合成Neu5Ac;同时,避免了传统细胞催化合成Neu5Ac需要大量丙酮酸(pyruvate)的缺陷,具有很大经济和环境友好优势。
在该重组大肠杆菌的培养过程中,我们发现菌体大量生长,胞内酶活性保持较高水平,而Neu5Ac合成产率却较低。因此,本研究以重组大肠杆菌E.coliSA-04/pDTrc-AB为对象,考察生物转化环境中的碳源和氮源对重组大肠杆菌生理和Neu5Ac合成的影响,探讨Neu5Ac合成过程中的内在关键限制性因素,以期实现重组大肠杆菌高效快速合成Neu5Ac。
1 材料与方法
1.1 菌株和试剂
重组大肠杆菌E.coliSA-04/pDTrc-AB由本实验室在前期工作中构建:以E.coliK-12 MG1655为出发菌株,敲除其基因组中的nagE基因和manXYZ、nanATEK基因簇,并将来源于Campylobacter jejuniNCTC 11168中的neuB基因(cneuB)和源于Anabaenasp.CH1的 AGE基因(bage)克隆到pTrcc99a载体,分别加上trc启动子实现了2个基因在大肠杆菌中的共表达。
Neu5Ac标准品购自Sigma-Aldrich公司;其他试剂购自上海国药。
1.2 生物转化合成Neu5Ac流程
双阶段生物转化合成Neu5Ac流程见图1。菌体生长阶段,待细胞浓度上升后添加诱导剂IPTG,诱导胞内酶的表达;生物转化阶段,将菌体收集浓缩后悬浮于添加了底物GlcNAc的转化培养基,同时转化培养基中含有必要的营养物质以维持细胞活性。
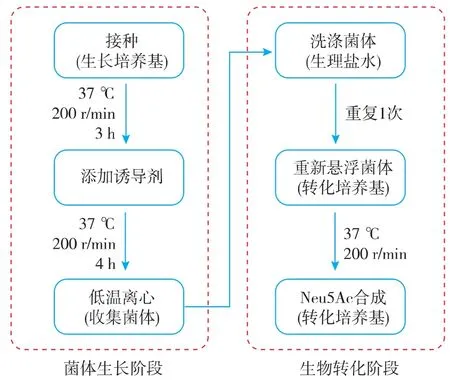
图1 全细胞生物转化合成Neu5Ac流程图Fig.1 Flow chart of whole-cell synthesis of Neu5Ac
1.2.1 菌体生长阶段 在菌体生长阶段,所用培养基为LB培养基(胰蛋白胨10 g/L,酵母5 g/L,氯化钠 10 g/L,pH 7.0),添加氨苄青霉素(终质量浓度 100 mg/L),接种于500 mL摇瓶中,置于37℃摇床(200 r/min)中培养大约3 h,当OD600达到1.2时,添加异丙基硫代半乳糖苷(IPTG)至终浓度0.2 mmol/L。继续震荡培养4 h后,将菌液收集于冰浴中静置10 min,然后低温(4 ℃)8000×g离心 15 min,弃掉上清液,用预冷的生理盐水洗涤菌体2次,待用。
1.2.2 生物转化阶段 将收集到的菌体重新悬浮于50 mL转化培养基(OD600=15),转移至500 mL挡板摇瓶,补加IPTG至终浓度0.2 mmol/L,于37℃摇床200 r/min培养。转化培养基成分为葡萄糖70 g/L或 甘 油 15 g/L,GlcNAc 80 g/L,MgSO41.2 g/L,K2HPO4·3H2O 25.0 g/L,氮源见表 1,pH 7.0。
1.3 分析方法
1.3.1 生物量测定方法 通过测定600 nm波长下的吸光度值来测定生物量。重组大肠杆菌的干质量与吸光度值的换算关系是:1.0 OD600=0.382 g/L细胞干质量。
1.3.2 蛋白质测定方法 采用考马斯亮蓝G250染色法[9]测定,以牛血清白蛋白(BSA)为标准蛋白质绘制拟合曲线。
1.3.3 Neu5Ac测定方法 Neu5Ac通过高效液相色谱(岛津LC2010a)测定。所用色谱柱为伯乐公司的 Aminex HPX-87H column(300 mm × 7.8 mm),柱温为35℃,流动相为5.0 mmol/L硫酸溶液,流速为0.6 mL/min,使用UV检测器,检测波长是196 nm。1.3.4 NeuB活性测定方法 在前期的实验中,我们发现AGE的活性远高于NeuB,因此NeuB的活性大小对Neu5Ac的合成具有更大的影响;于是在后续的实验中,我们重点关注NeuB的活性,其测定方法如下:将发酵液样品低温(4℃)离心(10000g,5 min),弃掉上清液后,用预冷的生理盐水洗涤2次,重新悬浮于生理盐水中,超声波破碎(破碎时间:4 s;暂停时间:10 s;共计时间:20 min),低温离心,收集上清作为粗酶液。
NeuB活性以ManNAc向Neu5Ac的转化速率来定义。酶活测定体系(1.0 mL)为Tris-HCl 0.1 mol/L pH 7.0,10 mmol/L MnSO4,50 mmol/L ManNAc,50 mmol/L PEP,添加20 μL酶液。将反应体系置于37℃水浴20 min后,沸水浴10 min终止反应。1 min内催化合成1 nmol Neu5Ac所需的酶量定义为1 U。
2 结果与讨论
2.1 双阶段生物转化合成Neu5Ac过程
菌体生长阶段,在IPTG的诱导下,源于Anabaenasp.CH1的 AGE基因(bage)和源于C.jejuniNCTC 11168中的neuB(cneuB)在重组大肠杆菌中共表达。在生物转化阶段,外源的GlcNAc在bAGE的催化下,异构化形成ManNAc;继而在cNeuB 的催化下,与胞内的 PEP 合成 Neu5Ac[8,10]。在此生物转化过程中,不需过量的外源丙酮酸(pyruvate)供给;但需要消耗胞内的PEP。为提高生物转化阶段的菌体活性,以LB培养基为基础添加GlcNAc作为生物转化阶段的培养基(标记为LB+培养基,如表 1所示),过程曲线见图 2(a)。
在生物转化阶段的初始阶段,生物量和胞内NeuB活性经历一个短暂且迅速的下降。这可能是由于在菌体收集与洗涤过程中,在剪切力的影响下,部分细胞的细胞壁受到损伤,同时也伴随着细胞的自然死亡;同时在经历冰浴和低温离心之后,细胞的活性没有完全复苏,因此在转化过程的初期出现生物量下降的现象;而同时,Neu5Ac却迅速合成。在经历4 h的适应期后,生物量和胞内NeuB活性迅速上升;但在此时期内,Neu5Ac的合成速率较低,其积累基本停滞,在生物转化过程结束后,产量仅为(0.38±0.08)g/L。胞内NeuB活性在4 h后显著上升,但Neu5Ac的合成速率不升反降,且其下降的时间节点与生物量开始增加的时间节点一致。因此推测,胞内NeuB活性不是Neu5Ac合成的瓶颈,而在于底物或能量的供给,而此供给受到了细胞自身生长的抑制。
2.2 氮源对全细胞生物转化合成Neu5Ac的影响
氮源是大肠杆菌生长不可或缺的营养物质,为探究Neu5Ac合成速率下降与细胞生长之间的内在联系,我们通过调整转化培养基中的氮源种类来控制菌株的生长状态,分别考察有机氮(胰蛋白胨)和无机氮(硫酸铵)为氮源时细胞的生长和Neu5Ac的合成。转化培养基的成分如表1所示。

表1 转化培养基名称与成分构成Table1 Nitrogen sources of catalysis medium
2.2.1 胰蛋白胨作为氮源对重组大肠杆菌合成Neu5Ac的影响 以Typ培养基作为转化培养基时的转化过程曲线见图2(b)。与LB+培养基作为转化培养基时类似:生物转化过程的前4 h,生物量与胞内NeuB活性迅速下降,而Neu5Ac迅速合成,将此阶段命名为生物量迅速下降期。4 h后,生物量和胞内NeuB活性停止迅速下降,转而趋于稳定,同时Neu5Ac依然维持较高的合成速率,至12.5 h时,Neu5Ac合成量为(0.51±0.07) g/L,将此阶段命名为Neu5Ac快速合成期。12.5 h后,重组大肠杆菌构建起了在转化培养基中生长所需要的酶系,生物量开始迅速上升,到生物转化阶段结束时,生物量达到(8.17±0.18)g/L,高出初始值 40%;由于转化培养基中添加了诱导剂IPTG,因此重组大肠杆菌能够重新合成NeuB,使得胞内NeuB活性维持在较高水平。然而,12.5 h后,Neu5Ac的合成速率没有随胞内NeuB活性升高而升高,却维持在较低水平,至生物转化阶段结束时,终质量浓度仅为(1.01±0.06)g/L。此阶段时间占总转化合成过程的80%,而Neu5Ac合成量却仅占总量的49.5%,将此阶段命名为Neu5Ac慢速合成期。
2.2.2 硫酸铵作为氮源对重组大肠杆菌合成Neu5Ac的影响 以IS培养基为转化培养基时的合成过程曲线如图2(c)所示。生物转化合成Neu5Ac过程经历了明显的生物量迅速下降期、Neu5Ac快速合成期和Neu5Ac慢速合成期。而进入Neu5Ac快速合成期后,与有机氮作为氮源不同的是,生物量的下降趋势虽有减弱但依然处于下降趋势,在此阶段的16 h内,生物量下降了1.30 g/L,胞内NeuB活性也同步下降。Neu5Ac以较高速率合成,在16.5 h内积累量达(0.88±0.07)g/L。相较 Typ培养基,IS培养基中重组大肠杆菌需要更长的时间构建细胞生长所需要的酶系,生物量开始回升的节点比Typ培养基中更迟,在20.5 h后,合成过程进入Neu5Ac慢速合成期:生物量停止下降,迅速回升,到生物转化阶段结束,生物量达到(7.63±0.19)g/L,高出初始值达22.9%;而Neu5Ac的积累速度迅速下降,并维持较低的合成速率直至生物转化过程结束,Neu5Ac的终质量浓度为(1.20±0.04) g/L。

图2 在不同转化培养基中重组大肠杆菌生物转化合成唾液酸Fig.2 Fermentation curve of Neu5Ac production in medium with different nitrogen sources for recombination E.coli
2.2.3 重组大肠杆菌在无氮培养基中合成Neu5Ac
Neu5Ac分子中的氨基,来源于转化底物GlcNAc,本文所述的无氮源条件是指不添加除GlcNAc之外的氮源。无氮源条件下的Neu5Ac生物转化合成过程也可以分成3个阶段:生物量迅速下降期、Neu5Ac快速合成期和Neu5Ac慢速合成期。在3种不同氮源的转化培养基中,无氮培养基中的Neu5Ac快速合成期持续时间更长,达到35 h,占总转化过程时间的55.6%,分别是Typ培养基和IS培养基的8.75和2.19倍,此阶段结束时,Neu5Ac质量浓度达到为(1.79±0.11)g/L。虽然不同条件下Neu5Ac快速合成期持续的时间不一致,但此时期Neu5Ac的比合成速率基本一致(如表2所示),说明即使在不同的转化条件中,处于Neu5Ac快速合成期的重组大肠杆菌的生理状态基本一致,处于有利于Neu5Ac合成的状态。而进入Neu5Ac慢速合成期后,重组大肠杆菌生理状态发生的改变,成为Neu5Ac合成的关键限制性因素。除Neu5Ac快速合成之外,此时期的另外一个特征便是前一时期生物量迅速下降的趋势得到缓解甚至维持相对稳定。
在无氮培养基中,Neu5Ac合成速率下降拐点出现在39 h,转化过程进入Neu5Ac慢速合成期,生物量开始缓慢上升,转化过程结束时生物量仅为(4.96±0.28) g/L, 比初始值(5.93±0.08 g/L)略低;Neu5Ac合成速率的下降幅度远小于氮源存在时的下降幅度,在生物转化过程结束时,Neu5Ac终质量浓度达到(2.04±0.08)g/L。由于转化培养基中除GlcNAc外不含其他氮源,而重组大肠杆菌的GlcNAc-PTS已被敲除而无法利用GlcNAc进行细胞生长[11],因此重组大肠杆菌只能依赖前期细胞衰亡破裂后释放出的少量氮源进行微弱的生长。综合LB+培养基、Typ培养和IS培养基中Neu5Ac合成过程曲线,可以看到,细胞的生长与Neu5Ac的合成存在紧密的负相关关系:Neu5Ac合成速率下降的拐点与生物量上升的拐点吻合;细胞生长越快,对Neu5Ac合成的抑制作用越早越明显。在生物转化和发酵过程中,尤其对于产物合成过程需要消耗大量能量时,细胞的生长常与产物的合成互相抑制,胞内能量供应相对不足。李晶等[12]在土壤杆菌ATCC 31749发酵产热凝胶过程中采用了氮源限制的双阶段发酵法,在菌体生长阶段提供充足的氮源,生物量迅速增加但产胶量极低;待氮源耗尽后不再流加氮源,菌体停止生长,转而开始大量合成热凝胶。代谢流分析实验表明,当碳限制条件转为氮限制后,由于碳源的补充而使得细胞经历了短暂的快速生长期,在此时期胞内的pyruvate含量大幅增加,PEP相应减少;此后由于氮源的限制,细胞停止生长,胞内的pyruvate含量减少,PEP相应增加[13]。具体到Neu5Ac的合成过程中,细胞的生长消耗胞内PEP[14],细胞的快速生长会导致胞内PEP相对不足,流向Neu5Ac合成的PEP减少,抑制Neu5Ac的合成。因此,我们可以得出结论:氮源本身不是Neu5Ac合成的关键因素,通过限制生物转化阶段的氮源抑制细胞自身的生长,减少了胞内PEP的消耗使得更多的PEP流向Neu5Ac合成,促进了Neu5Ac的合成。

表2 重组大肠杆菌在不同转化培养基中合成Neu5Ac的对比Table2 Comparison of different medium for Neu5Ac production in recombination E.coli
2.3 不同类型碳源对全细胞生物转化合成Neu5Ac的影响
从第2.2节和第2.3节可以得出结论,胞内PEP供给不足是Neu5Ac高效快速合成的瓶颈,增加PEP的供给对于Neu5Ac产量的提高有重要意义。在大肠杆菌中,通过代谢转化培养基中的葡萄糖,糖酵解和糖异生途径产生PEP[15]。而葡萄糖的跨膜运输主要依赖于磷酸转运系统(PTS),在跨膜的同时会消耗PEP从而磷酸化生成葡萄糖-6-磷酸。这对于大肠杆菌的生长具有重要意义;然而由于该过程会与Neu5Ac的合成竞争胞内的PEP,因而可能对于Neu5Ac的合成具有不利影响。因此,我们选择不依赖于PTS系统的甘油为碳源,对比分析两种碳源对重组大肠杆菌全细胞生物转化合成Neu5Ac的影响。
甘油培养基中生物转化合成Neu5Ac过程曲线如图3所示。与上述几种条件类似,转化过程可以分为3个不同阶段。在生物量迅速下降期和Neu5Ac快速合成期,Neu5Ac比合成速率达到0.030 h-1,是其他条件的2~3倍。39 h后,重组大肠杆菌适应了转化培养基环境后开始生长,加之胞内NeuB活性下降,导致转化过程进入Neu5Ac慢速合成期,Neu5Ac比合成速率下降(如图4所示)。到转化过程结束,Neu5Ac质量浓度达到(4.42±0.08) g/L。甘油为碳源时,其跨膜运输不依赖于PTS,因此不消耗胞内的PEP,从而使得更多的PEP流向Neu5Ac合成的方向,从而在生物量相同的条件下,提高了Neu5Ac的比合成速率,最终Neu5Ac合成量比无氮培养基中高出111.3%,比初始条件(LB+培养基)高出10.3倍。此外,培养基中甘油的存在对增强细胞膜的流动性和通透性也有促进作用,有利于底物GlcNAc进入胞内和产物Neu5Ac向胞外分泌。
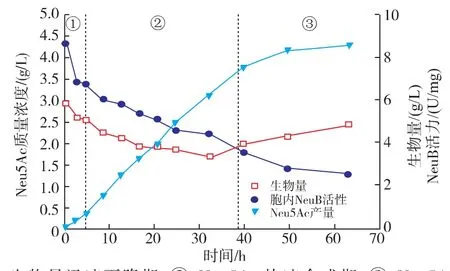
图3 甘油培养基对重组大肠杆菌合成唾液酸的影响Fig.3 Effects of glycerol medium on Neu5Ac production in recombination E.coli
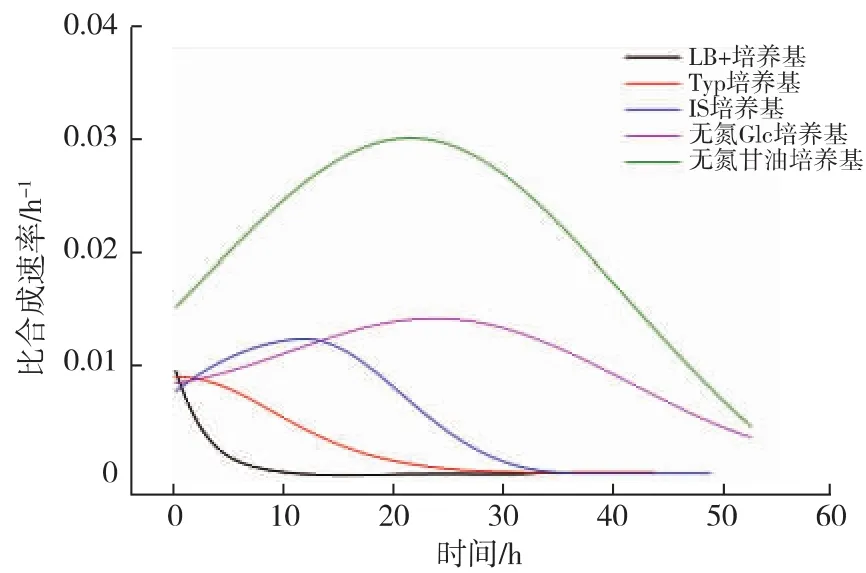
图4 不同转化培养基中的Neu5Ac比合成速率Fig.4 Specific production rates of Neu5Ac in different medium
目前,有多种合成Neu5Ac的方法,其中产量最高的方法,首先底物GlcNAc在GlcNAc异构酶催化下生成生成ManNAc,而后ManNAc和pyruvate在Neu5Ac醛缩酶的催化下合成Neu5Ac,该方法16 h合成Neu5Ac产量可达74.2 g/L[16]。由于Neu5Ac醛缩酶催化的可逆反应的反应平衡偏向于Neu5Ac裂解成ManNAc和pyruvate,因此在上述方法中需要添加过量的pyruvate(通常至少5倍),这也导致了pyruvate的浪费和额外的环境压力。本研究中所用的方法虽然产量不如上述方法,但由于Neu5Ac合成酶催化合成Neu5Ac时以胞内PEP为底物,以高能磷酸键为推动反应进行的动力,不需要额外过量的pyruvate。该方法经过优化后,可作为一种环境友好且高效的Neu5Ac合成方法。
3 结语
我们发现,在全细胞生物转化合成Neu5Ac过程中,胞内PEP的供给是Neu5Ac高效快速合成的瓶颈。当重组大肠杆菌自身生长时,会消耗胞内大量的PEP从而竞争性抑制Neu5Ac的合成。改用不含氮源的转化培养基,提高了Neu5Ac的合成效率。此外,通过改用不依赖PTS转运系统的甘油作为碳源,避免了碳源物质跨膜运输过程中PEP的消耗,大幅提高了Neu5Ac的比合成速率,终质量浓度达到(4.42±0.08) g/L。
