18F-FDG PET/CT体积及肿瘤异质性参数对宫颈癌临床分期、病理类型及预后预测价值的研究
2019-10-26姚稚明陈聪霞
郭 悦 姚稚明 陈聪霞 陈 敏
宫颈癌是女性最常见的恶性肿瘤之一,在世界范围内,每年新发病例数为46万例[1]。我国1989~2008年宫颈癌发生率总体呈上升趋势,其发生率和病死率逐年升高。宫颈癌早期无明显临床症状,往往出现症状时诊断已到晚期,失去最佳治疗机会。因此,早期发现肿瘤、及时疗效评估成为宫颈癌治疗的关键。
18F-FDG PET/CT在宫颈癌的治疗前分期、术后再分期、疗效监测及预后评估等方面发挥越来越重要的作用。最大标准摄取值(maximum standardized uptake value, SUVmax)是临床最常用的半定量参数,但SUVmax容易受噪声的影响,且不能反映肿瘤的整体代谢水平,有文献指出SUVmax在预测宫颈癌的淋巴结转移或预后评估方面价值有限。
反映肿瘤体积的定量分析代谢参数,例如肿瘤代谢体积(metabolic tumor volume,MTV)和糖酵解总量(total lesion glycolysis,TLG),近年来越来越得到重视。一些Meta分析已指出这些基于体积的代谢参数在多种恶性肿瘤的预后评估方面非常有前景,如头颈部肿瘤和肺癌[2,3]。但这些基于体积的参数与宫颈癌的预后之间的关系国内外未见大规模的报道[4]。
肿瘤异质性是恶性肿瘤的一个普遍特征,也是近年来影像学分析的研究热点。使用变异系数(coefficient of variation, COV)这个半定量参数来评价肿瘤FDG摄取的异质性,在鼻咽部癌、非小细胞肺癌、前列腺癌及直肠癌等恶性肿瘤已有所应用[5~8]。这种半定量分析方法简便易行,并与其他定量分析方法有很好的相关性。但将COV用在宫颈癌的预后评估上,目前研究尚少,尤其是国内尚未见报道。
本研究回顾性分析宫颈癌患者治疗前18F-FDG PET/CT的各项代谢参数,包括SUVmax、SUVavg、MTV、TLG及COV等,探讨上述参数与宫颈癌的临床分期、病理类型、预后预测等方面的关系,比较各参数间对宫颈癌临床病理特征及预后判断的预测能力,特别是基于体积的参数MTV、TLG及肿瘤异质性参数COV,是否能作为SUV值的补充或替代,给宫颈癌临床决策及个体化治疗提供更多有价值的信息。
对象与方法
1.研究对象:2008年3月~2018年10月于笔者医院中心行18F-FDG PET/CT的宫颈癌患者。纳入标准:①原位病灶均经阴道镜活检或手术病理学证实;②治疗前3周内于行18F-FDG PET/CT检查。排除标准:①在PET/CT检查前接受过治疗;②之前或同时诊断有其他恶性肿瘤;③失访。共有47例患者纳入研究。
2.PET/CT扫描:仪器为德国Siemens Biograph 16 PET/CT仪(2011年2月前)及Siemens mCT PET/CT仪(2011年2月后)。18F-FDG由北京原子高科股份有限公司提供,放化纯>95%。患者禁食4~6h以上,血糖<10mmol/L,按体重静脉注射18F-FDG 7.77MBq/kg或5.18MBq/kg,避光、安静休息60min后行PET/CT显像。先行CT扫描,电压120kV,电流120mA,层厚5mm或3mm。PET扫描采用三维模式,范围从颅底至股骨上段,2~3分钟/床位,共5~7个床位。利用CT扫描数据对PET图像进行衰减校正,使用有序子集期望最大化(OSEM)迭代法进行图像重建,获得横断面、矢状面和冠状面的PET和CT图像。
3.图像分析:PET/CT图像分析在Siemens 工作站进行。所有参数都应用三维感兴趣区体积(volume of interest, VOI)进行测量。在宫颈病灶处勾画VOI,以感兴趣区内SUVmax的40%自动勾画肿瘤边界[9]。在轴位、冠状位和矢状位PET、CT和融合图像上观察肿瘤边界,必要时进行手动微调以避开邻近FDG高摄取区域,如膀胱和周围肠道(图1)。记录下列参数:SUVmax, SUVavg,肿瘤最大径(Dmax)定义为VOI内最大截面的最长径(cm),MTV(cm3),TLG(g),肿瘤的代谢异质性参数COV定义为肿瘤VOI中SUVmax的标准差(standard deviation,SD)与SUVavg的比值并乘以100(SD/SUVavg×100)[6]。每处病灶勾画3次,取平均值为各项参数的最终数值。
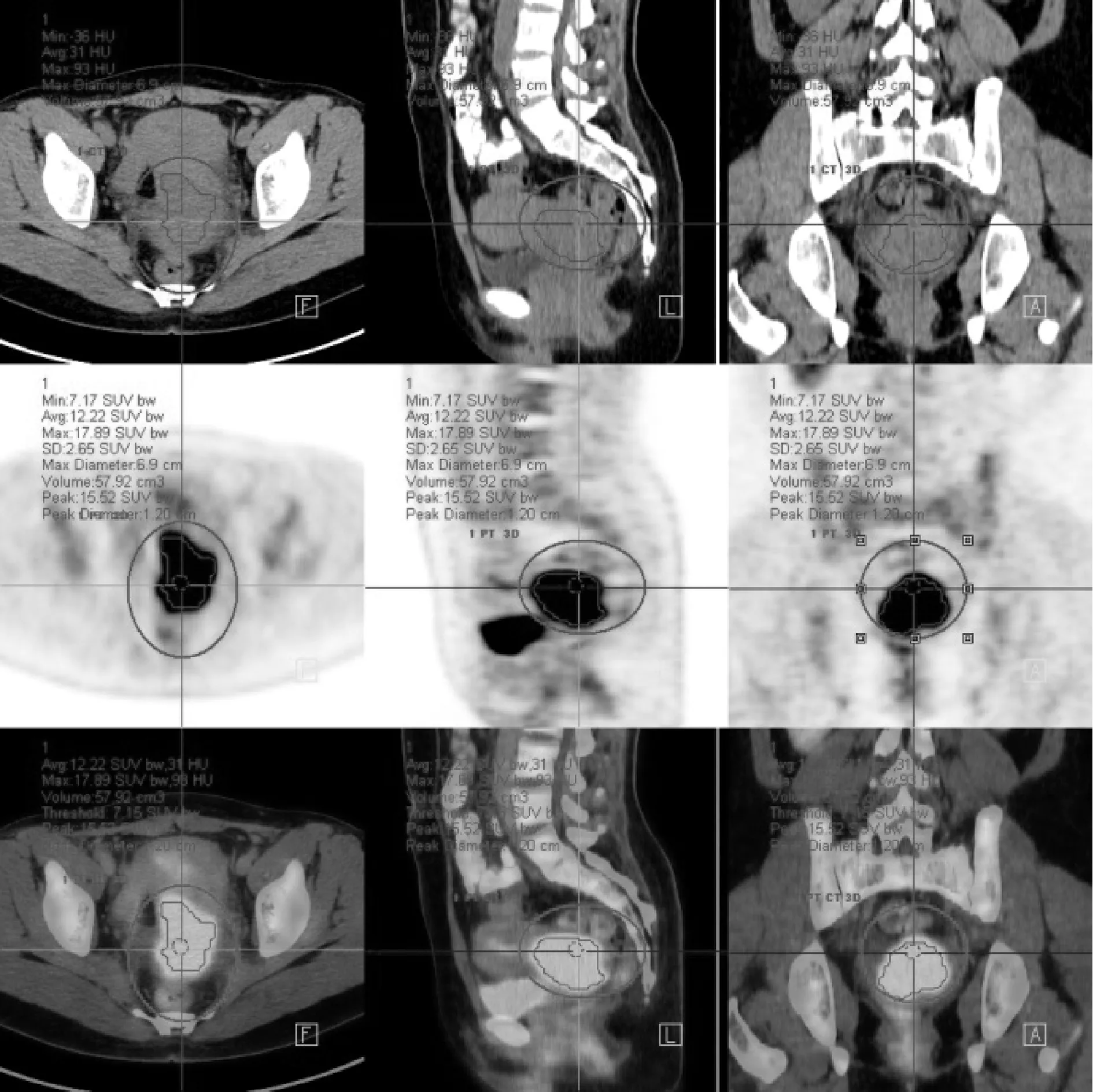
图1 VOI勾画
4.随访数据:以医院HIS、PACS系统及电话方式对患者进行随访。肿瘤进展定义为随访影像学或病理学证实肿瘤的局部复发、淋巴结转移及远处转移。无进展生存(progression-free survival,PFS)时间定义为18F-FDG PET/CT检查时间至第一次有病理或影像学证实疾病进展或死亡的时间间隔。总生存(overall survival, OS)时间定义为18F-FDG PET/CT检查时间至患者因疾病死亡或随访截止的时间间隔。

结 果
1.患者的临床病理及随访结果:47例患者中,有12例(25.53%)接受了手术治疗,其中7例术前或术后辅以放、化疗;29例(61.70%)行同步放、化疗;其余10例中两例接受髂内动脉介入热灌注及子宫动脉栓塞术,8例单纯行放疗或化疗。随访时间为1.5~133.0个月,中位随访时间17.3个月。34例(72.34%)患者在研究截止日期存活,13例(27.66%)患者因宫颈癌死亡。47例患者中,有20例(42.55%)在随访过程中出现疾病进展,其中4例为宫颈肿瘤复发或较前进展,8例新出现淋巴结转移,6例出现肺转移,1例左肾转移(病理证实),1例腹膜转移。中位无进展生存时间为13.3个月,中位生存时间为17.3个月,详见表1。
2.宫颈原发灶18F-FDG PET/CT各项代谢参数与临床分期及病理类型的关系:鳞癌组的代谢异质性参数COV低于非鳞癌组,差异有统计学意义[(21.65±1.86) vs (24.38±1.76),t=-3.079,P=0.009],其余参数包括SUVmax、SUVavg、肿瘤最大径、MTV、TLG比较,差异无统计学意义。按照FIGO分期将患者分为早期(FIGOⅠ~Ⅱ期)和晚期(FIGO Ⅲ~Ⅳ期),早期组和晚期组的Dmax、MTV、TLG和COV比较,差异有统计学意义(P均<0.05),而SUVmax、SUVavg比较,差异无统计学意义,详见表2。用ROC曲线评价COV对宫颈癌病理类型及临床分期的预测能力,如图2所示,AUC分别为0.768(P=0.008)和0.725(P=0.011)。用ROC曲线评价Dmax、MTV、TLG对临床分期的预测能力,如图3所示,AUC分别为0.725(P=0.011)、0.712(P=0.017)和0.676(P=0.046)。

表1 患者一般资料及临床病理特征
3.生存分析:(1)PFS:疾病无进展组的COV(n=27,22.91±2.42)大于疾病进展组(n=20,21.44±2.08),差异有统计学意义(t=2.181,P=0.034);进展组的MTV(35.09cm3, 50.13~14.95cm3)大于无进展组(15.65cm3, 23.07~8.11cm3),且差异有统计学意义(Z=-2.604,P=0.009)。SUVmax、SU Vavg、Dmax及TLG之间比较,差异无统计学意义。用ROC曲线评价各参数对PFS的预测效能并确定最佳临界值,如表3所示,MTV的曲线下面积AUC(0.724)大于其他各参数,表示其预测效能高于其他各参数。单因素COX回归分析结果见表4。单因素分析结果显示,FIGO分期(Ⅲ~Ⅳ期)、MTV(≥33.12cm3)、TLG(≥324.10g)、Dmax(≥4.65cm)和COV(≤22.73)与疾病进展呈显著相关(P值分别为0.001、0.004、0.030、0.045、0.009);多因素COX回归分析显示FIGO分期和MTV是PFS率的独立预测因子(P=0.003和0.030)。独立因素组间的PFS率Kaplan-Meier生存曲线比较如图4所示。MTV<33.12cm3和FIGO Ⅰ~Ⅱ期的PFS率显著高于MTV≥33.12cm3和FIGO Ⅲ~Ⅳ期(P=0.002和P=0.000)。(2)OS:存活组(n=34)的COV(22.82±2.38)高于死亡组(n=13)的COV(20.88±1.77),差异有统计学意义(t=2.663,P=0.110),死亡组的MTV(中位数43.21cm3vs 16.51cm3)和TLG(中位数355.74g vs 145.70g)显著高于存活组,Z值分别为-2.735和-2.450,P值分别为0.006和0.014。用ROC曲线评价各参数对OS的预测效能并确定最佳临界值,如表3所示。MTV的曲线下面积AUC(0.760)大于其他各参数,表示其预测效能高于其他各参数。单因素COX回归分析结果见表5。单因素分析结果显示,FIGO分期(Ⅲ~Ⅳ期)、MTV(≥38.97cm3)、TLG(≥324.10g)、Dmax(≥5.80cm)和COV(≤22.06)与OS率显著相关(P值分别为0.003、0.001、0.003、0.018、0.013);多因素COX回归分析显示FIGO分期和MTV是PFS率的独立预测因子(P=0.023,0.016)。OS的Kaplan-Meier生存曲线比较如图5所示。MTV<38.97cm3和FIGO Ⅰ~Ⅱ期的PFS率显著高于MTV≥38.97cm3和FIGO Ⅲ~Ⅳ期(P均=0.000)。
表2 宫颈原发灶18F-FDG PET/CT上各项参数与病理及临床分期的关系
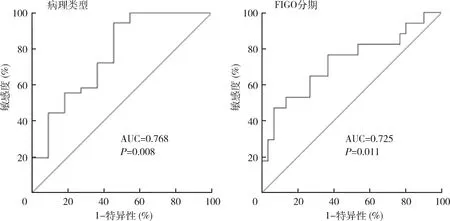
图2 ROC曲线评价COV对宫颈癌病理类型及临床分期的预测效能
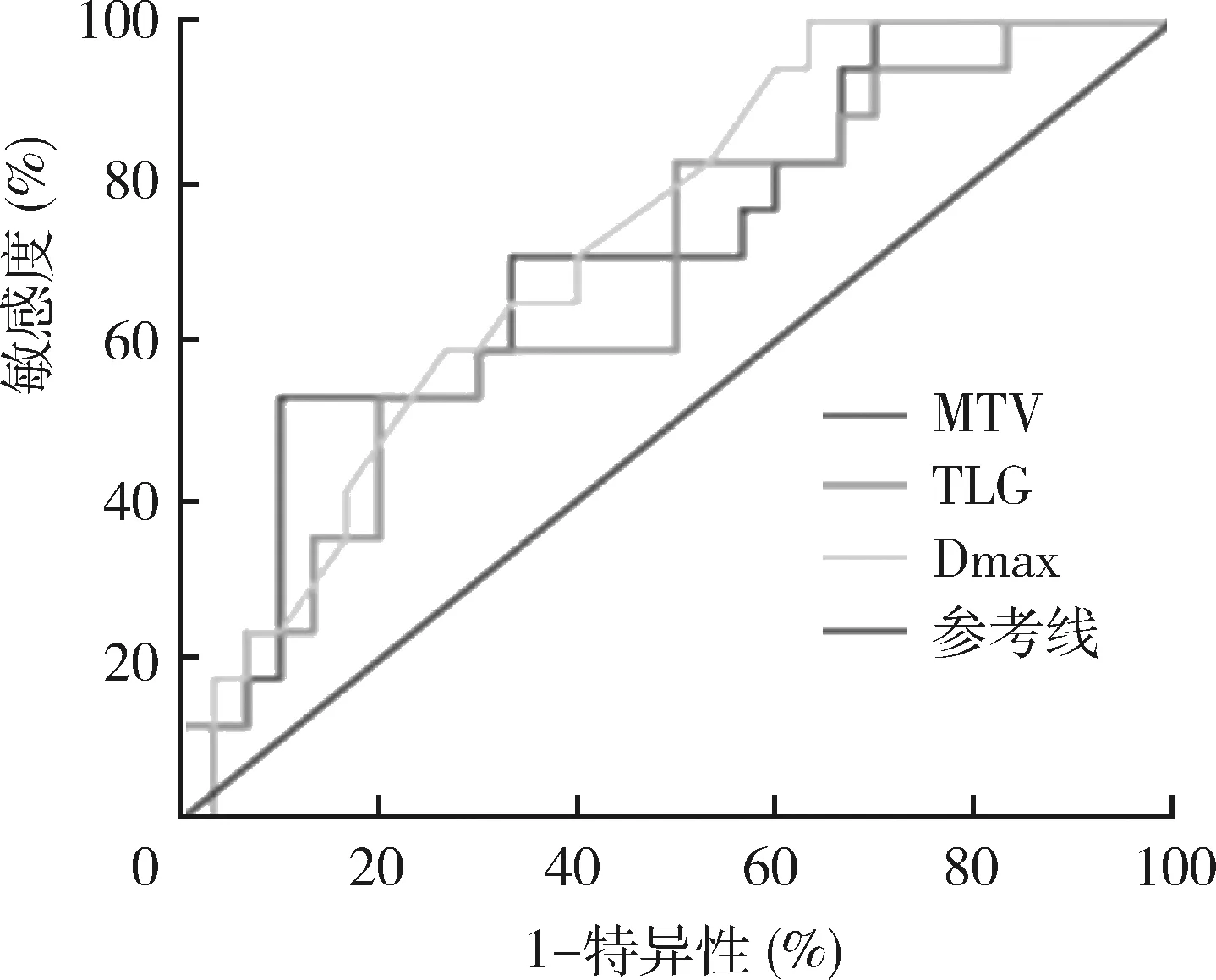
图3 ROC曲线评价Dmax、MTV、TLG对临床分期的预测效能
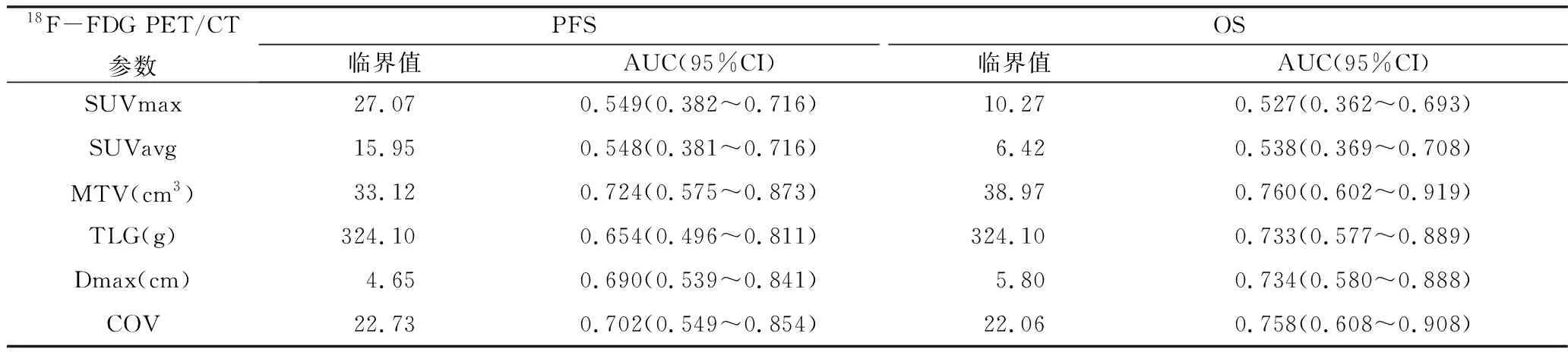
表3 ROC分析各参数对PFS和OS的预测效能及最佳临界值
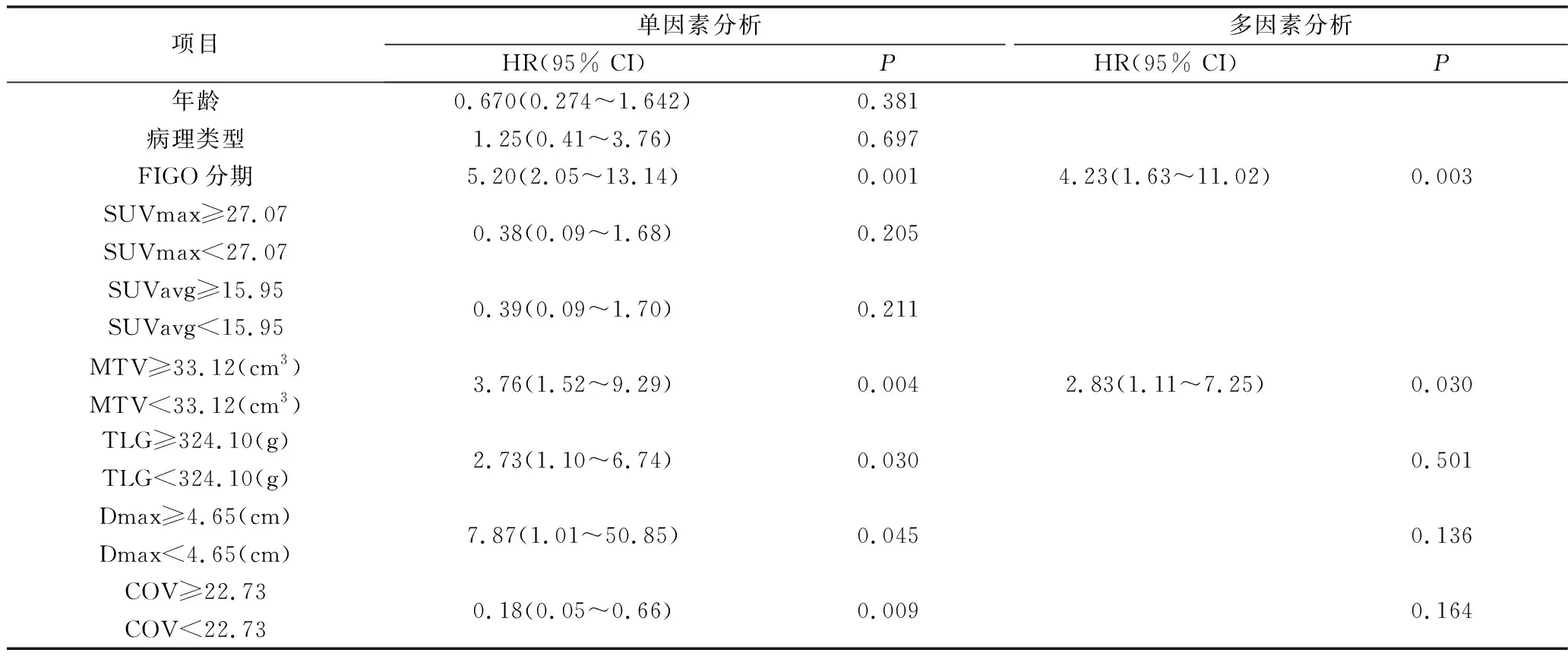
表4 单因素及多因素COX回归分析预测PFS
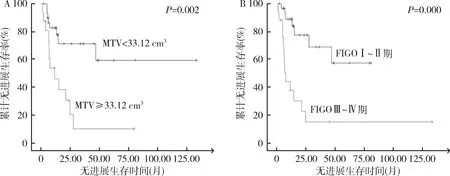
图4 PFS的独立预测因子的组间生存曲线比较A.MTV;B.FIGO分期
讨 论
宫颈癌是继乳腺癌后位居第2位的女性常见恶性肿瘤。根据2016年世界卫生组织的统计数据,每年全球有超过47万新发的宫颈癌病例。作为发展中国家的中国约占其中的28%,并预计直至2025年,亚洲的宫颈癌发生率将上升约40%。公认的宫颈癌复发及死亡风险因素包括FIGO分期、肿瘤直径、间质浸润深度及淋巴结转移等。病理诊断-临床分期-治疗决策是标准的宫颈癌诊疗模式,其中临床分期是关键,本研究结果也说明了这一点,无论是预测疾病进展或生存,FIGO分期都是独立危险因素。但FIGO分期也有一定的局限性,如判断宫旁浸润的准确性及未纳入淋巴结转移这一重要预后因素,与手术病理分期比较,约有20%~40%的患者分期被高估或低估[11]。因此,在宫颈癌的诊疗中,需要探索更多的预后影响因素,对患者进行综合评估,从而使治疗更加个体化,更加精准。
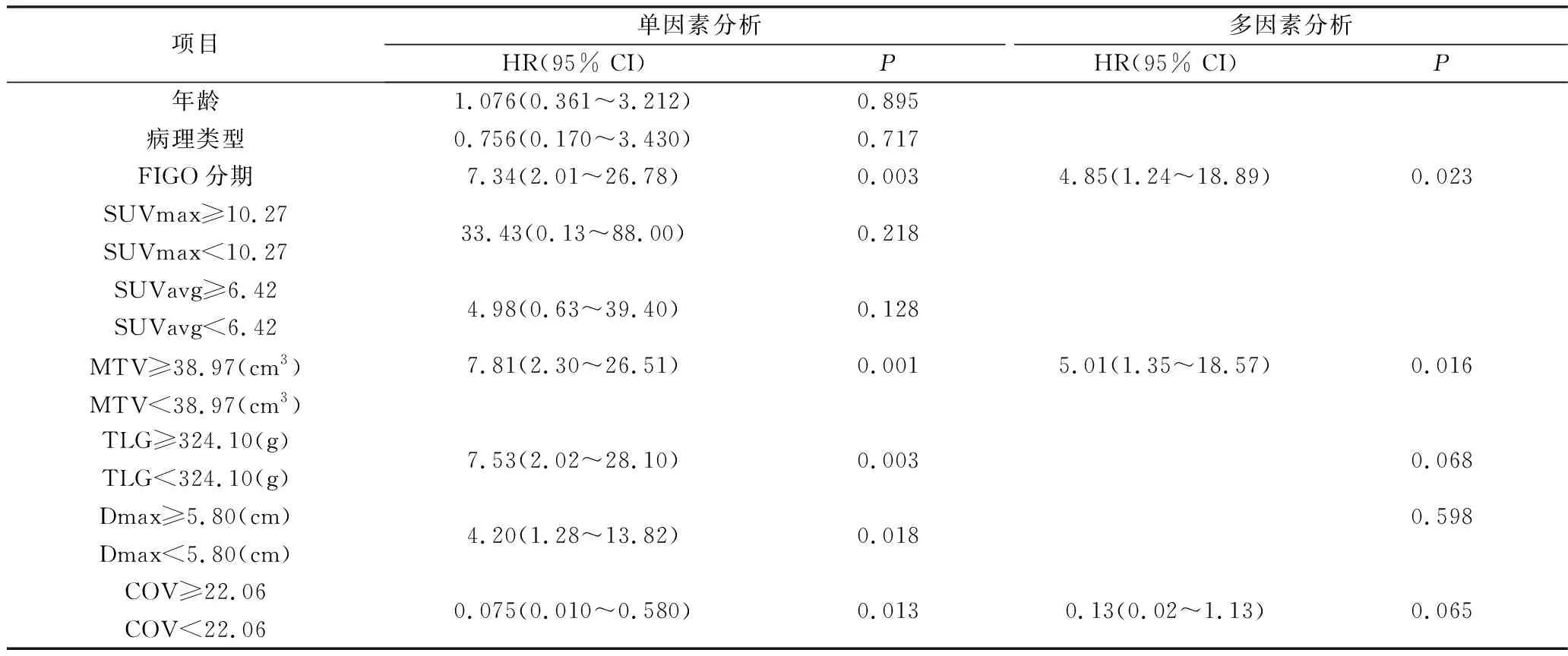
表5 单因素及多因素COX回归分析预测OS
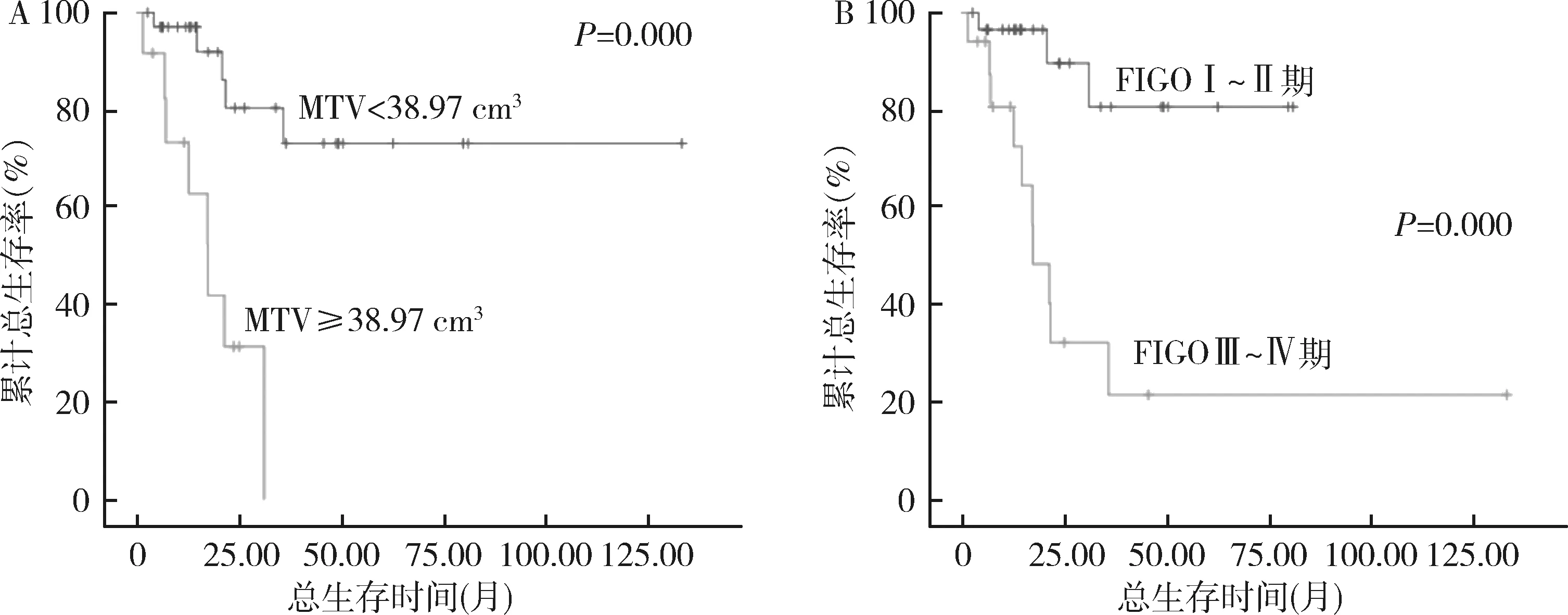
图5 OS的独立预测因子的组间生存曲线比较A.MTV;B.FIGO分期
18F-FDG PET/CT在宫颈癌的术前分期、疗效评估等方面发挥着越来越重要的作用。本研究回顾性分析了基于18F-FDG PET/CT的几个代谢参数,即SUVmax、SUVavg、MTV、TLG等对47例ⅠB~ⅣB期宫颈癌患者的预后影响,结果显示,在上述参数中,反映肿瘤代谢体积的MTV是无进展生存率和总生存率的独立危险因素,MTV越大,意味着肿瘤进展或死亡的风险越高。而临床最常用的SUVmax或SUVavg,与肿瘤预后的关系,反而没有那么密切,这与多项研究的结果类似。Miccò等[12]分析了49例ⅠB~ⅣB期宫颈癌患者的治疗前18F-FDG PET/CT、MRI和临床资料,结果显示,FIGO分期、淋巴结转移、ADCmean和MTV是OS和无病生存(disease free survival, DFS)的危险因素,SUVmax与DFS和OS无显著关系。Ueno等[9]对21例局灶进展期宫颈癌并接受同步放化疗的患者的影像数据进行回顾性分析,结果显示,对治疗无响应组的MTV和TLG显著高于治疗响应组,MTV和TLG是无进展生存的独立预测因子。原因可能是,SUVmax是基于单个体素的测量,并没有把原发肿瘤的整体代谢情况考虑进去;而MTV参数是基于体积的测量,是SUV值在预设阈值以上的所有体素的总和,TLG则结合了体积和相应区域内FDG摄取的平均情况,测量了“代谢活跃”部分的肿瘤,并能够提供有用的预后信息。当然,之前也有研究表明宫颈癌原发病灶的SUVmax是预后因素[13,14]。这些结果的差异也许是因为治疗方式的偏差,由于疾病分期的不同,治疗模式也不同。考虑到肿瘤内部FDG代谢的异质性,现在的研究只关注SUVmax相对比较单纯,也有局限性。因此在临床工作中,可以考虑将基于体积的上述参数也写入到日常报告中,给临床医生提供更全面的评估信息。
关于18F-FDG PET/CT各项代谢参数与病理类型之间的关系,张婧等[15]对41例宫颈癌患者的研究表明,宫颈鳞癌患者的SUVmax显著高于腺癌,34例鳞癌患者高、中、低分化者的SUVmax之间也存在差异,提示不同组织类型及相同组织类型不同分化程度的宫颈癌的标准摄取值不同。但本研究中,鳞癌组的SUVmax虽然较与非鳞癌组高,但差异无统计学意义,可能与病理类型的种类不同有关,在本研究中,非鳞癌组除了腺癌外,还有部分腺鳞癌和癌肉瘤。鳞癌的标准摄取值较高的原因,可能是鳞癌组织细胞的膜转运蛋白及糖酵解活性较强,尤其是肿瘤细胞膜葡萄糖转运蛋白1(GLUT-1)高度表达。腺癌由于肿瘤内含有大量黏液腺体成分,细胞成分相对偏少,且癌细胞表面GLUT-1表达相对缺乏,从而导致FDG摄取偏低。有研究表明FIGO ⅡB~ⅣB患者原发肿瘤的SUVmax、MTV和TLG显著高于FIGO ⅠB~ⅡA患者[12]。本研究结果也与上述研究类似,FIGOⅠ~Ⅱ期患者的MTV、TLG显著低于FIGO Ⅲ~Ⅳ期患者,但SUVmax和SUVavg比较差异无统计学意义,也再一次佐证了之前的观点,基于体积的MTV、TLG等参数可能较SUVmax等参数更为敏感。
肿瘤细胞的异质性能够在很大程度上影响患者对抗肿瘤治疗的特异性响应。PET可以提供细胞代谢、受体密度、细胞表面结构等信息,在显示肿瘤异质性方面有着良好的前景。肿瘤对FDG摄取的异质性,其原因与肿瘤的组织成分、灌注、细胞增殖、坏死、侵袭性、微血管密度或乏氧状态有关,反映为PET图像中像素灰度分布的差异,且研究发现这种代谢的异质性与多种肿瘤的临床预后相关,包括宫颈癌[16]。但目前还没有能够客观量化肿瘤异质性的标准化方法并应用于临床,且所用评价方法都较为复杂。于是,便有研究者提出变异系数COV的概念,此方法简便易行,且与其他方法所测得的异质性有很好的相关性,已用在多种肿瘤的预后评估及疗效预测方面,但在宫颈癌方面国内外研究均甚少[5~8]。本研究结果显示,无论是在病理类型(鳞癌vs非鳞癌)、FIGO分期(Ⅰ~Ⅱ期 vs Ⅲ~Ⅳ期),还是在无进展生存(进展vs无进展)及总生存(生存vs死亡)方面,组间比较COV差异有统计学意义,虽然并不是PFS和OS的独立影响因子,但对OS的预测P值也有0.065,表明还是有潜在的预测能力,在一定程度上也可以说明COV这个参数较为敏感,也许是非常有前景的、表现肿瘤代谢异质性的参数之一,有潜在的应用价值,可以作为传统参数的补充或替代。Pahk等[6]用COV预测非小细胞肺癌的N2淋巴结转移,发现其预测效能显著高于SUVmax、MTV和TLG,且是N2淋巴结转移的独立预测因子。但也有研究呈现了相反的结论:Brooks等[17]认为,FDG摄取的异质性并不能够预测FIGOⅡB期宫颈癌患者是否有淋巴结转移,但此研究用的异质性参数是数学建模法或纹理分析法所得出的参数,而非COV。
肿瘤的异质性与新生血管水平高及乏氧有关,表明肿瘤的侵袭性高,因而预示着预后不良,过去的多项研究也证明了这一点。一个有趣的现象是,本研究结果显示,COV越高,进展或死亡的风险越低,与常规的认识相反。但在Bundschuh等[8]预测直肠癌对新辅助化疗响应的研究,Zhao等[18]对转移性乳腺癌接受雌激素受体拮抗剂的研究以及Khurshid等[7]对前列腺癌接受177Lu-PSMA治疗前的68Ga-PSMA PET的研究中,均发现了类似的结果,即高COV组对治疗的响应均更好,无进展生存期及总生存期均更长,其原因可能为肿瘤的高度特异性,或者是样本选择的非均质性,如治疗方式的偏差、疾病分期的不同等。未来需要开展更大样本量的研究去验证。
本研究的局限性:①小样本回顾性研究;②研究对象的不均质,包括接受不同的治疗,但研究的目的是评估可能的预后生物学指标,严格地说,能够独立于任何治疗因素。
综上所述,基于体积的参数如MTV和TLG及肿瘤异质性参数COV是与宫颈癌临床病理特征及预后相关的参数,较SUV敏感,尤其是MTV,是宫颈癌无进展生存和总生存的独立预测因子。上述参数可作为临床常用SUV的补充或替代,为宫颈癌的个体化精准治疗及疗效预测提供更有价值的参考。
