2型糖尿病肾病患者肾血流阻力指数与血清脂蛋白a对肾功能进展的预测
2019-10-26丁国华
赵 凡 丁国华
糖尿病肾病(diabetic kidney disease,DKD)是糖尿病全身微血管病性合并症之一,也是终末期肾脏病的主要原因。糖尿病肾病病程长,长期监测糖尿病肾病肾功能是否进展及评估疾病进展程度及预后对于控制糖尿病肾病至关重要。目前常用于对DKD早期诊断的指标种类较多,包括肾小球损伤的生物学标志物、肾小管损伤的标志物、炎性指标及现在研究较热的miRNA与蛋白组学等[1]。然而对DKD疾病进展的长期监测指标较少,临床上常用预估肾小球滤过率(eGFR)及尿微量白蛋白(MAU)来规律监测DKD肾功能进展。但MAU的检测结果容易受感染、运动、检测方法等多因素影响,出现MAU的患者再次复查转阴的现象也很常见,且很多DKD患者在出现MAU前便已有不同程度的肾损伤[2]。不同患者的血肌酐受多种肾外因素干扰,且年龄、血糖、糖尿病病程及蛋白质摄入等因素均会影响DKD患者的eGFR结果[3]。脂蛋白a[Lp(a)]是众所周知的心血管危险因子,在心血管的粥样硬化的评估中有重要意义[4]。但是,Lp(a)在DKD的疾病进展的预测作用目前研究较少。彩色多普勒超声在糖尿病患者中具有重要价值,其中泌尿系彩超中的常用指标肾血流阻力指数(renal index,RI)可以评估肾血流的灌注情况,可用于DKD的早期诊断[5]。本实验通过研究RI、Lp(a)和GFR三者之间的关系,探讨RI联合Lp(a)在评估糖尿病肾病肾功能进展及预后的价值。
对象与方法
1.研究对象:回顾性收集2016年6月~2018年6月间在笔者医院肾内科住院的2型糖尿病肾病患者病例237例,其中男性144例(61.76%),女性93例(39.24%),患者年龄14~75岁。
2.资料收集:①基本资料:性别、初诊时年龄及糖尿病病程;②临床检验指标:糖化血红蛋白、血红蛋白、血尿酸、Lp(a)、甘油三酯、低密度脂蛋白、24h尿蛋白定量、血白蛋白、血肌酐、尿白蛋白肌酐比值(ACR)、尿α1微球蛋白、尿转铁蛋白、β2微球蛋白、尿IgG;③检查资料:泌尿系彩超结果:双肾血流阻力指数(本实验统一由左肾血流阻力指数代替)、左右肾体积;④预估肾小球滤过率(eGFR):由血肌酐估算,使用改良MDRD公式计算。将研究开始第1次入院的检查结果(包括住院病历资料、查血结果及检查资料)设置为基线资料。
3.DKD诊断标准:符合2007年《美国肾脏病预后质量指南(K/DOQI)》的糖尿病肾病诊断标准或2014年版《中国糖尿病肾病防治专家共识》中的诊断标准,包括尿蛋白正常但GFR下降的糖尿病肾病的患者[6]。排除标准:急性或慢性感染、恶性肿瘤性疾病、原发性心肌病、冠心病及长期口服调脂类药物、肾血管狭窄等病例。
4.分组:(1)根据RI结果将入选的病例分为:①RI升高组:RI>0.7组;②RI正常组:RI≤0.7组。(2)按照基线Lp(a)结果将入选的病例分为:①Lp(a)升高组:Lp(a)≥500mg/L组;②Lp(a)正常组:Lp(a)<500mg/L组两个亚组。(3)按照基线eGFR结果将入选的病例分为:①eGFR正常组:eGFR≥90ml/(min·1.73m2);②eGFR下降组:eGFR<90ml/(min·1.73m2)两个亚组。RI及Lp(a)参考值范围节点的选取根据临床既往研究的结果及本试验以Lp(a)300、400、500、600mg/L为节点分组后进行Logistic回归分析的各临床参数的风险差异不同及结合基线数据后选取的最适节点,文中不赘述[7]。
5.随访研究:自2016年6月开始在笔者医院规律住院随访,对未进入透析前的患者进行随访,随机随访病例113例,失访5例,失访率4.42%,实际随访108例;研究截止于2018年12月,至少每半年随访1次。研究终点设置为GFR减半或进入ESRD期。

结 果
1.2型DKD患者中eGFR下降的相关危险因素分析:对2型糖尿病肾病患者生化及人口学数据进行单因素Logistic回归分析,结果显示,与eGFR下降的相关因素包括年龄、糖尿病病程、24h尿蛋白定量、Hb、Alb、RI、双肾体积(P<0.05)。将这些因素作为协变量纳入Logistic回归方程进行多因素分析,结果提示糖尿病病程(OR=1.105)、24h尿蛋白定量(OR=1.370)、RI(OR=2.351)是eGFR<90ml/(min·1.73m2)的独立危险因素(P均<0.05),RI的OR值比24h尿蛋白定量OR值更大,详见表1。

表1 eGFR下降的相关因素分析(Logistic分析)
2.RI正常组与RI升高组临床参数比较:两组患者在Lp(a)、年龄、糖尿病病程、糖尿病分期高血压患病率、Scr、TG、LDL、eGFR、ACR、双肾体积比较,差异有统计学意义(P=0.05);两组比较,RI升高组的患者年龄较正常组高(P=0.000),糖尿病病程更长(P=0.000),集中在CKD5期(49.4%),高血压患病率更高(88.5% vs 76.7%,P=0.011),血红蛋白、甘油三酯、低密度脂蛋白、eGFR及双肾的体积水平偏低(P均<0.05),血肌酐、Lp(a)、ACR水平较高(P均<0.05),其中Lp(a)升高明显(590.36mg/L vs 365.75mg/L,P=0.000);两组之间性别比例、24h尿蛋白定量、糖化血红蛋白、血白蛋白、血尿酸、尿α1微球蛋白、β2微球蛋白、尿转铁蛋白、尿IgG比较,差异无统计学意义,详见表2。
3.RI与各临床参数之间的相关性分析:通过比较总体数据资料,排除无关变量,进行Pearson分析显示,RI与Lp(a)(r=0.663,P=0.000)、Scr(r=0.393,P=0.026)、ACR(r=0.222,P=0.043)呈正相关;RI与LDL(r=-0.26,P=0.021)、eGFR(r=-0.273,P=0.016)呈负相关。RI与24h尿蛋白定量、糖化血红蛋白、血红蛋白、血白蛋白、血尿酸、甘油三酯、尿α1微球蛋白、尿转铁蛋白、尿β2微球蛋白、尿IgG等比较差异无统计学意义,详见表3。
4.RI升高的相关危险因素分析:以上通过对eGFR<90ml/(min·1.73m2)影响因素的Logistic回归分析发现,RI是使肾功能下降的独立危险因素,且对肾功能的影响较大。故进一步对RI进行Logistic回归分析从而明确RI升高的独立危险因素;将单因素分析中与RI升高有关的因素作为协变量纳入回归方程进行多因素分析,结果提示,Lp(a)、年龄、Scr是RI升高的独立危险因素(P均<0.05),详见表4。

表2 RI升高组与正常组临床参数比较
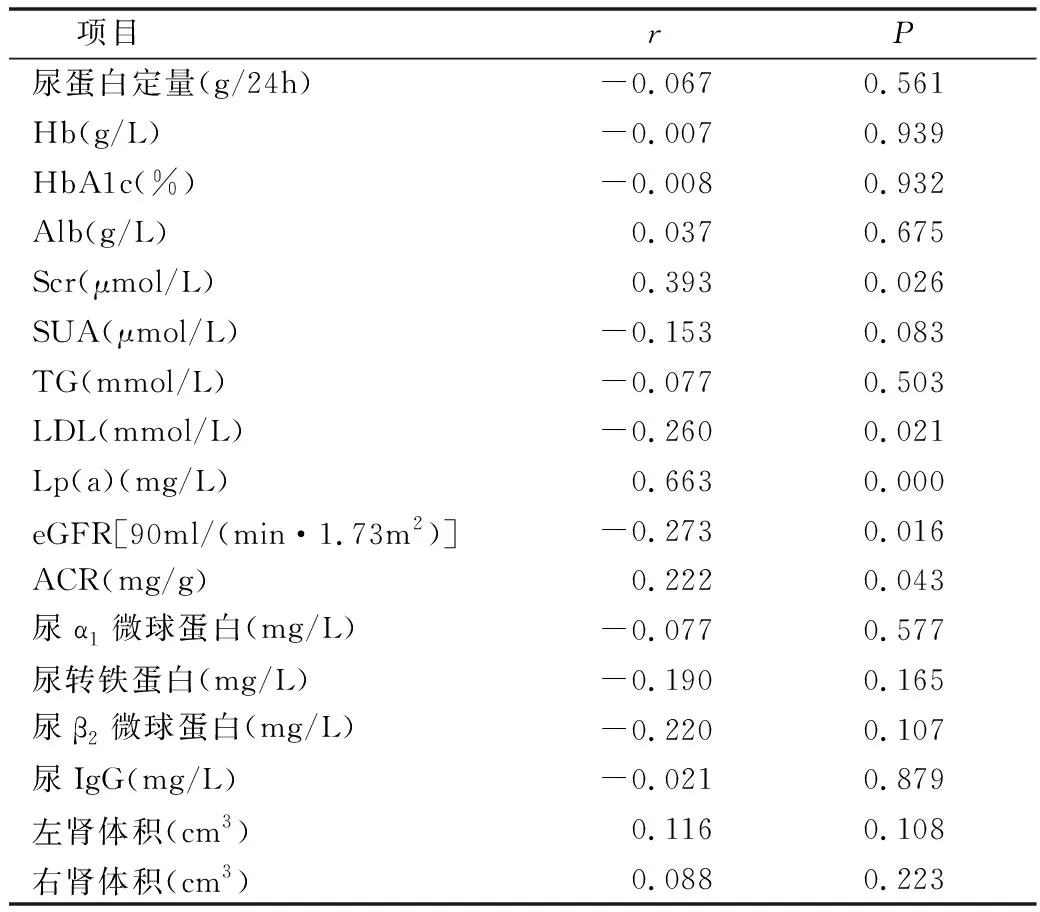
表3 RI与临床参数的相关性
5.RI并Lp(a)升高组与其余各组间临床参数比较:(1)对于RI与Lp(a)升高组与Lp(a)升高RI正常组患者临床参数比较提示RI并Lp(a)升高组糖尿病病程、Scr、β2-微球蛋白较Lp(a)升高RI正常组更高(P均<0.05);eGFR、尿α1微球蛋白、双肾体积更低(P均<0.05)。(2)对于RI并Lp(a)升高组与RI升高Lp(a)正常组临床参数比较提示RI并Lp(a)升高组Scr、24h尿蛋白定量、LDL、尿转铁蛋白、β2微球蛋白较RI升高Lp(a)正常组更高(P均<0.05);年龄、eGFR、尿α1微球蛋白、Hb、右肾体积更低(P均<0.05)。(3)RI并Lp(a)升高组与其余各组间临床参数比较提示RI并Lp(a)升高组相较于其他组在eGFR、右肾体积、尿α1微球蛋白水平较低,尿β2微球蛋白水平较高,差异有统计学意义(P<0.05),详见表5。
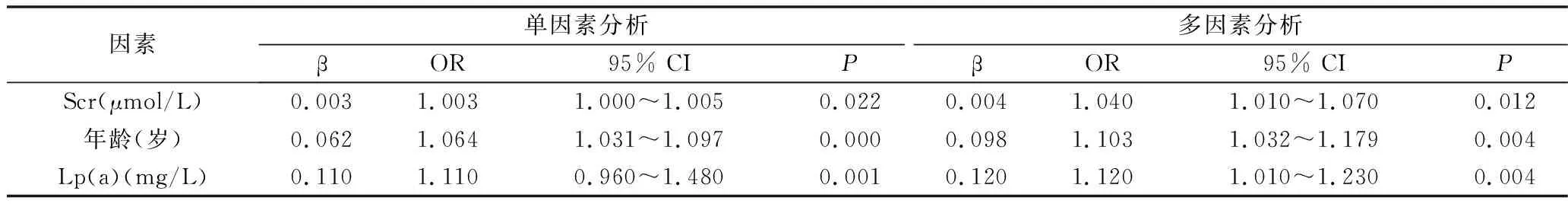
表4 RI升高的相关危险因素分析(Logistic分析)

表5 RI升高组与正常组患者Lp(a)升高与正常亚组间临床参数比较
6.以eGFR为90ml/(min·1.73m2)与60ml/(min·1.73m2)分组后进行Logistic回归分析进行各组间临床参数比较:以eGFR为90ml/(min·1.73m2)值分界作为GFR下降组与正常组患者分组后进行Logistic危险因素分析提示糖尿病病程、24h尿蛋白定量、Hb、HbA1c、RI、Lp(a)比较,差异有统计学意义(P均<0.05);而以eGFR为60ml/(min·1.73m2)值分界作为GFR下降组与正常组的患者比较,DKD的临床参数比较差异无统计学意义。以eGFR为90ml/(min·1.73m2)的分组,当开始GFR下降低于90ml/(min·1.73m2)时,即刚进入慢性肾脏病期时控制高Lp(a)血症与RI的临床意义较高,详见表6。

表6 不同eGFR分组的临床指标比较 (Logistic分析)
7.RI并Lp(a)升高对DN患者肾功能预后的影响:对108例患者的预后进行住院随访,以开始随访至进入研究终点的时间设置为生存时间,将是否进入研究终点设置为因变量,通过Kaplan-Meier生存分析比较RI合并Lp(a)升高组与非双升组[RI或Lp(a)未升高组]的糖尿病肾病患者的肾功能预后情况,结果提示随访67例非双升组DN患者的肾脏中位生存期为21个月,41例RI合并Lp(a)升高组DN患者肾脏中位生存期为16个月;共有54例患者进入终点,包括肾功能翻倍的患者36例,进入ESRD的患者18例;结果提示RI合并Lp(a)升高的患者组肾脏生存率低于非双升组(Log-rank检验,P=0.000),见图1。

图1 2型糖尿病肾病患者RI并Lp(a)升高对肾功能预后影响的生存曲线(Kaplan-Meier生存分析)
讨 论
DKD是糖尿病的严重并发症之一,DKD 的发生与慢性高血糖所致的糖代谢异常、脂代谢异常、肾脏血流动力学改变、氧化应激和遗传等因素有关[8]。DKD的临床特点是尿白蛋白排泄率(UAER)升高,血压(BP)升高,肾功能持续下降。在DKD的自然病程中,持续性蛋白尿发病后肾脏平均存活时间为5~7年[9]。尽管有更好的治疗,包括血管紧张素转换酶抑制剂(ACEI)血管紧张素受体拮抗剂(ARB)类药物和透析,但是DKD仍然是终末期肾病(ESRD)的主要原因[10]。对于糖尿病肾病患者的管理,肾功能的进展轨迹比慢性肾病的发病阶段更为重要[11]。在目前的前瞻性研究中很少有生物学标志物作为预测DKD进展过程的指标优于蛋白尿和eGFR[12]。彩色多普勒血流显像作为一种非侵入性的检测肾脏血流动力学变化的方法,可以通过直接检测肾脏血流反映肾血管病变的RI值,来提供一种简便又可靠的反映肾功能进展的方法。有文献表明,在162例的前瞻性试验中,与蛋白尿>1g/d或肌酐清除率<40ml/(min·1.73m2)比较,肾RI在指示肾功能恶化或死亡的优势方面更具有优势,且RI和蛋白尿>1g/d为独立变量,提示进展[13]。本研究显示,RI水平与蛋白尿及其他传统危险因素无关,可独立预测肾脏的进展;RI可提供对DN肾功能进展更高的预测价值(表1)。
有研究指出,RI可反映肾动脉阻力状态[14]。但RI受系统血流动力学的影响,并不是单纯受肾血管阻力的影响[15]。RI不是血流阻力的及时变量,但RI却至少能反映肾脏的血流阻力动态变化趋势。还有观点表明,RI和肾小动脉硬化相关[16]。RI与动脉粥样硬化标志物脉搏波传播速度(PWV)相关,在糖尿病肾病中增加程度更大[17]。因此,通过RI无创评估肾血管阻力的变化可能为评估动脉粥样硬化和糖尿病肾病以及肾功能提供重要信息。但临床上对PWV的检测没有普及,临床上是否还有其他指标来反映血管动脉粥样硬化在糖尿病肾病中的影响,且临床指标又是否与RI和肾功能改变独立相关,相关的研究并不多。Lp(a)是公认的心血管危险因子,又是动脉粥样硬化重要的检测指标[18]。有研究表明,血清Lp(a)水平与2型糖尿病肾病发病呈正相关[19]。
糖尿病可以改变脂质和脂蛋白的利用,是动脉粥样硬化发生的重要危险因素之一,最终导致糖尿病诱导的动脉粥样硬化性血脂异常[20]。并且糖尿病患者病死率的增加主要发生在DKD患者,主要死因是由于心血管疾病(CVD)[21,22]。即使是透析患者,高Lp(a)水平也可预测不良的心血管事件[23]。单纯监测肾功能进展的指标对DKD患者心血管事件的预测不足,无法预估患者的死亡风险。
对于糖尿病肾病与Lp(a)的关系而言,有回顾性研究指出:血液中高Lp(a)水平与糖尿病肾病的进展相关[24]。在另一个临床试验中,研究者比较了糖尿病肾病组、T2DM组与正常空白对照组患者的血脂的改变,与对照组比较,T2DM合并肾病和未合并肾病的患者中,均存在Lp(a)、TC等血脂异常,但并没有发现T2DM与糖尿病肾病之间Lp(a)的明显差异,可能与样本量小有关[25]。本研究中结果显示Lp(a)与RI有显著的相关性(P=0.000),在以RI>0.7与否分组后,Lp(a)仍与RI表现显著相关性(P=0.000),RI并Lp(a)升高组与其余各组间临床参数比较提示RI并Lp(a)升高组相较于其他组在eGFR、右肾体积、尿α1微球蛋白水平较低,尿β2微球蛋白水平较高,差异有统计学意义(P<0.05)。另外,研究中还发现,对eGFR<90ml/(min·1.73m2)影响因素的Logistic回归分析提示RI的升高是eGFR<90ml/(min·1.73m2)的独立危险因素(P均为0.000),风险是正常人的2.907倍,这一结论与国外的研究也是相符的[7]。本研究并未发现Lp(a)升高是糖尿病肾病肾功能下降的独立危险因素,但是Lp(a)升高是2型糖尿病肾病患者RI升高的独立危险因素。出现这一现象的原因可能是源于回归分析中选择肾功能下降的纳入因素时,纳入的RI水平改变的影响因素来自于Lp(a),且RI本身对肾功能下降有影响,所以这一结果可能受RI干扰。因此推测Lp(a)和RI的升高可以预测肾脏的损害,Lp(a)及RI加重肾血流的粥样硬化,增加肾脏血管的狭窄程度,影响肾血流阻力程度,进一步导致肾功能的进展。相关研究显示,肾小球的毛细血管的阻力增高引起肾小球的高滤过、高灌注、高压力改变,刺激内皮细胞和系膜细胞分泌各种促纤维化的因子,造成肾小球的硬化,造成肾功能恶化[26]。
另外,本研究还对以eGFR为90ml/(min·1.73m2)与60ml/(min·1.73m2)分组后进行了Logistic回归分析,而结果提示以eGFR为90ml/(min·1.73m2)患者分组后临床检验参数统计学差异更显著,说明当开始GFR下降<90ml/(min·1.73m2)时,即刚进入慢性肾脏病期时控制高Lp(a)血症与RI的临床意义较高,伴随蛋白尿加重、粥样斑块的形成、肾功能进展后,RI与Lp(a)的控制意义会显著降低,此时进行降脂脂蛋白a治疗效果也会相应下降。
综上所述,在2型糖尿病肾病中监测RI与Lp(a)对明确糖尿病肾病是否进展具有重要意义。Lp(a)与RI水平升高独立相关。RI与2型糖尿病肾病肾功能进展独立相关,RI可作为预测肾功能下降的预测因素;在慢性肾脏病早期控制RI与Lp(a)效果更明显,有助于减少糖尿病心血管并发症的风险。但是降Lp(a)治疗的必要性与收益需要临床大规模的实验来验证。由于RAS阻断剂是DN的基础治疗,因此在未来的研究中可以了解RAS阻断剂是否会影响Lp(a)与RI水平[27]。
