坏疽性脓皮病的辅助检查及治疗
2019-10-25晋红中
吴 超,晋红中
坏疽性脓皮病(pyoderma gangrenosum,PG)是一种少见的非感染性嗜中性皮肤病,以复发性、疼痛性、坏死性溃疡为特点,常伴有潜在的系统疾病,病因不明,可能与免疫异常有关。本研究回顾性分析1994年1月至2014年5月就诊于北京协和医院的61例PG患者的实验室检查、影像学检查、组织病理、治疗情况及疗效,旨在提高对坏疽性脓皮病辅助检查特点及治疗的认识。
1 资料与方法
查阅北京协和医院1994年1月至2014年5月门诊或住院患者的病历资料,符合PG两条主要诊断标准(PG典型溃疡、排除引起皮肤溃疡的其他原因)[1],同时符合以下四条次要诊断标准中至少两条(曾出现过敏反应性或筛孔状瘢痕、存在相关的并发症、存在相应的组织病理表现、对激素治疗反应好)[2],共61例,对其实验室检查(常规及生化、感染指标、免疫指标、肿瘤指标)、影像学检查、组织病理、治疗情况及疗效进行回顾性分析。
2 结果
2.1 一般资料
61例患者中男性33例,女性28例,男女比例1.2∶1。年龄8~72岁,平均年龄(40.2±17.0)岁,其中18岁以下6例(9.8%),60岁以上11例(18.0%)。门诊患者12例(19.7%),住院患者49例(80.3%),平均住院日(37.1±25.8)d。
2.2 实验室检查结果
2.2.1 常规及生化:61例均行血常规及肝功能、肾功能检查。13例(21.3%)白细胞明显升高至(10.81~114.00)×109/L[正常值(4.00~10.00)×109/L];8例(13.1%)白细胞明显降低至0.96~3.93×109/L,其中3例并发MDS、1例并发再生障碍性贫血(均因PG就诊于本院后确诊)。11例(18.0%)血红蛋白显著降低至27~110 g/L(正常值120~160 g/L),其中3例并发MDS,1例并发消化道溃疡,1例并发溃疡性结肠炎,其余6例未找到明确贫血原因。1例嗜酸性粒细胞明显升高达39%。1例出现类白血病反应,继发于PG,白细胞最高达114×109/L,NEU%达96.5%,Hb 27 g/L,Plt 19×109/L。12例(19.7%)入院时即发现谷丙转氨酶升高至56~168 U/L(正常值5~40 U/L),既往多使用系统性药物治疗。36例患者检测血沉,其中31例(86.1%)升高,最高者>140 mm/h(正常值0~15 mm/h),23例(63.9%)超过50 mm/h,6例(16.7%)超过100 mm/h。16例患者检测C反应蛋白,其中15例(93.8%)升高,最高者151 mg/L(正常值0~8 mg/L)。
2.2.2 感染指标:14例检查梅毒RPR,均阴性。12例行皮损组织微生物培养,3例(25%)阳性,分别为大肠埃希菌、金黄色葡萄球菌、荧光假单胞菌。31例行创面分泌物微生物培养,22例(71.0%)阳性,其中1例真菌培养阳性(可见大量酵母样孢子)、21例细菌培养阳性。同一患者创面分泌物培养可存在多种细菌。分泌物常见病原体:苯唑西林敏感的金葡菌5例,肺炎克雷伯菌4例,大肠埃希菌、凝固酶阴性葡萄球菌各3例,绿脓杆菌、溶血葡萄球菌、粪肠球菌各2例,奇异变形杆菌、阴沟肠杆菌、假白喉棒状杆菌、类酵母菌、草绿色链球菌、头状葡萄球菌、肾棒状杆菌、耐甲氧西林的金黄色葡萄球菌(MRSA)各1例。
2.2.3 免疫相关指标:45例查ANA/ENA/dsDNA,4例(8.9%)阳性。ANA 1∶80者3例,其中并发溃疡性结肠炎、甲状腺癌各1例,另1例未发现其他潜在疾病;ANA 1∶160者1例,同时抗核小体抗体强阳性,RF4750 U/ml(<15),其并发类风湿性关节炎及嗜酸细胞增多综合征。10例检测补体C3、C4及总补体活性,4例(40%)总补体活性升高,2例(20%)C3稍下降。12例查ANCA,发现2例(16.7%)抗中性粒细胞胞浆抗体IgG型(IF-ANCA)阳性,滴度均为1∶10,该2例患者分别并发溃疡性结肠炎、甲状腺癌。另外,1例行DIF,阴性。20例查血清蛋白电泳,19例(95%)异常,15例Alb%下降,15例α1球蛋白升高,14例α2球蛋白升高,8例β球蛋白升高,5例γ球蛋白升高,2例γ球蛋白降低,1例β球蛋白降低。8例检测血清免疫固定电泳,仅1例M蛋白为IgA λ型,但该患者并未发现血液系统异常。30例检测血清免疫球蛋白三项(IgG/M/A),13例(43.3%)异常,其中9例IgA升高,6例IgG升高,5例IgM升高;4例IgG下降,2例IgA下降,2例IgM下降。另外,10例查IgE,8例(80%)明显升高,最高者776 IU/ml(正常值0~100 IU/ml)。10例患者行淋巴细胞表型分析,9例(90%)异常。其中8例(80%)自然杀伤细胞(NK细胞)计数或比例降低,最低者2.1%(8%~26%);3例B细胞计数或比例降低、2例升高,3例辅助性/诱导性T淋巴细胞(CD4+T细胞)计数或比例降低、2例升高,2例抑制性/细胞毒性T淋巴细胞(CD8+T细胞)计数或比例降低,1例CD4+T细胞第二信号受体(CD28)表达比例降低。1例表现为B细胞、NK细胞严重减少,T细胞免疫功能明显低下。
2.2.4 肿瘤指标:9例筛查肿瘤标志物,2例升高,其中1例并发非小细胞肺癌,其CEA升高至72.46 ng/ml(正常值0~5 ng/ml)、CA125升高至78.3 U/ml(正常值0~35 U/ml),另1例患者CA199明显升高至91 U/ml(正常值0~37 U/ml)、胸腹盆CT未发现明显占位。
2.2.5 骨髓穿刺及活检:17例行骨髓穿刺及活检,10例(58.8%)异常,其中4例符合骨髓增生异常综合征(MDS),1例符合再生障碍性贫血,1例符合类白血病反应,1例符合感染骨髓象,2例为非特异性粒系增生,1例为非特异性造血组织比例减少。此10例骨穿异常的患者本次就诊于本院前均未发现血液系统异常,均为本次就诊后确诊。
2.3 影像学检查结果
腹部B超3例显示脾大(均并发血液系统疾病),3例脂肪肝,2例胆囊息肉,肝囊肿、淤血肝、腹腔积液各1例。超声心动发现肥厚性心肌病1例,1例升主动脉明显增宽、主动脉瓣轻中度关闭不全。11例查胸/腹/盆CT,发现肺部感染、肺癌、肺脓肿、胸腔积液、肺结核、肝囊肿各1例。10例患者行全消化道造影筛查,均大致正常。5例已确诊为炎症性肠病的患者因既往于外院行肠镜,皆未于本院行全消化道造影检查。
2.4 皮损组织病理
61例患者均行皮肤组织病理检查。表皮常角化过度,棘层增厚,皮突延长,棘细胞内、细胞间可发生水肿(图1A),4例患者出现角层内中性粒细胞构成的微脓疡(图1D),亦可出现表皮坏死、溃疡或结痂(图1C),与取材部位有关。真皮常出现血管增生、扩张,血管壁增厚、水肿,部分患者可出现血管壁纤维素样变性、溢血、核尘(图1E);血管周围皆有大量细胞浸润,主要为中性粒细胞、淋巴细胞、组织细胞(图1B),8例患者出现少量嗜酸性粒细胞或浆细胞。皮下组织可出现脂肪间隔增宽,脂肪小叶或小叶间隔内较多淋巴细胞、组织细胞、中性粒细胞浸润(图1F)。
2.5 治疗情况及疗效
2.5.1 系统治疗:59例应用系统治疗,其中20例(32.8%)单用糖皮质激素,33例(54.2%)应用糖皮质激素联合免疫抑制剂/生物制剂依那西普,6例(9.8%)单用免疫抑制剂。1例未应用系统治疗,仅局部换药、外用他克莫司软膏,皮疹即逐渐愈合。1例拒绝激素治疗而自动出院。单用糖皮质激素者,激素起始量4例为泼尼松0.5 mg/(kg·d)、13例为1.0 mg/(kg·d)、2例为1.5 mg/(kg·d)、1例为2.0 mg/(kg·d)。应用糖皮质激素联合免疫抑制剂者29例,其中最常用的免疫抑制剂为环磷酰胺(11例),其他免疫抑制剂包括环孢素、甲氨蝶呤、雷公藤多苷、沙利度胺等。61例中治疗无效者2例,1例患者拒绝治疗出院,余58例均好转。应用糖皮质激素联合依那西普的4例患者中3例病情严重、对其他疗法不敏感,1例为少年患者、病情严重。4例均起效较快,溃疡于治疗5~14 d内面积明显缩小、基底变浅、无明显渗出。应用糖皮质激素治疗的53例患者于治疗5~56 d后溃疡好转、激素开始减量,约半数患者每隔2周激素减量一次,每次减量10 mg/d;约1/4患者每隔1周激素减量一次,每次减量5 mg/d;有系统受累者多每隔14 d激素减量一次,每次减量5 mg/d,一般至激素量30 mg/d时减量速度更慢;个别患者激素起始量较大,皮疹控制后每隔1周减量一次,每次减量10 mg/d。
2.5.2 局部治疗:局部治疗包括应用生理盐水、阿米卡星、利多卡因配制的混合溶液换药,外用他克莫司软膏,外用抗生素软膏,高锰酸钾溶液(1∶8 000)湿敷,外用表皮生长因子、溃疡油、银离子活性敷料,皮损内肌注得宝松等,部分患者辅以NB-UVB或氦氖激光局部照射。
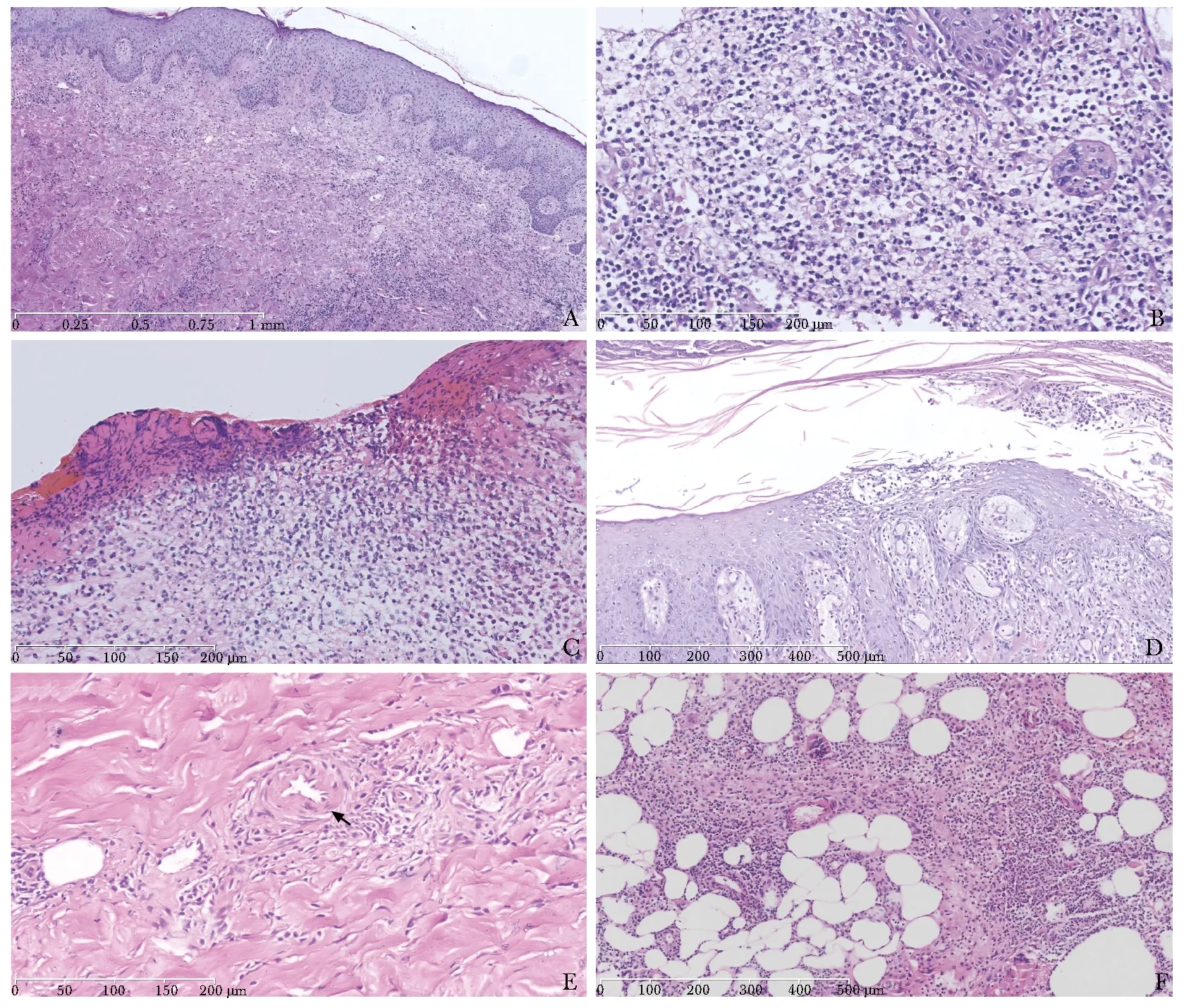
图 1坏疽性脓皮病的组织病理表现
Fig1Histopathological manifestations of pyoderma gangrenosum
A:棘层增厚,真皮水肿,真皮血管扩张,血管壁增厚、水肿,血管周围淋巴细胞、中性粒细胞浸润 (H&E染色,×100);B:真皮内大量中性粒细胞浸润 (H&E染色,×400);C:真皮浅层血管增生、扩张,血管壁纤维素样变性,真皮内较多淋巴细胞、组织细胞、浆细胞、中性粒细胞浸润 (H&E染色,×400);D:表皮内可见中性粒细胞构成的微脓疡 (H&E染色,×200);E:真皮血管扩张,血管壁变性、坏死 (H&E染色,×400);F:脂肪小叶及小叶间隔内较多淋巴细胞、组织细胞、中性粒细胞浸润 (H&E染色,×200)
3 讨论
PG是一种罕见的慢性、复发性、炎症性疾病,以非感染性、坏死性、疼痛性皮肤溃疡为主要临床特征[3]。组织病理无特异性,诊断主要基于临床表现,需排除可引起溃疡的其他疾病,如感染、血管闭塞性疾病、静脉疾病、血管炎、结缔组织病、肿瘤等。本病病因不明,由于免疫抑制治疗有效、且易并发免疫性疾病,故推测本病的发生与免疫相关[4]。文献报道PG患者中存在异常的单核细胞和中性粒细胞趋化及淋巴细胞功能异常、补体降低、循环细胞因子升高等[3],但均未得到共识。皮损部位的血管壁蛋白沉积提示免疫复合物的形成[5]。然而目前并未发现PG患者血清中存在特异性的抗体或抗原,本研究中45例患者检测了自身抗体、仅4例呈低滴度阳性。本研究中血清蛋白电泳及血清免疫球蛋白异常率较高,亦证明PG与免疫系统有关。总IgE明显升高,推测PG可能与超敏反应有关。本研究中10例患者行淋巴细胞表型分析,其中8例自然杀伤细胞计数比例降低,这在既往文献未见报道,提示固有免疫可能在PG的发生中发挥一定作用。另外,分泌物细菌培养阳性率较高,考虑与溃疡面继发感染有关,提示局部换药的重要性。
组织病理可符合血管炎、脂膜炎、嗜中性皮病、肉芽肿,需与临床结合再做诊断,确诊不能依赖病理。本研究多数组织病理诊断为坏疽性脓皮病的患者皆为临床已疑诊为坏疽性脓皮病的患者,若临床医师未考虑到这一诊断,组织病理易被误诊为血管炎、脂膜炎、嗜中性皮病、肉芽肿等。8例患者出现少量嗜酸性粒细胞或浆细胞,可能与病程或继发感染有关。
除皮疹局限、浅表者,所有患者均推荐系统治疗[3]。系统性糖皮质激素是PG的一线疗法[6],控制剂量相当于1 mg/(kg·d),皮疹泛发及严重者可能需增加初始剂量或冲击治疗。近期报道,吸入性糖皮质激素对于其他治疗反应较差的口周PG者有效[7]。免疫抑制剂常作为辅助治疗或用于对糖皮质激素不能耐受者。国外文献报道,环孢素是PG患者最常用的免疫抑制剂,可通过阻断T辅助细胞的早期抗原活化而抑制淋巴因子的产生和分泌[3];而本研究发现,环磷酰胺是最常用的免疫抑制剂。中药雷公藤制剂可治疗PG,其机制可能与其抗炎和双向免疫调节作用有关[8]。肿瘤坏死因子(TNF)-α升高与PG的发生有关[9]。近年来,单用TNF-α拮抗剂或TNF-α拮抗剂联合糖皮质激素在PG的治疗中地位逐渐提升。多项随机双盲临床对照试验均证明英夫利昔单抗、依那西普、阿达木单抗、依法利珠单抗、阿法西普对绝大部分PG患者疗效显著[10-14]。本研究4例应用激素联合依那西普的患者中3例对其他疗法抵抗,1例为病情较重的少年患者,应用此方案均起效快且取得满意疗效,治疗中应密切监测各项指标,警惕感染。
本研究中半数以上患者采用系统性糖皮质激素联合免疫抑制剂或生物制剂治疗,可减少糖皮质激素用量及其不良反应。皮损局限者推荐激素起始剂量为泼尼松0.5 mg/(kg·d),皮疹泛发者推荐激素起始剂量为泼尼松1 mg/(kg·d)。病情严重、对其他疗法抵抗或有禁忌证者推荐应用激素联合TNF-α拮抗剂。无新发皮疹且原有溃疡缩小、基底变浅、分泌物减少时激素开始逐渐减量,平均需2~4周开始减量,应用激素联合生物制剂者诱导治疗期更短。激素平均每2周减量10 mg/d,至30 mg以下时减量速度更慢。单用大剂量激素或激素冲击疗法易发生股骨头坏死、感染性休克、血栓等严重不良反应,使用应谨慎。
