21基因复发风险评分对早期乳腺癌术后治疗决策的影响
2019-10-24朱丽喆巩凯丽何建军
朱丽喆,马 楠,巩凯丽,汪 蕾,王 彬,何建军,任 予,闫 宇
(1. 西安交通大学第一附属医院乳腺外科,陕西西安 710061;2. 西安交通大学医学部,陕西西安 710061;3. 西安交通大学第一附属医院妇产科,陕西西安 710061)
作为中国女性最常见的恶性肿瘤之一,目前每年有超过269 000名新发的女性乳腺癌患者。飞速增长的患病率业已超过世界平均增长水平2%[1]。因此,乳腺癌的“三早”治疗原则即早期发现、早期诊断和早期治疗尤为重要。随着诊断和治疗水平的提高,我国乳腺癌治疗模式已成功转向综合外科、放化疗、内分泌和靶向治疗的诊疗模式[2]。但是,相应的治疗副作用也逐渐显现,其中最重要的是化疗副反应。虽然乳腺癌术后化疗可减少局部和远处复发和转移,同时延长患者生存期,但也伴有心脏毒性、骨髓抑制、卵巢功能衰竭及神经毒性等相关副作用[3]。对早期乳腺癌患者是否可以从化疗中获益也尚不清楚。
近年来,基因组学蓬勃发展,乳腺癌的诊治也逐渐侧重个体基因检测以确保精准医疗[4]。其中,21基因复发风险评分已经被美国国立综合癌症网络(NCCN)及美国临床肿瘤学会(ASCO)推荐应用于早期乳腺癌患者风险评估[5-6]。相较于传统的临床病理特征以及免疫组化结果,21基因检测复发风险评分可以更加精确地预测乳腺癌术后的复发及转移风险[7-10]。NSABP B-20试验表明:依据21基因检测计算得出的复发风险评分可以预测乳腺癌患者10年的远期复发风险,从而可以辅助临床医师制定乳腺癌患者术后治疗决策,为低复发风险的患者避免过度的术后辅助化疗[11-12]。
目前国内外已逐步开展21基因复发风险评分,以协助乳腺癌个体化治疗,世界多个国家不同临床研究[13-19]皆表明21基因复发风险评分可协助临床医师进行乳腺癌术后辅助治疗决策的制定,使得一部分低复发风险评分的乳腺癌患者可以减少不必要的过度化疗,从而减轻化疗相关的副反应,在个人得到精准治疗的同时,患者的生活质量也得到提高。迄今为止,我国尚未将21基因检测复发风险评分纳入到基本医疗保险当中,其价格仍然较贵,也尚未得到普及,因此国内相关临床研究较少。本研究探讨21基因复发风险评分在我国早期激素受体阳性且淋巴结阴性的乳腺癌患者辅助治疗决策中的导向作用,进一步验证21基因检测在我国人群中的适用性,提高其在我国早期乳腺癌患者术后辅助治疗决策中的指导地位及作用。
1 材料与方法
1.1 研究对象本研究统计并收集2013年6月至2016年12月在西安交通大学第一附属医院接受外科手术治疗的共110名早期乳腺癌患者,术后病理皆为激素受体阳性和淋巴结阴性,并且已行21基因检测评分。患者纳入标准:①年龄为18~75岁的女性乳腺癌患者;②ER/PR阳性,HER2阴性(HER2-/+或HER2 2+但FISH检测提示未扩增),无淋巴结转移的患者;③病理类型为非特殊性浸润性乳腺癌;④全身检查未见远处转移;⑤同意行个体化检测评估的21基因检测复发风险评分;⑥无其他严重伴随疾病。排除标准:①已行新辅助化疗;②妊娠或者哺乳期妇女;③患者在初次就诊时出现远处转移;④AJCC分期为T4期的乳腺癌患者;⑤ECOG评分≥2分或因一般情况不佳可能无法行辅助化疗;⑥患者自身伴有严重内脏器质性病变。
1.2 21基因复发风险评分的测定21基因复发风险评分由广州益善生物科技有限公司(医疗机构许可证:440116PDY707461)采用分支DNA-液相芯片技术替代传统的RT-PCR技术对患者石蜡包埋的肿瘤标本进行检测,21个与复发风险相关基因分别为Ki67、STK15、Survivin、CCNB1、MYBL2、GRB7、HER2、ER、PGR、BCL2、SCUBE2、MMP11、CTSL2、GSTM1、CD68、BAG1、ACTB、GAPDH、RPLPO、GUS、TFRC。最后,通过相关公式计算21基因表达获得复发风险评分(RS)。其中,RS<18分归类为低危组,18分≤RS<31分归类为中危组,RS≥31分归类为高危组[7]。
1.3 治疗决策的制定所有患者均经过我院乳腺肿瘤多学科协作团队(MDT团队)讨论后得出治疗决策。我院MDT团队在RS评分之前和之后独立做出治疗决策。该决定基于以下指南,中国抗癌协会制定的乳腺癌诊治指南与规定,及中国临床肿瘤学会(CSCO)乳腺癌诊疗指南、美国NCCN指南(NCCN Clinical Practice Guidelines in Oncology, Breast Cancer)、St Gallen共识,并结合MDT团队医师临床经验及患者个体情况最终决定。终方案已告知患者及其家属,并获得知情同意书。
1.4 统计学分析所有数据均由SPSS 22.0统计软件进行分析和处理。McNemar卡方检验被用于21基因复发风险评分前后治疗决策改变情况的统计学分析。P<0.05为差异具有统计学意义。
2 结 果
2.1 所有纳入患者的临床基线资料乳腺癌患者的临床基线特征见表1。根据RS分类标准,其中有59.1%(65/110)归类为低危组,34.5%(38/110)归类为中危组,6.4%(7/110)归类为高危组(图1)。所有患者的中位年龄为52岁(25~73岁)。约85%的术后病理学提示为非特殊性浸润性导管癌。
表1 行21基因复发风险评分患者的基线特征
Tab.1 Baseline characteristics of patients with 21-gene recurrence score
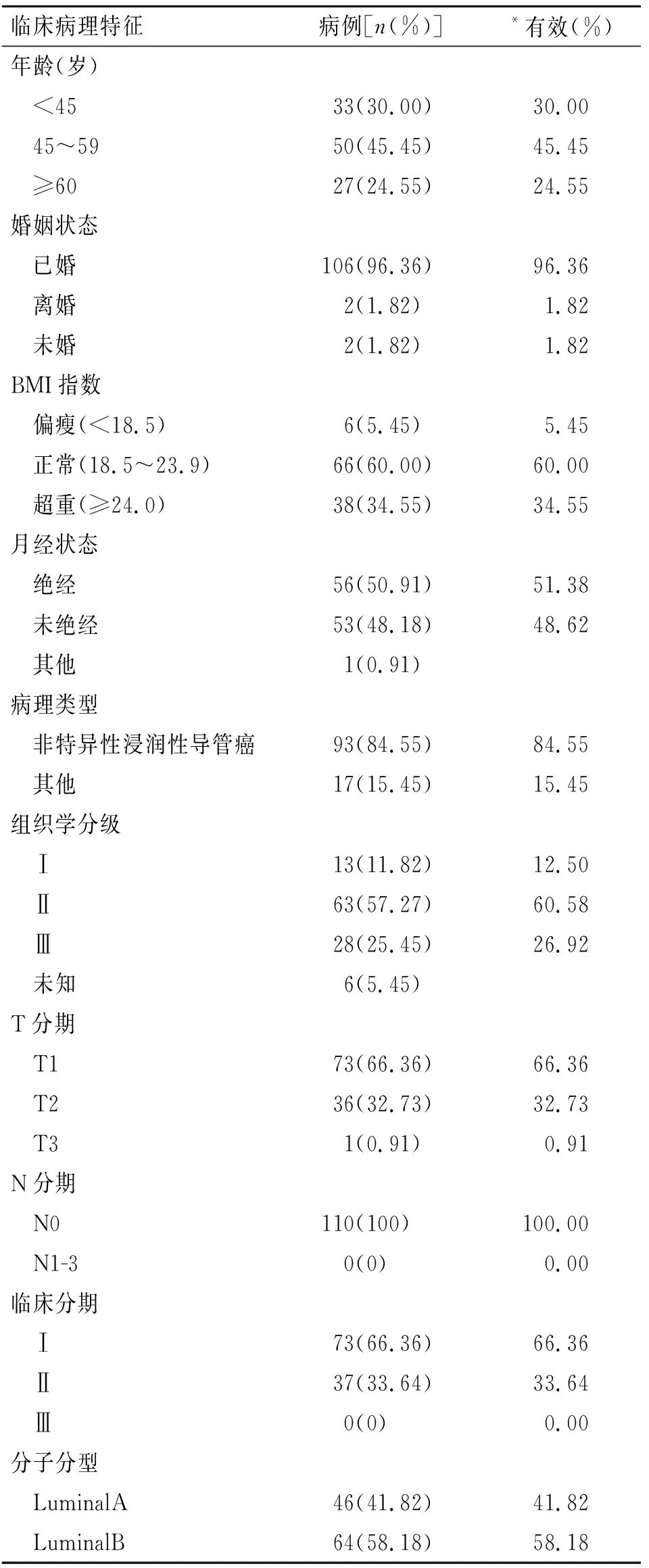
临床病理特征病例[n(%)]*有效(%)年龄(岁) <4533(30.00)30.00 45~5950(45.45)45.45 ≥6027(24.55)24.55婚姻状态 已婚106(96.36)96.36 离婚 2(1.82)1.82 未婚 2(1.82)1.82BMI指数 偏瘦(<18.5) 6(5.45)5.45 正常(18.5~23.9)66(60.00)60.00 超重(≥24.0)38(34.55)34.55月经状态 绝经56(50.91)51.38 未绝经53(48.18)48.62 其他 1(0.91)病理类型 非特异性浸润性导管癌93(84.55)84.55 其他17(15.45)15.45组织学分级 Ⅰ13(11.82)12.50 Ⅱ63(57.27)60.58 Ⅲ28(25.45)26.92 未知 6(5.45)T分期 T173(66.36)66.36 T236(32.73)32.73 T3 1(0.91)0.91N分期 N0110(100)100.00 N1-3 0(0)0.00临床分期 Ⅰ73(66.36)66.36 Ⅱ37(33.64)33.64 Ⅲ 0(0)0.00分子分型 LuminalA46(41.82)41.82 LuminalB64(58.18)58.18
*有效(%)指的是不包含“其他”和“未知”的百分数。
2.2 针对21基因复发风险评分进行治疗决策调整行21基因复发风险评分后,低危组和中危组患者最终由辅助化疗联合内分泌治疗改为单纯行内分泌治疗的患者分别有24例(39%)和8例(20%);且在行21基因检测之后,低风险及中风险组患者不再选择行AC-T方案(蒽环类+环磷酰胺-紫杉类),与此同时,TC方案(多西他赛+环磷酰胺)的选择也减少了26例(24%,表2和表3)。

图1 21基因复发风险评分的分布图
Fig.1 Distribution of 21-gene recurrence score
表2 21基因检测前后医师治疗决策的总体情况
Tab.2 General situation in doctor’s treatment decisions before and after the 21-gene test [n(%)]
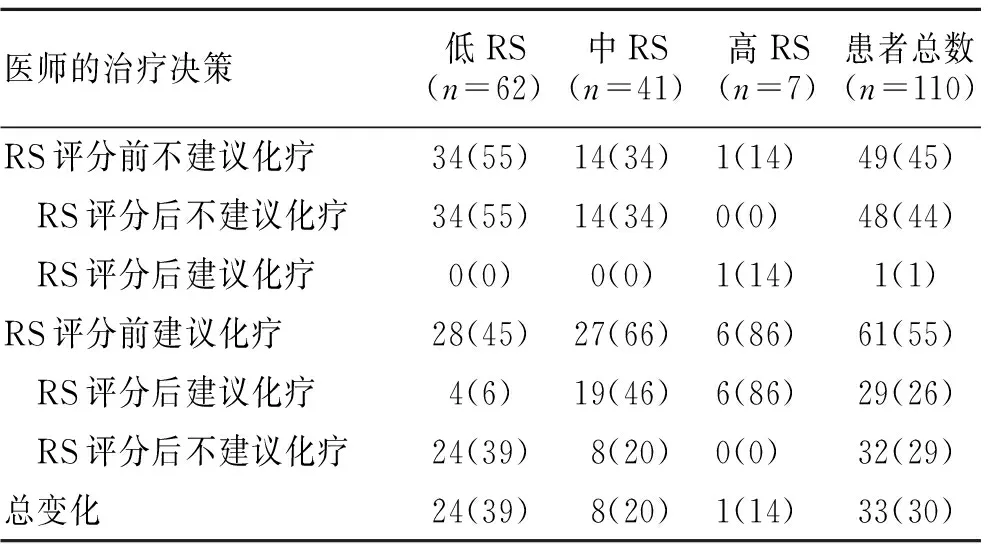
医师的治疗决策低RS(n=62)中RS(n=41)高RS(n=7)患者总数(n=110)RS评分前不建议化疗34(55)14(34)1(14)49(45) RS评分后不建议化疗34(55)14(34)0(0)48(44) RS评分后建议化疗0(0)0(0)1(14)1(1)RS评分前建议化疗28(45)27(66)6(86)61(55) RS评分后建议化疗4(6)19(46)6(86)29(26) RS评分后不建议化疗24(39)8(20)0(0)32(29)总变化24(39)8(20)1(14)33(30)
RS:21基因复发风险评分。
表3 21基因检测前后医师辅助化疗方案的选择
Tab.3 Selection of doctor’s adjuvant chemotherapy regimen before and after the 21-gene test [n(%)]
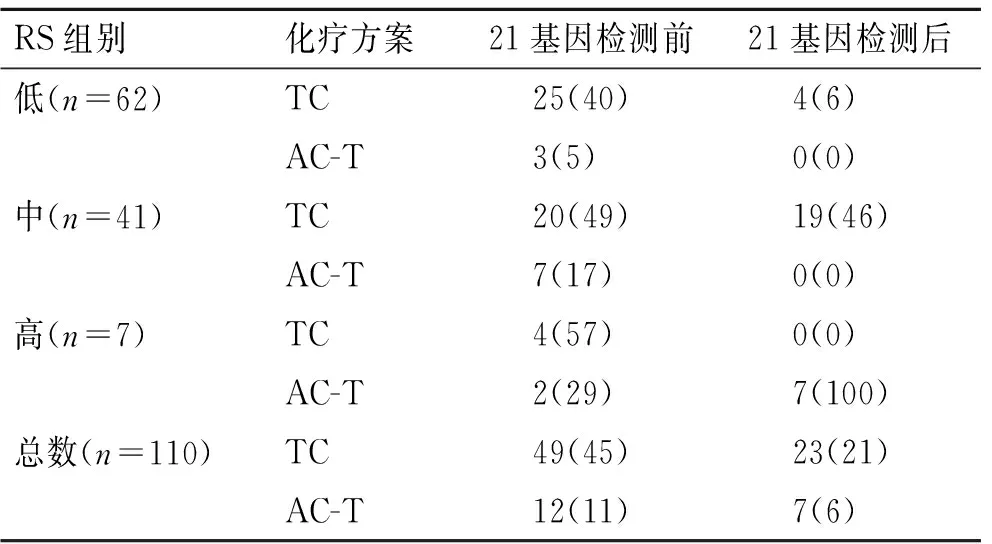
RS组别化疗方案21基因检测前21基因检测后低(n=62)TC25(40)4(6)AC-T3(5)0(0)中(n=41)TC20(49)19(46)AC-T7(17)0(0)高(n=7)TC4(57)0(0)AC-T2(29)7(100)总数(n=110)TC49(45)23(21)AC-T12(11)7(6)
RS:21基因复发风险评分;TC方案:多西他赛(T)75 mg/m2d1+环磷酰胺(C)600 mg/m2d1 1/21 d×4;AC-T方案:蒽环类+环磷酰胺-序贯紫杉类。
2.3 21基因复发风险评分前后医师治疗决策的改变情况行21基因复发风险评分后,32例(29%)患者改为行单纯辅助内分泌治疗(McNemar’s test,P<0.001,表4)。在分类为低风险和中风险群体的乳腺癌患者中,由化疗联合内分泌治疗改为单纯行术后辅助内分泌治疗的分别为24例(39%)和8例(20%)(McNemar’s test,P<0.001;P=0.008,表5)。基因检测前后医师治疗决策的差异具有统计学意义。
表4 21基因检测前后医师治疗决策的改变情况
Tab.4 Changes in doctor’s treatment decisions before and after the 21-gene test [n(%)]
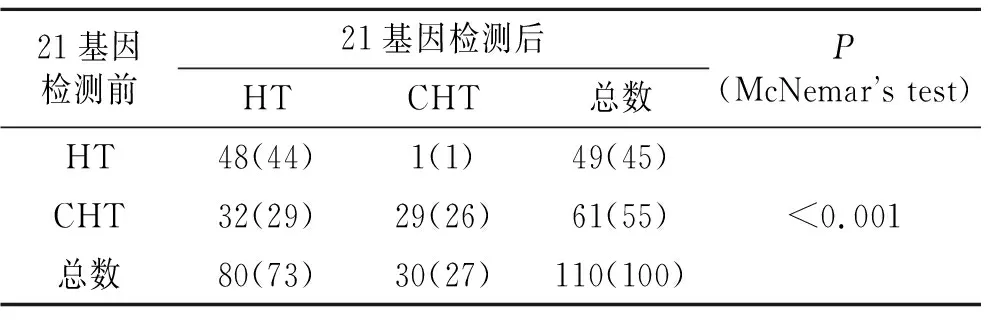
21基因检测前21基因检测后 HTCHT总数P(McNemars test)HT48(44)1(1)49(45)CHT32(29)29(26)61(55)总数80(73)30(27)110(100)<0.001
HT:辅助内分泌治疗;CHT:辅助化疗+辅助内分泌治疗。因观测频数过小,使用校正过的McNemar卡方检验。P<0.05为具有统计学意义。
2.4 国内外不同研究中21基因复发风险评分前后医师治疗决策改变的对比本研究与其他7国的相关研究相比,皆显示21基因检测可减少低复发风险的早期乳腺癌患者的术后辅助化疗率,韩国LEE等[16]研究显示,行21基因检测评分后,有51%的早期乳腺癌患者可避免过度化疗带来的化疗副反应与经济压力,其治疗决策改变率最高。我国的治疗决策改变率在8国之中居中(表6)。
表5 不同组别检测21基因前后治疗决策的比较
Tab.5 Comparison of therapeutic decisions before and after the 21-gene test [n(%)]
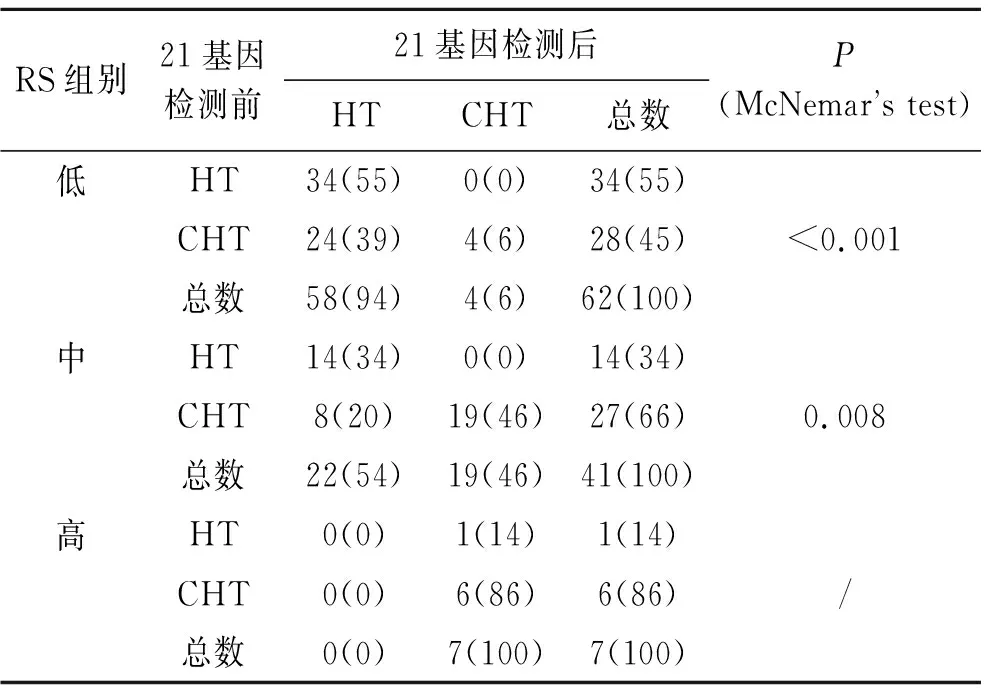
RS组别21基因检测前21基因检测后HTCHT总数P(McNemars test)低HT34(55)0(0)34(55)CHT24(39)4(6)28(45)总数58(94)4(6)62(100)<0.001中HT14(34)0(0)14(34)CHT8(20)19(46)27(66)总数22(54)19(46)41(100)0.008高HT0(0)1(14)1(14)CHT0(0)6(86)6(86)总数0(0)7(100)7(100)/
RS:21基因检测复发分数;HT:辅助内分泌治疗;CHT:辅助化疗+辅助内分泌治疗。因存在观测频数过小,使用校正过的McNemar卡方检验。P<0.05为具有统计学意义。
表6 行21基因检测评分前后治疗决策改变的多研究对比
Tab.6 The multiple studies’ comparison of treatment decisions before and afterthe 21-gene test
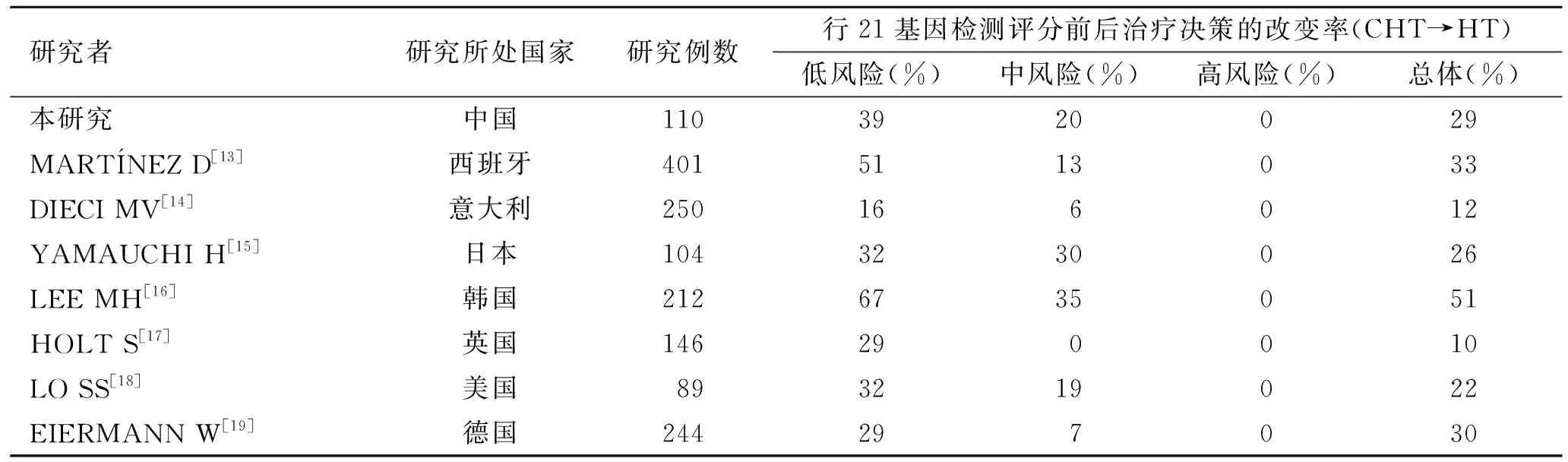
研究者研究所处国家研究例数行21基因检测评分前后治疗决策的改变率(CHT→HT)低风险(%)中风险(%)高风险(%)总体(%)本研究中国1103920029MARTÍNEZ D[13]西班牙4015113033DIECI MV[14] 意大利250166012YAMAUCHI H[15] 日本1043230026LEE MH[16]韩国2126735051HOLT S[17] 英国146290010LO SS[18] 美国893219022EIERMANN W[19] 德国244297030
HT:辅助内分泌治疗;CHT:辅助化疗+辅助内分泌治疗。
2.5 随访对所有纳入患者的随访截至2018年底,中位随访时间为37月(3年零1月)。随访方式为病例系统住院号跟踪,门诊复查跟踪登记以及定期电话随访,未出现局部以及远处复发和转移。仅有1例患者非乳腺癌相关因素死亡,其21基因复发风险评分为29分(归类为中危组),并且其接受了术后的辅助化疗与联合内分泌治疗。
3 讨 论
随着精准医疗的发展,基因组学的研究有助于更加精准针对每一个患者自身的情况制定个体化的治疗方案。21基因检测复发风险评分可准确预测乳腺癌患者长期复发的风险,从而协助临床医师制定个体化的治疗方案,避免过度治疗或治疗不足。但21基因检测最早是由美国Genomic Health公司研发的一款基因检测方案,且大样本量前瞻性TAILORx试验结果显示:复发风险评分位于低危组的早期乳腺癌患者仅使用术后辅助内分泌治疗就可降低复发率,避免联合辅助化疗[20]。RxPONDER前瞻性临床试验也进一步发现了21基因复发风险评分影响临床医师对淋巴结阳性早期乳腺癌患者的化疗建议[21]。但由于21基因检测价格昂贵且尚未纳入我国医疗保险体系,所以相关研究在我国开展较少。
本研究针对在我院行手术治疗且术后行21基因检测评分的早期激素受体阳性、淋巴结阴性的110例乳腺癌患者,根据评价标准,将患者分为低、中、高风险组,比较21基因检测前后治疗决策的变化。研究结果显示与国外多数类似,在基因检测之后,29%的乳腺癌患者的治疗方案从化疗联合内分泌治疗更换为单纯行辅助内分泌治疗(McNemar’s test,P<0.001)。尤其在低危组和中危组中,分别有39%和20%的患者改为单纯行术后辅助内分泌治疗(McNemar’s test,P<0.001;P=0.008),治疗决策前后的变化具有统计学意义。从随访中可看出,中位随访37月,未出现局部以及远处的乳腺癌复发或转移,这说明21基因检测在我国指导乳腺癌患者临床决策方面的成功性,21基因检测使得39%的低危组乳腺癌患者免于化疗,20%的中度危险者也免于化疗,且长期随访显示不仅低危组患者,甚至中危组免于化疗的患者临床生存良好,并未出现乳腺癌相关的复发、转移。这说明21基因检测在我国指导乳腺癌临床决策上的初步适用性及实用性得到了一定程度的验证。由此提出,21基因检测可应用于我国早期乳腺癌患者中,协助临床医师在临床病理及免疫组化的基础上,制定患者术后辅助治疗决策,从而筛选出远期复发风险较低的乳腺癌患者,使得这些患者免于不必要的术后辅助化疗,从而减少化疗副反应引起的患者生活质量减低,也减轻了患者的经济与心理负担。
本研究进一步将21基因检测前后治疗决策的改变率与国外的不同研究结果进行了对比。结果显示,我国的治疗决策改变率在8国之中居中(英国10%,意大利12%,美国22%,日本26%,我国29%,德国30%,西班牙33%,韩国51%)[13-19]。可以看出,本研究补充了中国相关研究领域的数据,提高了21基因检测复发风险评分在我国早期乳腺癌的术后辅助治疗决策的制定方向中的指导地位。但本研究的治疗决策改变率较高也同时受到纳入患者偏倚的影响。目前我国多针对由临床病理特征初判为低危的乳腺癌患者行21基因检测,而初判为高危的乳腺癌患者往往不进行基因检测而直接选择化疗。所以使得纳入的中低危组的患者比例增多,从而使得治疗决策改变率增加。
目前,随着乳腺癌基因检测相关研究逐步增加,国内外21基因复发风险评分的应用范围也不仅仅局限于早期乳腺癌患者,研究显示该检测也可对激素受体阴性乳腺癌患者提供治疗决策及预后相关信息[22]。基因检测预测乳腺癌术后远期复发将为个体化精准医疗补充更多临床数据,其在我国乳腺癌患者中的应用效果有待更大数据量的循证医学验证。
