边缘前皮质α1受体调节帕金森病焦虑模型大鼠杏仁核的活动
2019-10-24吴仲恒李立博李文娟郭方圆张巧俊
吴仲恒,李立博,王 涛,李文娟,席 悦,郭方圆,张巧俊
(1. 西安交通大学第二附属医院康复医学科,陕西西安 710004;2. 西安交通大学医学部基础医学院生理学与病理生理学系,陕西西安 710061)
帕金森病(Parkinson’s disease, PD)是一种以运动障碍(运动迟缓、肌强直和静止性震颤等)为特征的疾病,同时还具有广泛的非运动系统表现(如焦虑、抑郁等)[1]。帕金森病患者焦虑症的患病率为25%~52%,焦虑既可以是抑郁障碍中的特征,也可以独立于抑郁发生,但发病机制目前仍不清楚[2-3]。人类和啮齿类动物的研究证据显示,内侧前额叶皮质(medial prefrontal cortex, mPFC)的边缘前皮质(prelimbic cortex, PrL)亚区通过与杏仁核双向联系调节恐惧和焦虑行为的表达[4]。本课题组前期研究也证实,6-羟基多巴胺(6-hydroxydopamine, 6-OHDA)单侧损毁内侧前脑束(medial forebrain bundle, MFB)的PD模型大鼠产生焦虑样行为[5-6],这些改变与PrL中谷氨酸能神经元过度活动以及杏仁核中多巴胺(dopamine, DA)含量下降有关[5-7]。PD患者或动物模型的5-羟色胺能(serotonin, 5-HT)和去甲肾上腺素能(noradrenaline, NA)递质系统亦受到显著影响[5-8]。其中,α1肾上腺素受体(α1受体)在与焦虑等情感行为调节的mPFC和杏仁核中表达丰富[9]。仅有少量研究显示,体循环给予α1受体激动剂苯肾上腺素可以逆转尼古丁所导致的小鼠焦虑样行为[10];α1受体拮抗剂哌唑嗪在斑马鱼剥夺睡眠的焦虑模型中可产生抗焦虑样作用[11]。我们推测,激活或阻断PrL内α1受体可能通过调节PrL和杏仁核活动参与PD焦虑样行为的调节,但目前尚未见相关研究报道。
因此,本研究以6-OHDA损毁的PD模型大鼠为对象,观察激活或阻断PrL内α1受体对大鼠焦虑样行为的影响及对杏仁核内单胺类递质含量和c-Fos表达的影响。阐明PrL内α1受体激活或阻断对PD相关焦虑样行为及杏仁核活动的影响。
1 材料与方法
1.1 实验动物选择体质量240~330 g的雄性Sprague-Dawley大鼠(西安交通大学医学部实验动物中心提供)。动物许可证号:SCXK(陕)2012-003。大鼠在标准环境下饲养[12 h昼/夜循环,室温(22±2)℃]并自由饮水、摄食。
1.2 主要试剂与仪器6-OHDA、阿朴吗啡(apomorphine, APO)、苯肾上腺素(phenylephrine, 选择性α1受体激动剂)和苯那沙坦(benoxathian,选择性α1受体拮抗剂)等购自美国Sigma公司;酪氨酸羟化酶(tyrosine hydroxylase, TH)试剂盒、多克隆兔抗c-Fos购自美国Chemicon公司。主要仪器包括脑立体定位仪(SN-2N,日本Narishige公司)、高效液相色谱系统(美国ESA公司)、数码摄像机(HR-550E,日本SONY公司)和微量注射器(上海安亭微量进样器厂)等。
1.3 大鼠PD模型的建立与分组根据Paxinos-Watson大鼠脑立体定位图谱确定右侧MFB位置(AP -4.3~4.4 mm,ML 1.2~1.3 mm, DV 7.8 mm距硬脑膜)[12]。模型具体制备过程参照前期的研究[5-7]。模型组大鼠MFB内注射6-OHDA(12 μg/4 μL),假手术组大鼠注射4 μL生理盐水作为对照。手术1周后,采用APO诱发旋转实验评估6-OHDA损毁是否成功。大鼠颈部皮下注射APO(0.05 mg/kg),药物注射后15 min内如果大鼠出现向损毁对侧的持续旋转行为,且>20圈/5 min判定为合格的PD模型,可用于进一步的实验[13]。
假手术组及PD模型组大鼠进行随机分组如下:生理盐水/生理盐水(n=10)、生理盐水/苯肾上腺素(n=10)、生理盐水/苯那沙坦(n=10)、苯那沙坦/苯肾上腺素(n=8)。
1.4 导向套管的埋置和PrL内药物注射参考Paxinos-Watson大鼠脑立体定位图谱确定右侧PrL位置(AP +3.3 mm,ML 0.7 mm,DV 1.8~2.0 mm距硬脑膜)[12]。导向套管埋置过程参考前期的研究[5-6]。大鼠在套管埋置手术完成后恢复1周后进行导管内给药。拔出内芯后将1 μL微量注射器插入导向套管(尖端位于套管末端下1 mm),每次注射药物或溶媒0.5 μL,注射时间60 s,留针60 s后移除。苯那沙坦5 μg/只,苯肾上腺素10 μg/只。药物注射后10 min开始行为学实验测试,注射间隔5 min,剂量选择基于大鼠在体实验报道[14-15]。
1.5 行为学实验所有行为学实验均在MFB内注射生理盐水或6-OHDA后第4周内进行。测试时间定于上午9∶00-12∶00,检测地点选择一间隔音的房间。整个过程用HR-550E数码相机记录,结果由2名不了解实验分组情况的观察人员进行分析。旷场实验通过测定大鼠在中央区内停留时间百分比反映焦虑样行为[16]。中央区停留时间百分比=[中央区停留时间(s)/300(s)]×100%,该值降低提示焦虑样行为的出现。
1.6 组织学与免疫组织化学检测行为学实验完成后,采用水合氯醛(600 mg/kg, i.p.)对大鼠进行深度麻醉,然后应用0.01 mol/L PBS溶液150 mL快速心脏灌注,40 g/L多聚甲醛250 mL固定。断头、剥离脑组织,将剥离好的脑组织后固定4 h后转移至含蔗糖溶液(质量浓度300 g/L)中直至沉底。在恒冷切片机上行连续冠状冰冻切片,片厚30 μm,收集包含PrL结构的组织切片行尼式染色,观察PrL基本结构、确定套管埋置位置。对包含黑质致密部(substantia nigra compacta, SNc)和腹侧被盖区(ventral tegmental area, VTA)区的组织切片行酪氨酸羟化酶(tyrosine hydroxylase, TH)免疫组织化学染色,观察DA神经元的变性丢失程度评估MFB损毁情况。TH染色后对SNc及VTA中DA能神经元计数,每只大鼠选取3张切片计数,取平均值。
1.7 单胺类递质含量的测定6-OHDA损毁MFB后第4周,采用高效液相色谱-电化学检测法(HPLC-ED)测定假手术组和损毁组大鼠杏仁核DA、NA和5-HT 3种单胺类递质的含量。通过导向套管向假手术组和PD模型组大鼠PrL内注射生理盐水(n=10)、苯肾上腺素(n=10)、苯那沙坦(n=10)或苯那沙坦/苯肾上腺素(n=8),容积每只0.5 μL,给药及检测方法参照既往研究报道[17]。
2 结 果
2.1 PrL内的注射位点尼氏染色显微照片显示假手术组大鼠PrL内的注射位点(黑色箭头,图1)。

图1 PrL注射位点
Fig.1 The injection site of the PrL
大鼠脑立体定位图谱显示PrL冠状切面模式图(前囟+3.2 mm,右侧)引自Paxinos G and Watson C[12]。标尺:500 μm。
2.2 TH阳性神经元计数在假手术组大鼠,SNc和VTA区TH免疫阳性神经元的平均密度分别为(163±3)个/mm2、(291±8)个/mm2(n=8);在PD模型组大鼠,SNc和VTA区TH免疫阳性神经元的平均密度分别为(6±4)个/mm2、(84±5)个/mm2(n=10)。与假手术组大鼠比较,PD模型组大鼠SNc和VTA区TH免疫阳性的神经元数目均下降(t=116.00,P<0.001,图2、图3)。

图2 大鼠SNc和VTA区TH免疫阳性神经元计数
Fig.2 Counts of TH immunoreactive positive neurons in the SNc and VTA
与假手术组比较,***P<0.001。
2.3 6-OHDA损毁、激活和阻断PrL内α1受体对大鼠焦虑样行为的影响旷场实验中,各组中央区停留百分比符合方差齐性(F=2.864,P<0.05)。双因素方差分析(损毁×药物)显示损毁因素(F1,76=18.859,P<0.001)和药物因素(F3,76=30.137,P<0.001)均能对大鼠的中央区停留时间百分比产生影响。两两比较显示,与局部注射生理盐水相比,PrL内注射苯肾上腺素降低了假手术组和PD模型组大鼠在中央区停留时间的百分比(假手术组P<0.001,PD模型组P<0.05,图4),表明诱导焦虑样反应。与苯肾上腺素作用相比,苯那沙坦增加两组大鼠在中央区停留时间的百分比(假手术组P<0.001;损毁组P<0.05),表明抗焦虑样反应。若假手术组和损毁组大鼠预先给予苯那沙坦则可以阻断苯肾上腺素的效应(P<0.001,图4)。

图3 中脑冠状位TH免疫组织化学染色显微照片
Fig.3 TH immunohistochemical staining of mesencephalic coronal sections
A和B分别为代表性的假手术组和PD模型组大鼠SNc和VTA的TH染色结果,左侧为注射侧,右侧为未注射侧。MTN:内侧终核(medial terminal nucleus of the accessory optic tract)。

图4 旷场实验观察6-OHDA单侧损毁MFB和PrL内注射α1受体激动剂或拮抗剂对大鼠焦虑样行为的影响
Fig.4 Histograms showing the effects of 6-OHDA lesion, intra-PrL injection of the α1-adrenoceptor agonist phenylephrine and antagonist benoxathian on anxiety-like behavior measured by the open field test
与假手术组(Sham)相比,***P<0.001;与同组内注射生理盐水组(Saline/Saline)相比,#P<0.05,###P<0.001;与同组内注射苯肾上腺素组(Saline/Benoxathian)相比,&&&P<0.001。
2.4 6-OHDA损毁、激活和阻断PrL内α1受体对杏仁核单胺类递质含量的影响与假手术组相比,6-OHDA单侧损毁MFB降低了大鼠损毁侧杏仁核中的DA含量(t=11.073,P<0.001),而损毁并没有改变这些脑区中NA和5-HT的含量(图5)。

图5 6-OHDA 单侧损毁MFB对杏仁核DA、NA和5-HT含量的影响
Fig.5 Effects of 6-OHDA lesion on DA, NA and 5-HT in theamygdala
与假手术组比较,***P<0.001。
PrL内局部注射苯肾上腺素对杏仁核中单胺类递质水平的影响见图6。在假手术组大鼠,与PrL内注射生理盐水相比,PrL内给予苯肾上腺素增加了杏仁核内DA水平(P<0.001,图6A),但并没有改变杏仁核内NA的水平(图6C)。苯肾上腺素显著增加假手术组大鼠杏仁核内5-HT含量(P<0.001,图6E)。在PD模型组大鼠,相同剂量的苯肾上腺素增加了杏仁核中NA含量(P<0.01,图6C),但杏仁核内DA水平并未发生改变(图6A)。同时,苯肾上腺素增加PD模型组大鼠杏仁核内5-HT水平(P<0.001,图6E)。
PrL内局部注射苯那沙坦对杏仁核中单胺类递质水平的影响见图6。在假手术组大鼠,与PrL内注射生理盐水相比,PrL内给予苯那沙坦明显降低了杏仁核内DA水平(P<0.001,图6B),但并没有改变杏仁核内NA的水平(图6D)。苯那沙坦降低假手术组大鼠杏仁核内5-HT含量(P<0.001,图6F)。在PD模型组大鼠,相同剂量的苯那沙坦降低了杏仁核中NA 含量(P<0.001,图6D),但杏仁核内DA水平并未发生改变(图6B)。同时,苯那沙坦降低损毁组大鼠杏仁核内5-HT水平(P<0.001,图6F)。
2.5 激活和阻断PrL内α1受体对杏仁核c-Fos表达的影响PrL内局部注射苯肾上腺素或苯那沙坦后,对杏仁核中c-Fos表达阳性神经元密度的影响见图7。在假手术组大鼠,PrL局部注射生理盐水后,杏仁核中c-Fos表达阳性神经元的平均密度为(796±21)个/mm2(n=8),PrL内局部注射苯肾上腺素或苯那沙坦后,杏仁核中c-Fos表达阳性神经元的平均密度分别为(1 160±46)、(758±30)个/mm2(n=8),与注射生理盐水组相比,局部注射苯肾上腺素后,杏仁核中c-Fos表达阳性神经元的平均密度显著增加(n=8,P<0.001);在PD模型组大鼠,PrL局部注射生理盐水后,杏仁核中c-Fos表达阳性神经元的平均密度为(726±40)个/mm2(n=8),PrL内局部注射苯肾上腺素或苯那沙坦后,杏仁核中c-Fos表达阳性神经元的平均密度分别为(1 249±12)、(655±78)/mm2(n=8),与注射生理盐水相比,局部注射苯肾上腺素后,杏仁核中表达c-Fos阳性神经元的平均密度增多(n=8,P<0.001)。而PrL局部注射苯那沙坦后,两组大鼠的杏仁核中c-Fos表达阳性神经元的平均密度均未发生变化。

图6 PrL内给予α1受体激动剂苯肾上腺素和拮抗剂苯那沙坦对杏仁核内3种单胺类递质含量的影响
Fig.6 Effects of intra-PrL injection of the α1-adrenoceptor agonist phenylephrine and antagonist benoxathian on the levels of three monoamines in the amygdala
与注射生理盐水组(Saline)大鼠比较,**P<0.01,***P<0.001。
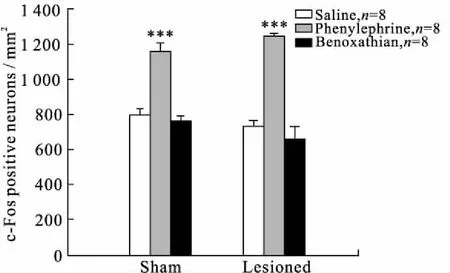
图7 PrL局部注射α1受体激动剂苯肾上腺素或拮抗剂苯那沙坦对mPFC和杏仁核中c-Fos表达的影响
Fig.7 Effect of intra-PrL injection of the α1-adrenoceptor agonist phenylephrine or antagonist benoxathian on the c-Fos expression in the amygdala
与注射生理盐水组(Saline)大鼠比较,***P<0.001。
3 讨 论
本实验的主要研究结果有以下几方面:①6-OHDA单侧损毁MFB后诱发大鼠产生焦虑样行为;②在假手术组及损毁组大鼠,PrL局部给予α1受体激动剂苯肾上腺素可诱导大鼠产生焦虑样行为,而α1受体拮抗剂苯那沙坦产生了抗焦虑样效应;③6-OHDA损毁MFB后杏仁核内DA含量下降;激活或阻断PrL内α1受体在假手术组大鼠分别增加或降低了杏仁核内DA和5-HT含量,而损毁组大鼠则增加或降低了NA和5-HT含量;④激活2组大鼠PrL内α1受体后杏仁核内c-Fos阳性神经元表达密度增加。
焦虑是PD患者常见的非运动系统症状之一,但PD动物模型是否存在类似于人类的焦虑样行为,目前研究结果不一致:一些研究显示PD模型大鼠表现焦虑样的行为[18-19],而另一些研究显示PD模型大鼠无焦虑样的行为特征[20-21]。出现以上研究分歧的原因可能是:6-OHDA损毁部位(如MFB、SNc或纹状体)的不同、6-OHDA损毁侧(单侧或双侧损毁)及损毁程度(完全或部分损毁)的区别以及行为学测试方法差异(旷场实验、高架十字迷宫实验或社会干预)等。本研究结果显示,6-OHDA损毁MFB后的PD模型大鼠在旷场中央区停留时间百分比下降,表现出焦虑样特征,同时,杏仁核内DA含量显著下降,而NA和5-HT含量无明显变化。这一结果与课题组前期研究相一致[5-6]。
神经解剖学研究显示,PrL发出谷氨酸能纤维投射到杏仁核[22],PrL神经活动的变化可能通过影响杏仁核活动并参与焦虑样行为的调节[5-6]。既往行为学研究表明:体循环给予α1受体激动剂苯肾上腺素可诱发焦虑样行为,而哌唑嗪可阻断α1受体发挥抗焦虑样作用[3]。大鼠杏仁中央核内局部微量注射α1受体拮抗剂苯那沙坦后,在社会干预(social interaction, SI)实验中阻断SI时间下降,表明具有抗焦虑作用[14]。但也有研究者得出不同的结论,伏隔核壳部微量注射α1受体激动剂苯肾上腺素后并未改变高架十字迷宫实验中开放臂停留时间及开放臂进入次数等焦虑样行为[15]。本研究结果显示,激活PrL内α1受体可诱发或增强假手术组和损毁组大鼠焦虑样行为,而阻断该受体则发挥抗焦虑样作用;同时,激活或阻断PrL内α1受体在假手术组大鼠分别增加或降低了杏仁核内DA和5-HT含量,而损毁组大鼠则增加或降低了NA和5-HT含量。这里比较有趣的现象是,刺激PrL的α1受体后两组大鼠杏仁核中5-HT呈同步升高或降低,但DA和NA递质变化不一致,假手术组主要改变DA含量,而PD模型组主要改变的是NA含量。参考前期的研究,我们发现,除DA系统受到显著影响外,PD患者或动物模型中缝背核(dorsal raphe nucleus, DRN)的5-HT能递质系统亦受到显著影响,主要包括:5-HT能神经元的丢失、5-HT递质水平下降、5-HT能神经元过度活动以及多种5-HT受体功能异常等[5-6,23-24]。研究还发现,PD患者或动物模型蓝斑(locus coeruleus, LC)出现显著退行性改变,LC的NA能递质系统变化可能是对DA递质系统的代偿[25],这种代偿机制可能是刺激模型组大鼠PrL内α1受体后主要影响NA而不是DA递质改变。α1受体激活或阻断参与了PrL内DA的神经传递[5-6,25]。据此我们推测:激活或阻断PrL内α1受体改变了Glu能神经元活动,进而发出直接纤维投射或通过影响VTA、LC以及DRN等活动间接影响包括杏仁核在内的边缘相关脑区三种单胺类递质水平,以及核团间复杂的相互作用,参与了PD相关焦虑的发生。
c-Fos是即刻早期基因c-Fos的表达产物,当神经元的受体被刺激后,c-Fos的表达可以短暂性地增强,所以c-Fos阳性细胞的分布密度可以用来评价急性的神经元活性,常用于研究深部脑刺激对相关脑区神经元活性的影响[26]。以往及最新的研究均提示mPFC和杏仁核内神经元活动的增强与焦虑行为相关[27-28]。本实验通过急性PrL内注射α1受体激动剂后观察杏仁核中c-Fos阳性神经元密度反映神经元活性,结果显示,PrL内局部注射α1受体激动剂苯肾上腺素后,杏仁核中的c-Fos阳性神经元密度增加。提示PrL内局部注射苯肾上腺素后,杏仁核中神经元活性增强,进一步解释了PrL内局部注射苯肾上腺素可能通过PrL与杏仁核间纤维联系,改变了杏仁核的神经活动,诱发焦虑样行为的产生。
综上所述,本研究结果证实了PrL内α1受体在调节焦虑行为中的重要作用,阐明了PrL中α1受体通过影响杏仁核的活动参与了PD焦虑样行为的调节。
