微卫星不稳定型胃癌及微卫星稳定型胃癌的免疫分型及预后分析
2019-10-24钱美睿李建辉韩渭丽李增山吴开春和水祥
麻 婧,钱美睿,李建辉,李 潇,韩渭丽,李增山,吴开春,和水祥
(1. 西安交通大学第一附属医院消化内科,陕西西安 710061;2. 空军军医大学第一附属医院消化病医院,肿瘤生物学国家重点实验室,陕西西安 710032;3. 空军军医大学第二附属医院传染科,陕西西安 710038;4. 空军军医大学第一附属医院病理科,陕西西安 710032)
错配修复(mismatch repair, MMR)是细胞复制的主要修复机制之一,用以维持基因组的稳定性。TCGA数据库分析显示[1],微卫星不稳定型(microsatellite instability, MSI)胃癌具有特征性的临床及表观遗传学表现(MLH1沉默、高度突变、高度甲基化等),可能与预后及免疫治疗疗效相关。进一步研究发现,与微卫星稳定型胃癌(microsatellite stability, MSS)相比,在MSI肿瘤的局部微环境中可见明显的免疫激活与抑制分子的表达,且与患者预后相关。针对微卫星相关胃癌的检测方法主要包括以下两种:免疫组织化学染色(MLH1、MSH2、MSH6、PMS2)和PCR法检测单核苷酸重复标志物(NR-27、NR-21、BAT-26、BAT-25、NR-24、MONO-27)。
PD-1/PD-L1是目前肿瘤免疫的明星分子[2],其单抗药物在PD-L1阳性的多种实体瘤治疗中均能明显延长疾病无进展生存期和总体生存期。本课题组联合PD-L1表达和CD8阳性T细胞浸润状态,将胃癌分为4种类型,包括Ⅰ型(CD8+PD-L1+)、Ⅱ型(CD8-PD-L1-)、Ⅲ型(CD8-PD-L1+)、Ⅳ型(CD8+PD-L1-),其中Ⅳ型胃癌预后最好[3]。此外,肿瘤微环境中巨噬细胞的浸润与肿瘤的进展及生存预后密切相关。本课题旨在研究MSI胃癌微环境中CD8、CD68、PD-1和PD-L1的表达情况及免疫分型占比,并分析其对预后的影响。
1 对象与方法
1.1 病例来源纳入2012年3月至2012年8月于空军军医大学第一附属医院消化病医院行外科手术切除的60例原发胃癌患者,术前未进行其他相关治疗。术后从病理科调取石蜡组织,连续切片10张,厚度5 μm。病理分期根据国际抗癌联盟(Union for International Cancer Control, UICC)第8版胃癌分期标准进行分期。患者的临床病理资料由病历系统收集获得,预后信息通过电话随访获得。本研究通过空军军医大学第一附属医院伦理委员会的审核批准。
1.2 免疫组织化学染色及原位杂交石蜡切片行常规HE染色及免疫组织化学染色,兔抗人单克隆抗体MLH1(ES05,DAKO),MSH2(FE11,DAKO),MSH6(EP49,DAKO),PMS2(EP51,DAKO),鼠抗人单克隆抗体CD68(KP1,DAKO),CD8(C8/144B,CST),兔抗人单克隆抗体PD-L1(SP142,Ventana),羊抗人多克隆抗体PD-1(AF1086,R&D)。结肠上皮黏膜及间质内的淋巴细胞明确的核着色阳性为阳性对照,一抗稀释液(CST)为空白对照。EB病毒检测采用EBER原位杂交(中山金桥),按说明书操作,选取FISH确诊的EBV阳性淋巴瘤组织切片为阳性对照组织。
1.3 染色结果判读MMR蛋白在肿瘤细胞核明确着色表达判定为阳性,任何比率肿瘤细胞的阳性均视为阳性;PD-L1染色阳性细胞(包括肿瘤细胞和间质细胞)比例大于1%视为阳性;CD8染色阳性细胞在间质细胞中比例大于5%视为阳性;PD-1染色阳性细胞在间质细胞中比例大于1%视为阳性。
1.4 生存分析无病生存期定义为患者自接受手术日至出现局部复发、远处转移或最后1次随访的时间,患者死亡或失访以删失值处理。总生存期定义为患者自手术日至因任何原因死亡或最后1次随访的时间。总体随访时间为60个月。
1.5 统计学处理应用SPSS 22.0进行统计学分析。计量资料采用独立样本t检验,计数资料采用卡方检验,等级资料采用非参数检验,生存分析采用Log-rank秩检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 基本临床病理学资料60例胃癌患者的肿瘤部位,浸润深度,分化程度,肿瘤性质,AJCC分期,脉管/神经侵犯,血清CEA、CA199、CA125水平,HER2表达及EBV感染状态见表1。MLH1、MSH2、MSH6和PMS2阳性表达率分别为38.3%(23/60)、56.7%(34/60)、71.7%(43/60)和33.3%(20/60)。MLH1、MSH2、MSH6和PMS2均为阳性病例(MSS_1)为23.3%(14/60),均为阴性(MSI)病例为25.0%(15/60),任一分子为阳性病例(MSS_2)为51.7%(31/60)。PMS2单独缺失病例10.0%(6/60),MSH2单独缺失病例1.7%(1/60),MLH1单独缺失病例1.7%(1/60)。MLH1、MSH2、MSH6、PMS2、CD8、CD68、PD-1、PD-L1免疫组织化学染色阳性组织及EBER原位杂交阳性组织代表图片见图1。MSI胃癌血清CA199水平(179.19±166.52)高于MSS胃癌(51.85±20.91),差异有统计学意义(P=0.009)。
表1 60例胃癌样本的临床病理学资料
Tab.1 Clinical pathological characteristics of the 60 gastric cancer samples [n(%)]
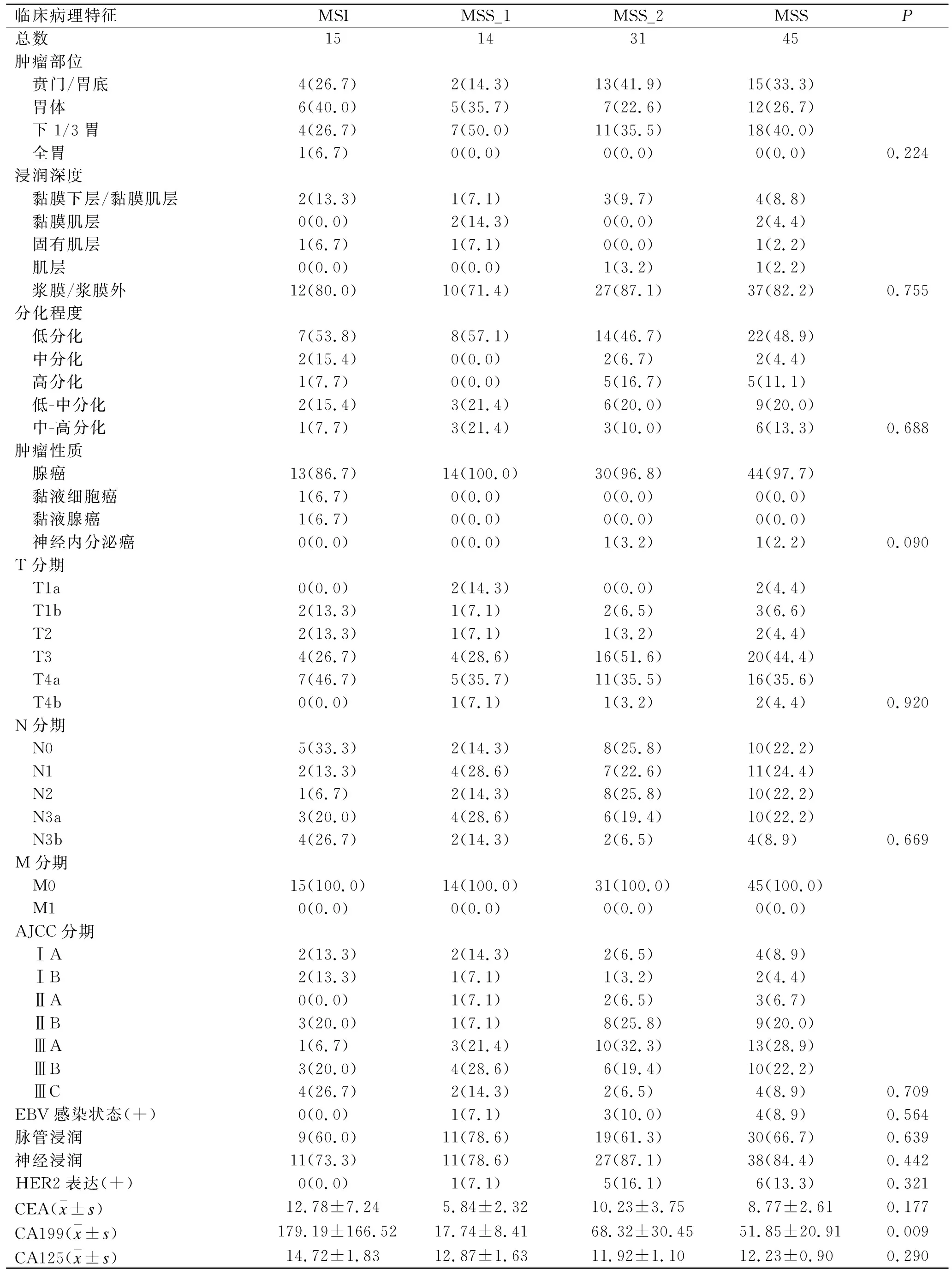
临床病理特征MSIMSS_1MSS_2MSSP总数15143145肿瘤部位 贲门/胃底4(26.7)2(14.3)13(41.9)15(33.3) 胃体6(40.0)5(35.7)7(22.6)12(26.7) 下1/3胃4(26.7)7(50.0)11(35.5)18(40.0) 全胃1(6.7)0(0.0)0(0.0)0(0.0)0.224浸润深度 黏膜下层/黏膜肌层2(13.3)1(7.1)3(9.7)4(8.8) 黏膜肌层0(0.0)2(14.3)0(0.0)2(4.4) 固有肌层1(6.7)1(7.1)0(0.0)1(2.2) 肌层0(0.0)0(0.0)1(3.2)1(2.2) 浆膜/浆膜外12(80.0)10(71.4)27(87.1)37(82.2)0.755分化程度 低分化7(53.8)8(57.1)14(46.7)22(48.9) 中分化2(15.4)0(0.0)2(6.7)2(4.4) 高分化1(7.7)0(0.0)5(16.7)5(11.1) 低-中分化2(15.4)3(21.4)6(20.0)9(20.0) 中-高分化1(7.7)3(21.4)3(10.0)6(13.3)0.688肿瘤性质 腺癌13(86.7)14(100.0)30(96.8)44(97.7) 黏液细胞癌1(6.7)0(0.0)0(0.0)0(0.0) 黏液腺癌1(6.7)0(0.0)0(0.0)0(0.0) 神经内分泌癌0(0.0)0(0.0)1(3.2)1(2.2)0.090T分期 T1a0(0.0)2(14.3)0(0.0)2(4.4) T1b2(13.3)1(7.1)2(6.5)3(6.6) T22(13.3)1(7.1)1(3.2)2(4.4) T34(26.7)4(28.6)16(51.6)20(44.4) T4a7(46.7)5(35.7)11(35.5)16(35.6) T4b0(0.0)1(7.1)1(3.2)2(4.4)0.920N分期 N05(33.3)2(14.3)8(25.8)10(22.2) N12(13.3)4(28.6)7(22.6)11(24.4) N21(6.7)2(14.3)8(25.8)10(22.2) N3a3(20.0)4(28.6)6(19.4)10(22.2) N3b4(26.7)2(14.3)2(6.5)4(8.9)0.669M分期 M015(100.0)14(100.0)31(100.0)45(100.0) M10(0.0)0(0.0)0(0.0)0(0.0)AJCC分期 ⅠA2(13.3)2(14.3)2(6.5)4(8.9) ⅠB2(13.3)1(7.1)1(3.2)2(4.4) ⅡA0(0.0)1(7.1)2(6.5)3(6.7) ⅡB3(20.0)1(7.1)8(25.8)9(20.0) ⅢA1(6.7)3(21.4)10(32.3)13(28.9) ⅢB3(20.0)4(28.6)6(19.4)10(22.2) ⅢC4(26.7)2(14.3)2(6.5)4(8.9)0.709EBV感染状态(+)0(0.0)1(7.1)3(10.0)4(8.9)0.564脉管浸润9(60.0)11(78.6)19(61.3)30(66.7)0.639神经浸润11(73.3)11(78.6)27(87.1)38(84.4)0.442HER2表达(+)0(0.0)1(7.1)5(16.1)6(13.3)0.321CEA(x±s)12.78±7.245.84±2.3210.23±3.758.77±2.610.177CA199(x±s)179.19±166.5217.74±8.4168.32±30.4551.85±20.910.009CA125(x±s)14.72±1.8312.87±1.6311.92±1.1012.23±0.900.290
P值均为MSS与MSI比较获得。
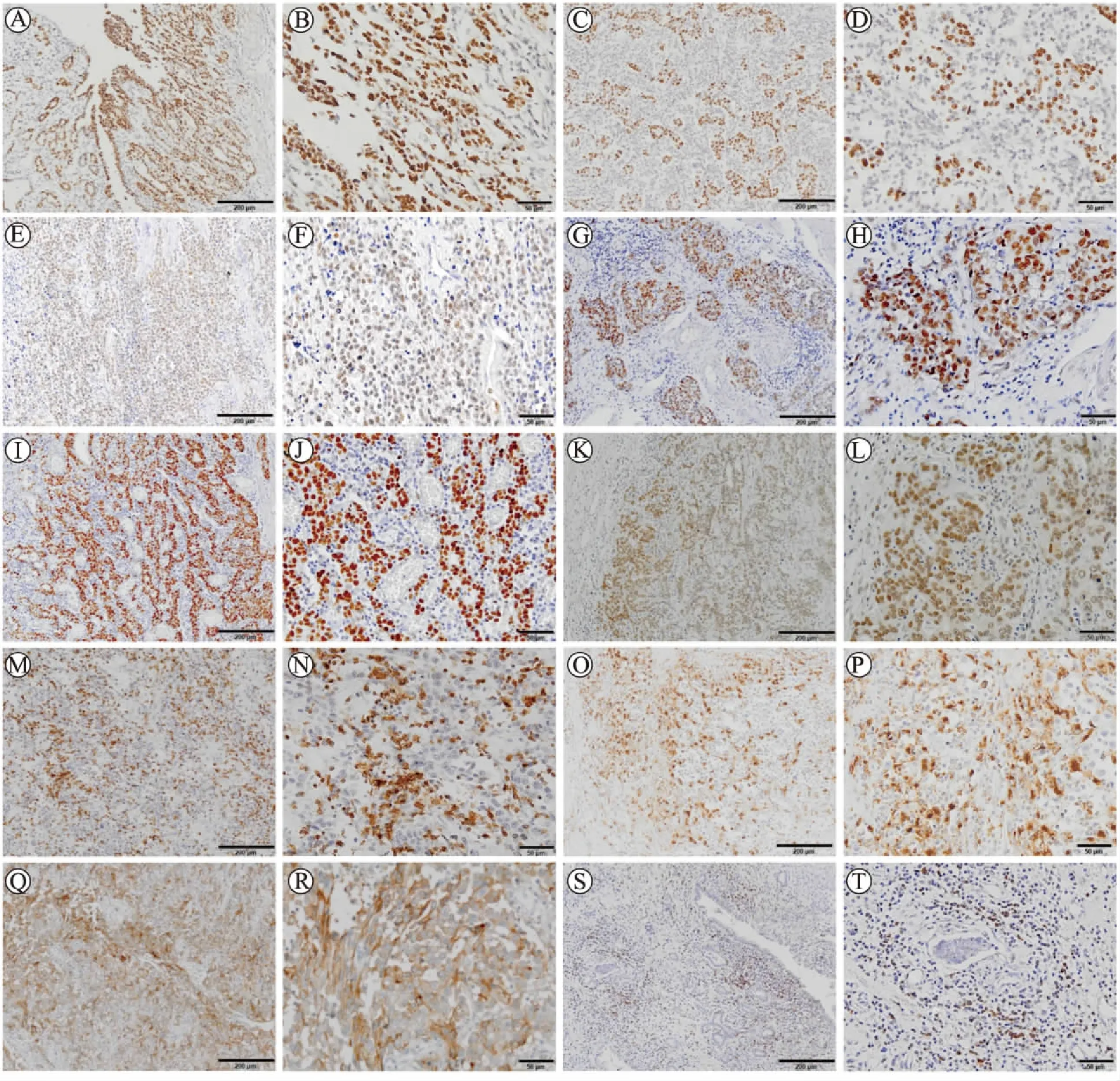
图1 免疫组织化学染色及原位杂交
Fig.1 Immunohistochemistry (IHC) and in situ hybridization (ISH)
A~D:EBER原位杂交阳性病例;E~F:MLH1染色阳性;G~H:MSH2染色阳性;I~J:MSH6染色阳性;K~L:PMS2染色阳性;M~N:CD8染色阳性;O~P:CD68染色阳性;Q~R:PD-L1染色阳性;S~T:PD-1染色阳性。A、C、E、G、I、K、M、O、Q和S的bar值为200 μm,×10;B、D、F、H、J、L、N、P、R和T的bar值为50 μm,×40。
2.2 CD8、CD68、PD-1、PD-L1在MSI及MSS胃癌中的表达CD8、CD68、PD-1、PD-L1阳性染色结果见表2。CD8、PD-1及PD-L1在MSI和MSS病例中的表达差异无统计学意义(P=0.179、0.881、0.757);CD68在MSS中的阳性率明显高于MSI组,差异有统计学意义(P=0.046)。
2.3 胃癌免疫分型在MSI/MSS中的占比MSI胃癌中免疫分型Ⅰ型(CD8+PD-L1+)、Ⅱ型(CD8-PD-L1-)、Ⅲ型(CD8-PD-L1+)及Ⅳ型(CD8+PD-L1-)的比例依次为20.00%、46.67%、20.00%及13.33%;MSS胃癌中上述比例依次为22.22%、33.33%、13.33%及31.11%(图2)。
2.4 生存分析60例胃癌患者在60个月随访中未出现失访病例。MSI胃癌患者在60个月随访中疾病复发/转移病例(5/15)及死亡病例(5/15)均未达到一半;MSS胃癌患者60个月随访中疾病复发/转移病例及死亡病例均为30例,疾病无进展中位生存时间为25个月,总体中位生存时间为29个月。Log-rank生存分析显示,MSI胃癌患者的疾病无进展生存时间(P=0.036)及总体生存时间(P=0.041)均长于MSS胃癌患者,差异具有统计学意义(图3)。
表2 CD8、CD68、PD-L1及PD-1在MSI和MSS胃癌中的表达
Tab.2 The expressions of CD8, CD68, PD-L1 and PD-1 in MSI and MSS gastric cancer [n(%)]
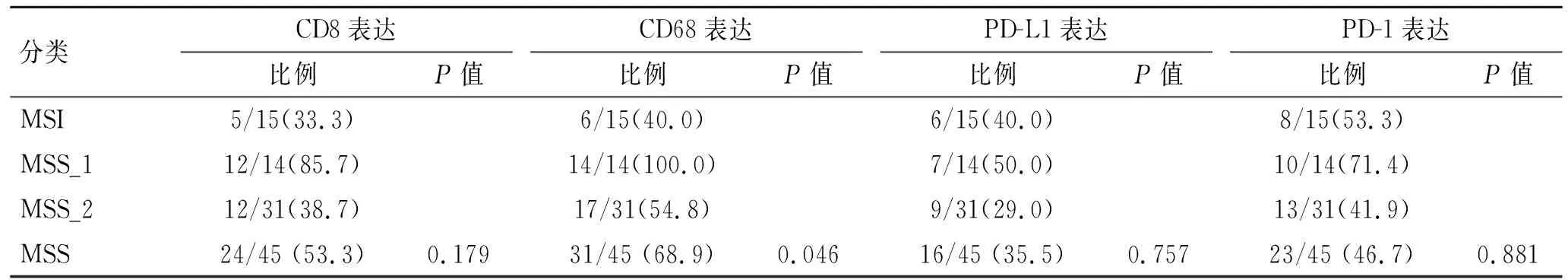
分类CD8表达比例P值CD68表达比例P值PD-L1表达比例P值PD-1表达比例P值MSI5/15(33.3)6/15(40.0)6/15(40.0)8/15(53.3)MSS_112/14(85.7)14/14(100.0)7/14(50.0)10/14(71.4)MSS_212/31(38.7)17/31(54.8)9/31(29.0)13/31(41.9)MSS24/45 (53.3)0.17931/45 (68.9)0.04616/45 (35.5)0.75723/45 (46.7)0.881
MSS: MSS_1+MSS_2;P值均为MSS与MSI比较获得。
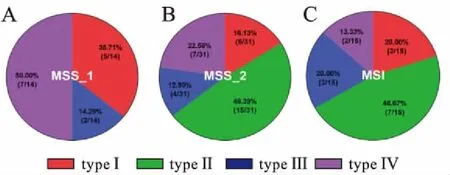
图2 MSI和MSS胃癌中各免疫分型占比
Fig.2 The percentage of immune types in MSI and MSS gastric cancer
3 讨 论
2014年,TCGA[1]提出了一套全新的胃癌分子分型,包括EBV阳性胃癌、微卫星不稳定型(MSI)胃癌、基因组稳定和染色体不稳定型胃癌。其中,MSI胃癌具有高度突变、高度甲基化、MLH1沉默等特点。在结直肠癌及胃癌中,已经证实组织化学染色预测MSI具有更高的敏感性和特异性[4]。在一小部分微卫星高度不稳定的肿瘤中,除了MLH1和MLH2外还有其他基因可发生突变,如PMS2和MSH6[5]。我们用免疫组织化学染色方法检测MLH1、MSH2、MSH6和PMS2水平,全面评估胃癌错配修复相关分子的表达状态。
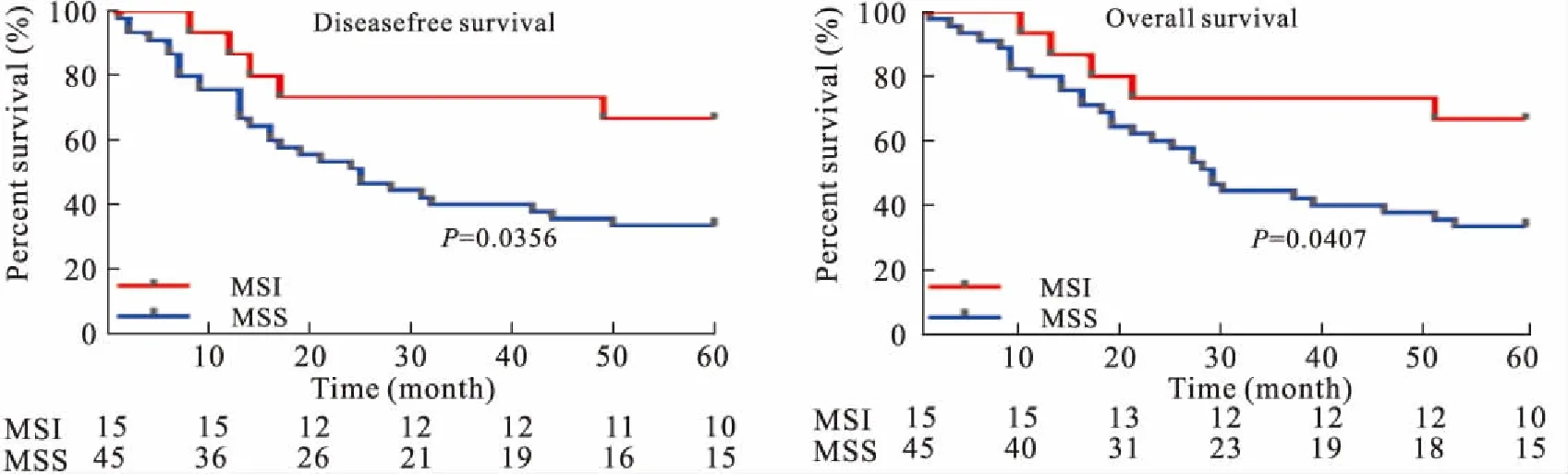
图3 MSI和MSS胃癌的疾病无进展生存(disease-free survival)和总体生存(overall survival)分析
Fig.3 Disease-free survival and overall survival in MSI and MSS gastric cancer
微卫星不稳定主要集中在10%~15%结肠癌、Lynch综合征和遗传性非息肉性结肠癌中[6]。研究显示,MSI胃癌主要为老年、女性、肠型多见,TNM分期较低且淋巴结转移数目较少[7-8]。MSI状态评估在胃癌预后预测中有争议[9-10]。我们研究发现,在疾病无进展生存分析和总体生存分析中,MSI胃癌患者预后优于MSS胃癌,可能与错配修复缺陷所产生的新抗原/肿瘤抗原有关。
MSI肿瘤微环境中淋巴细胞的浸润增多[11]。本课题组前期发现在EBV阳性胃癌微环境中淋巴细胞的比例升高。在本项研究中,5例EBV阳性胃癌均存在一定程度的MMR分子表达缺失。根据CD8+T细胞浸润和PD-L1表达水平进行免疫分型,MSI胃癌主要以Ⅱ型为主,MSS胃癌主要以Ⅱ型、Ⅳ型为主。免疫分型的提出不仅对预后有很好的预测作用,还对未来的免疫治疗有一定筛选作用。MSS肿瘤具有Ⅳ型免疫分型也许能够在治疗中获得一定的疾病缓解。
巨噬细胞在肿瘤中的作用十分复杂,经典活化的M1型巨噬细胞有杀伤细菌及肿瘤细胞的作用;选择性活化的M2型巨噬细胞促进肿瘤发生发展。肿瘤相关巨噬细胞浸润与微环境中PD-L1表达有关[12]。CD68是一个泛巨噬细胞标志物,且与预后密切相关[13]。在大部分肿瘤中,肿瘤相关巨噬细胞主要表现出M2型作用,抑制免疫细胞杀伤肿瘤细胞或者通过分泌细胞因子抑制具有杀伤作用的淋巴细胞发挥作用。本研究发现,MSS胃癌中巨噬细胞浸润增多,肿瘤免疫微环境对肿瘤细胞的杀伤和抑制作用减弱,患者预后较差。
此外,PD-1/PD-L1在不同类型肿瘤及同一肿瘤不同亚型的表达程度有明显差异[14]。抗PD-1/PD-L1药物临床试验结果提示,相比于MSS肿瘤,MSI肿瘤患者能够获得更好的临床缓解,延长生存时间[15-16],可能与MSI肿瘤微环境中多种免疫分子的表达相关。MSI肿瘤因存在高度突变的潜质,突变基因编码翻译的蛋白可以成为有潜力的肿瘤抗原而被免疫系统识别并清除。随着免疫的激活,抑制性分子的表达随之升高,如PD-L1表达。抗PD-1/PD-L1治疗可以打破这种平衡,更好地辅助免疫系统清除肿瘤细胞。因此,PD-L1的表达虽然反映了机体的免疫抑制状态,但也提示免疫系统的激活。我们研究发现,MSI和MSS胃癌中PD-L1表达水平无明显差异,与课题组既往在胃癌中发现的PD-L1表达阳性率基本一致。这可能提示,虽然MSS胃癌错配修复机制完善,仍有其他多种因素(肿瘤细胞自身、肿瘤间质细胞、肿瘤细胞或间质细胞分泌因子)诱导PD-L1表达。
总之,本研究通过错配修复相关分子MLH1、MSH2、MSH6及PMS2的免疫组织化学染色筛选MSI和MSS胃癌,通过CD8、CD68、PD-1、PD-L1染色,发现CD68+巨噬细胞在MSS胃癌中的浸润程度明显高于MSI胃癌。此外,MSI胃癌以Ⅱ型为主。以上研究结果对今后针对免疫相关分子设计单抗或靶点治疗具有参考价值。
