SIRT4在肝癌中的表达及其对肝癌细胞增殖和侵袭迁移的影响
2019-10-24韩丽丽贾丽君强昊琛张淑群
韩丽丽,贾丽君,强昊琛,张淑群
(1. 西安交通大学第二附属医院肿瘤病院,陕西西安 710004;2. 西安市曲江第一小学,陕西西安 710061)
原发性肝细胞癌(hepatocellular carcinoma, HCC)是位居全球发病率第5位的恶性肿瘤[1]。肝癌细胞高增殖和高侵袭的生物学行为特点决定了肝癌起病隐匿、发展迅速、预后较差,其死亡率居全球第3位[2]。缺乏早期有效的预测生物标记物以及治疗手段是原发性肝癌预后较差的主要原因。
沉默调节蛋白Sirtuin(SIRT)家族是维持哺乳动物基因组稳定的NAD+依赖的去乙酰化酶,乙酰化酶或ADP-核糖转移酶广泛参与能量代谢和调控应激反应[3]。家族成员包括SIRT1~SIRT7,7个家族成员表达异常与多种恶性肿瘤的发生关系密切[4]。以往研究热点集中在SIRT1和SIRT2:SIRT1可通过对p53、DNA修复蛋白Ku70等去乙酰化作用抑制肿瘤发生;SIRT2表观修饰H4K20进而调节细胞周期演进维持基因组稳定[5]。新近研究逐渐揭示位于线粒体内的SIRT4有重要生物学作用。起初,SIRT4的研究热点在于其调控脂肪酸氧化代谢和胰岛素分泌的作用[6-8];随着研究的深入,人们逐渐发现SIRT4可调控谷氨酰胺代谢发挥抑制肿瘤的功能[9];近期报道,SIRT4在胃癌、结肠癌等恶性肿瘤组织中均有表达下降的表现[10-12]。这些研究结果提示SIRT4可能参与抑制肿瘤的发生发展。但是,SIRT4在人原发性肝癌中的表达水平以及与原发性肝癌的相关性研究鲜见报道。
本研究首次检测SIRT4在肝癌组织及配对癌旁组织标本中的表达水平,结合临床病理资料分析SIRT4和肝癌患者临床病理指标的关系;利用慢病毒载体转染技术构建过表达的SIRT4的肝癌细胞株,观察SIRT4表达上调后对肝癌细胞增殖、迁移、侵袭和上皮间质转化的影响,进一步探讨调控肝癌发生发展的潜在机制,为探寻新的肝癌生物标记物和新的治疗靶点提供前期基础。
1 材料与方法
1.1 临床资料收集西安交通大学第二附属医院2010年3月至2011年3月HCC患者手术组织标本120例,术前未接受放化疗。所有组织标本术后经病理医师查证,并冻存在液态氮中。
1.2 细胞株及主要试剂人肝癌细胞株SMMC-7721购自美国ATCC生物资源的中心。DMEM购自美国Thermo Fisher科技公司;胎牛血清购自美国Invitrogen公司;胰蛋白酶购自Sigma公司;RNA提取试剂Trizol购自美国Invitrogen公司;Westernblot所用SIRT4、TGF-β、Vimentin、E-cadherin和GAPDH一抗购买于CST公司;二抗购买于北京博奥森公司;Transwell小室购自Millipore公司;慢病毒载体由吉凯公司提供包装。
1.3 方法
1.3.1qRT-PCR检测SIRT4的表达 应用Trizol试剂提取临床组织标本或肝癌细胞总RNA,利用紫外分光光度计测试RNA纯度和浓度;反转录试剂盒(日本TaKaRa公司)用于反转录总RNA为cDNA。qRT-PCR条件:95 ℃预热10 min,95 ℃ 15 s,60 ℃ 5 s,重复40个周期。SIRT4相对表达情况采用2-△△Ct法对比GAPDH表达进行数据分析。引物购自TaKaRa公司,其序列如下:5′-CCCTGACCTTGTAGATGTCATTG-3′(forward)和5′-GTCACGATGATACAG-TTCTGCAAA-3′(reverse)。所有实验重复3次。
1.3.2细胞培养及转染 在DMEM培养基(含150 mL/L胎牛血清)中,用于SMMC-7721细胞培养,1.25 g/L胰酶用于细胞消化传代。本研究采用慢病毒转染技术感染SMMC-7721细胞,实验分为SMMC-7721-NC阴性对照组和SMMC-7721-SIRT4过表达组。转染前1 d将6×104/mL生长状态良好的细胞平均接种于6孔培养板中,细胞融合度均在10%~20%之间,病毒感染3~4 d后吸出培养基,按照MOI值为50(根据说明书推荐和预实验结果)加入病毒稀释液和完全培养基,培养箱中培养3~4 d后观察感染效果。加入3 μg/mL嘌呤霉素加压筛选,单克隆细胞集落形成后,1.5 μg/mL的嘌呤霉素维持筛选扩增。
本研究采用对照病毒为NC载体病毒,3个过表达SIRT4病毒的靶点:5′-GCACACTGGGCTTTGAGCTTG-3′和5′-CACAATCCAAGCACAGGA-G-3′;5′-GCCGCTAGAGGTGAAATTCTT-3′和5′-CATTCTTGGCAAATGCTTTC-3′;5′-GTCCACA-ATGTGCTACGTGCT-3′和5′-TGATCAACGAT-ACTTCGTTC-3′。
1.3.3MTT法检测细胞增殖能力 取对数生长期SMMC-7721-NC和SMMC-7721-SIRT4细胞,分别均匀接种于96孔板中,共设置5个复孔;分别于7 d同一时间检测细胞增殖情况;第7天每孔加入5 mg/mL的MTT贮存液20 μL,继续于37 ℃细胞培养箱孵育4 h后弃去上清液,加入150 μL的DMSO溶液,置于室温避光反应20 min,酶标492 nm波长检测吸光度值。
1.3.4Transwell小室实验测定细胞迁移、侵袭能力 Transwell迁移实验:100 μL无血清DMEM培养基重悬1×104个肝癌细胞接种于Transwell小室上层,分组同前,设3个复孔;加入500 μL含胎牛血清的DMEM培养基至Transwell小室下层;置于37 ℃细胞培养箱培养48 h;取出小室,吸出上室内培养基,用棉签拭去小室上层残存于聚碳酸酯膜上的细胞;40 g/L多聚甲醛液固定细胞15 min,结晶紫染色20 min;细胞超净台内倒置风干过夜,于光镜下随机观察10个视野计数。Transwell侵袭实验:首先用4 ℃的无血清DMEM稀释Matrigel胶,稀释比例为3∶1,取100 μL稀释好的胶铺满小室上层,并于37 ℃细胞培养箱中孵育6 h后可用于后续实验;余步骤同迁移实验。
1.3.5Western blot检测SIRT4等表达 将实验所用细胞在RIPA缓冲液中溶解,蛋白质浓度由BCA进行检测。SDS-PAGE胶每孔加入总蛋白质(25 g),进行蛋白电泳,随后电转移至PVDF膜上。50 g/L的脱脂牛奶封闭1 h,加入一抗(SIRT4,1∶500;E-cadherin,1∶300,Vimentin,1∶500;TGF-β,1∶600;GAPDH,1∶3 000),置于4 ℃冰箱过夜。TPBS清洗膜后加入二抗,37 ℃摇床放置2 h。最后使用DNR生物成像系统进行发光、测试、照相。
1.4 统计学处理采用SPSS 20.0软件进行统计分析。独立样本t检验用于两样本间均数的比较,单因素方差分析及Dunnet检测用于多组均数间比较,SIRT4与临床病理参数采用χ2检验进行分析。P<0.05为差异有统计学意义。
2 结 果
2.1 SIRT4在肝癌和配对癌旁组织中的表达及其与肝癌临床病理特征的关系qRT-PCR结果提示,与配对的癌旁组织相比,肝癌组织中SIRT4表达明显降低,差异有统计学意义(2.18±0.11vs. 5.18±0.23,P<0.001)。进一步对SIRT4的表达和临床资料进行分析,结果表明,SIRT4在67.5%(81/120)的HCC患者中表达下调,其低表达与肝癌患者的肿瘤大小(χ2=4.615,P=0.032)、微血管侵犯(χ2=12.001,P=0.001)及临床分期有关(χ2=5.330,P=0.021),与性别、年龄及组织病理分级等无相关性。
2.2 构建稳定转染SIRT4过表达慢病毒载体的SMMC-7721肝癌细胞系利用qRT-PCR方法检测慢病毒载体4个靶点的过表达效果,结果显示:3号靶点慢病毒过表达SIRT4效果最强(F=5.564,P=0.008,图1A),因而3号慢病毒载体被用于后续建立稳定转染细胞系。应用3号慢病毒和LV-shNC分别转染SMMC-7721细胞,2~3周后荧光显微镜下观察慢病毒转染效率,85%以上观察细胞呈现明亮绿色荧光,可见转染效率在85%以上(图1B)。
qRT-PCR结果提示,稳定转染SIRT4过表达慢病毒载体的SMMC-7721细胞中SIRT4的mRNA表达水平与阴性对照组比较明显上调,差异有统计学意义(2.18±0.087vs. 1±0.073,P<0.001,图1C);Western blot结果显示,在蛋白水平上,SMMC-7721-SIRT4组SIRT4表达水平较对照组明显上调(1.087±0.095vs. 0.15±0.063,P=0.007,图1D)。以上结果表明,SIRT4过表达的SMMC-7721细胞系构建成功。
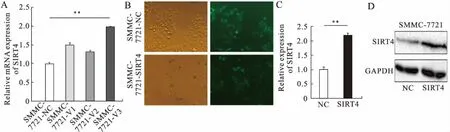
图1 慢病毒转染SIRT4过表达载体后SMMC-7721中SIRT4表达水平上调
Fig.2 Up-regulated expression of SIRT4 in SMMC-7721-SIRT4 cells compared with SMMC-7721-NC cells
A:qRT-PCR检测慢病毒载体4个靶点过表达效果,**P<0.01;B:荧光镜观察慢病毒转染效率(左为光镜照片;右为荧光镜照片);C:qRT-PCR检测SIRT4 mRNA表达,**P<0.01;D:Western blot检测SIRT4蛋白表达。
2.3 SIRT4过表达对肝癌细胞增殖能力的影响采用MTT法检测了SMMC-7721细胞转染对照空载体病毒及SIRT4过表达的慢病毒之后连续7 d的生长情况。结果显示,与对照组(SMMC-7721-NC)比较,实验观察第5天至第7天过表达SIRT4的SMMC-7721细胞增殖能力明显降低,其增殖能力明显低于对照组细胞,差异具有统计学意义(第5天:1.51±0.032vs. 2.99±0.097,P<0.001;第6天:1.98±0.089vs. 3.10±0.15,P<0.001;第7天:2.31±0.101vs. 3.98±0.34,P<0.001,图2)。
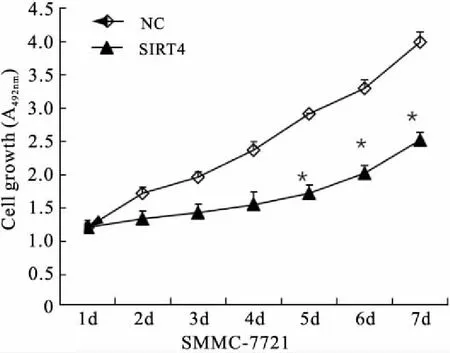
图2 MTT检测过表达SIRT4对SMMC-7721细胞增殖能力的影响
Fig.2 MTT assay results showed the effect of overexpression of SIRT4 on the proliferation ability of SMMC-7721 cells
与SMMC-7721-NC阴性对照组相比,*P<0.01。
2.4 SIRT4过表达对肝癌细胞侵袭和迁移能力的影响Transwell侵袭和迁移实验结果显示,与阴性对照组(SMMC-7721-NC)相比,过表达SIRT4的SMMC-7721侵袭和迁移细胞数目明显减少,差异有统计学意义(21±4.87vs. 88±5.67,P=0.015;19±4.17vs. 86±4.99,P=0.021,图3)。
2.5 SIRT4过表达对TGF-β和肝癌细胞上皮间质转化相关蛋白表达的影响Western blot结果显示,与阴性对照组(SMMC-7721-NC)比,过表达SIRT4明显降低了SMMC-7721细胞TGF-β(0.399±0.036vs. 0.98±0.023,P=0.010)及上皮间质转化相关蛋白Vimentin表达水平(0.25±0.036vs. 0.99±0.034,P=0.030),而代表上皮性的标记物E-cadherin表达明显升高(2.16±0.064vs. 1.03±0.074,P=0.014,图4)。
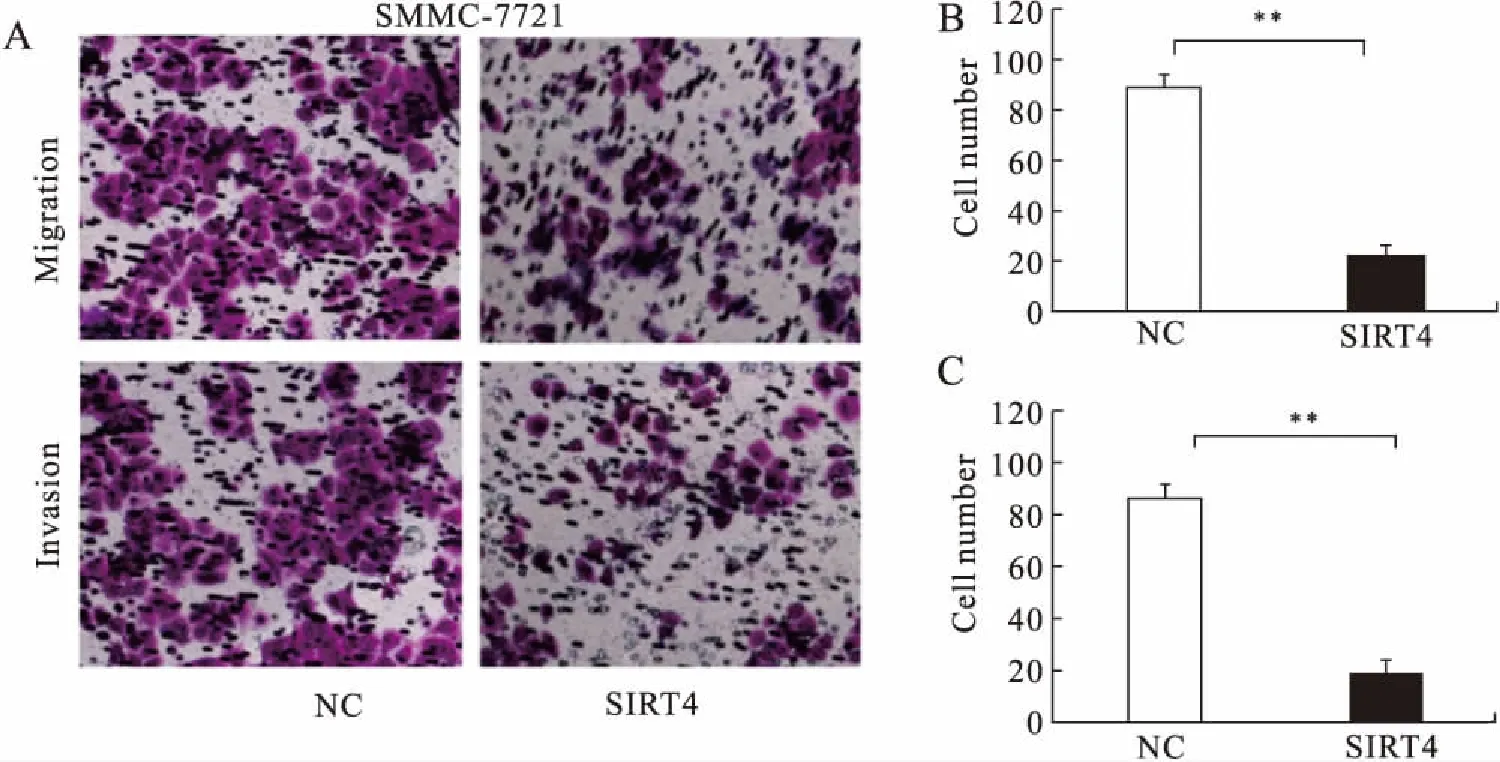
图3 Transwell实验检测过表达SIRT4对SMMC-7721细胞侵袭和迁移能力的影响
Fig.3 Transwell assay results showed that the effect of overexpression of SIRT3 on the invasion and migration ability of SMMC-7721 cells
A:Transwell小室实验于显微镜下图;B:SMMC-7721-SIRT4过表达组迁移细胞数明显少于SMMC-7721-NC阴性对照组,**P<0.01;C:SMMC-7721-SIRT4过表达组侵袭细胞数明显少于SMMC-7721-NC阴性对照组,**P<0.01。
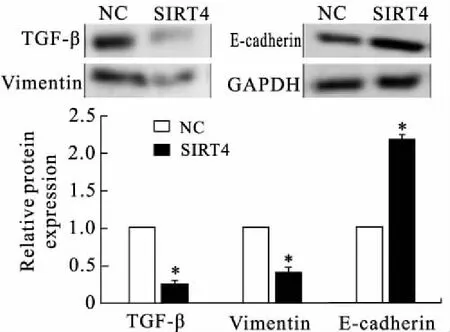
图4 SMMC-7721细胞中过表达SIRT4对TGF-β以及上皮间质转化相关蛋白的影响
Fig.4 Effect of increased SIRT4 on the expression of TGF-β, Vimentin and E-cadherin
与SMMC-7721-NC阴性对照组相比,*P<0.05。
3 讨 论
本研究结果首次提示,沉默调节蛋白SIRT4可能通过抑制肝癌细胞增殖、迁移、侵袭和上皮间质转化来抑制肝癌的发生发展。与其他实体肿瘤相同,原发性肝癌的发生是一个多步骤、多因素的过程,这个生物过程包含一系列抑癌基因失活和癌基因异常激活的参与[13]。肝癌发展过程中,多种与细胞增殖、迁移和转移密切相关的分子信号发生异常表达或激活,这决定了肝癌高复发、高转移的生物学特点,导致肝癌患者预后不良。因此,深入研究筛选肝癌侵袭转移的关键调控因子,并探索其作用分子机制,寻找新的生物标记物和新的治疗靶点具有重要临床价值。
SIRT4属于SIRT家族,位于染色体12q24.23-q24.31,其编码蛋白与酵母Sir4蛋白同源,具备sirtuin家族成员的共同特征——包括一个sirtuin核心领域,参与表观修饰遗传基因,导致其抑制、沉默和重组。新近研究表明,SIRT4通过调节谷氨酰胺代谢发挥抑癌作用,结肠癌、胃癌组织中SIRT4表达明显下调[9]。然而,SIRT4在肝癌组织中的表达情况未见报道。回顾文献,SIRT的7个家族成员在不同的实体肿瘤类型中发挥的作用不尽相同[14]。例如,SIRT1在和皮肤癌、胃癌及前列腺癌中其表达异常升高[15-17],提示SIRT1高表达与肿瘤进程相关;SIRT1在乳腺癌中低表达;另外,WANG等[18]报道SIRT1可抑制小鼠模型肿瘤的形成,提示SIRT1在不同肿瘤中发挥不同作用。SIRT2在神经母细胞瘤中表达降低,而在胰腺癌中表达却升高,同样提示SIRT2在不同肿瘤中发挥不同作用。以往报道提示,SIRT4在不同肿瘤均表现出抑癌基因的作用,例如,SIRT4抑制谷氨酰胺代谢,抑制HeLa细胞的生长;过表达SIRT4抑制结肠癌细胞生长;此外,SIRT4基因敲除小鼠模型更容易发生肺癌、乳腺癌以及淋巴瘤;SIRT4还可以抑制myc诱导的B淋巴瘤细胞生长[19]。本研究结果提示,SIRT4在肝癌组织中明显下调,其低表达与更大的肿瘤大小、微血管侵犯及更高的肿瘤分期密切相关。进一步的细胞实验证实了肝癌细胞中过表达SIRT4抑制肝癌细胞增殖、迁移和侵袭,提示SIRT4在肝癌中同样发挥抑癌基因作用。这是首次报道SIRT4在肝癌组织中的表达以及对肝癌细胞恶性生物学行为的影响。
以往大量研究证实,上皮间质转化是肿瘤细胞迁移和侵袭的基本机制[20-22]。本研究发现,SIRT4过表达抑制TGF-β和上皮间质转化相关蛋白。而TGF-β是诱导肿瘤细胞发生上皮间质转化的关键调控因子,因而我们推测,SIRT4可以通过抑制TGF-β抑制肝癌细胞上皮间质的转化、迁移、侵袭。但是,其更深的调控机制尚未明确,这是本课题的局限,后续将进一步探索SIRT4调控TGF-β的分子机制。
综上所述,结合临床组织样本和细胞实验的结果,我们的研究支持SIRT4在肝癌中发挥肿瘤抑制因子作用。同时,提示SIRT4是一个有前景的肝癌生物标记物和有潜力的治疗靶点。
