骨髓激酶X对宫颈癌细胞增殖的影响及可能的作用机制
2019-10-24李晓兰赵骏达马俊旗
李晓兰 赵骏达 马俊旗
作者单位:830054 乌鲁木齐 新疆医科大学第一附属医院妇科中心
宫颈癌是全球女性癌症死亡的第四大原因[1]。有研究报道,一些癌基因和转录因子可能参与宫颈癌的发生和发展[2-3]。骨髓激酶X(bone marrow X-linked kinase,BMX)是Tec家族细胞内非受体酪氨酸激酶成员[4-7]。BMX可介导前列腺癌和膀胱癌等细胞增殖、存活、迁移、侵袭和凋亡[8-9]。PI3K/Akt/mTOR信号通路对肿瘤发生、细胞周期进展、细胞迁移、增殖和存活有重要作用[10]。研究[10-12]表明,PI3K/Akt/mTOR通路在结直肠癌、卵巢癌及乳腺癌等肿瘤中异常激活。本研究探讨BMX在人宫颈癌增殖的影响及其可能的作用机制。
1 材料和方法
1.1 主要试剂和仪器
人宫颈癌细胞系HeLa(HeLa-野生型细胞)购自美国ATCC公司,10%胎牛血清购自浙江天杭生物科技股份有限公司,DMEM培养基、MTT购自美国Sigma Aldrich 公司,BMX、Akt、p-Akt、mTOR、p-mTOR、β-actin及二级抗体均购自美国Santa Cruz公司,辣根过氧化物酶购自美国Thermo Fisher Scientifc公司,Trizol、逆转录试剂盒购自日本Takara公司,Lipofectamine 2000试剂购自美国Invitrogen公司,BMX-IN-1、LFM-A13购自美国MCE公司,MK-2206和雷帕霉素购自美国Selleck公司,APC-BrdU细胞增殖检测试剂盒购自江苏凯基生物技术股份有限公司,Olympus-Cx31显微镜购自日本Olympus公司,FACS Calibur流式细胞仪购自美国BD Biosciences公司。
1.2 细胞系和组织样本
将HeLa细胞接种在含有10%胎牛血清的DMEM培养基中,并置于37℃、5%CO2培养箱中培养。收集2013—2017年本院34例正常子宫颈组织、25例原位宫颈癌组织和52例浸润性宫颈癌组织标本。所有患者均未接受化疗、免疫治疗或放射治疗。本研究经本院伦理委员会批准,所有患者在采集标本前均签署知情同意书。
1.3 免疫组织化学法检测BMX的表达
选取正常宫颈、原位宫颈癌及浸润性宫颈癌组织并用10%中性福尔马林固定,常规脱水,石蜡包埋,制片。免疫组化染色采用En Vision两步法,所用抗体包括BMX抗体及二级抗体,具体操作步骤参照试剂盒说明及全自动免疫组化标准操作流程。BMX染色结果采用IRS表示,IRS为每个样本中的染色强度值(0分:无染色;1分:弱染色;2分:中度染色;3分:强染色)和阳性细胞百分比值(0分:<10%;1分:10%~25%;2分:26~50%;3分:51~75%;4 分:76~100%)的乘积,IRS>3为阳性,IRS≤3为阴性。
1.4 载体构建和细胞转染
采用TALEN敲除技术成功构建BMX-TALEN重组质粒载体。按照LipofectamineTM2000转染试剂说明书转染BMX-TALEN重组质粒,BMX-TALEN重组质粒与LipofectamineTM 2000的配制比例为1∶3,将其加入9孔板中构建低表达BMX的HeLa-BMX+/-细胞。以含有10%胎牛血清的DMEM培养基常规培养的野生型HeLa细胞为对照。转染48 h后,采用Western blot检测BMX蛋白的表达水平以鉴定转染效率。
1.5 Western blot检测蛋白表达水平
将随机选择的7例原位宫颈癌组织与7例正常宫颈组织,HeLa-野生型细胞和转染后的HeLa-BMX+/-细胞,DMSO、Akt抑制剂(MK-2206)和 mTOR抑制剂雷帕霉素分别处理的HeLa-野生型和BMX+/-细胞,分别放入含有新加入的蛋白酶抑制剂混合物的裂解缓冲液中,冰上裂解30~45 min。BCA法测定蛋白浓度,将蛋白质加入5×上样缓冲液中,95℃ 煮沸10 min。通过SDS-PAGE分离等量的蛋白质,印迹至活化的聚偏二氟乙烯膜。室温封闭1 h,分别加入BMX抗体(稀释比例为 1∶2 000)、Akt抗体(稀释比例为1∶500)、p-Akt抗体(稀释比例为 1∶1 000)、mTOR 抗体(稀释比例为 1∶1 000)、p-mTOR 抗体(稀释比例为1∶1 000)及 β-actin 抗体(稀释比例为 1∶1 000),4 ℃温育过夜。将印迹与偶联于辣根过氧化物酶的第二抗体室温孵育1 h,在X光片上采用ECL法显影,用成像分析系统分析目的蛋白及内参β-actin灰度值的比值,作为目的蛋白的相对表达水平。实验重复3次。
1.6 MTT检测细胞的生长速度及细胞活力
采用DMEM培养基调整各组细胞悬液浓度为2×103·mL-1,接种于 96 孔板,每孔体积 200 μL,每组3个复孔。分别于第1天、第3天、第5天和第7天用血细胞计数器计数,绘制细胞生长曲线。
1.7 流式细胞仪分析细胞周期变化
将BMX-IN-1处理后的HeLa细胞、DMSO处理后的HeLa细胞、HeLa-野生型细胞及转染后HeLa-BMX+/-细胞接种在60 mm培养皿中24~48 h,并用30 μm BrdU标记30~60 min。待生长至50%~70%融合时收取细胞,置于4℃下的70%冷乙醇固定过夜。PBS洗涤2次,采用APC-BrdU细胞增殖检测试剂盒对细胞进行抗APC-BrdU染色后,用FACS Calibur流式细胞仪分析,Flowjo 7.6软件分析细胞周期的分布。
1.8 统计学方法
采用SPSS 19.0进行数据分析。计量数据采用均数±标准差(χ±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析;计数资料采用百分比表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 BMX在正常宫颈及宫颈癌组织中的表达
免疫组织化学法检测结果显示,正常宫颈组织BMX阳性表达率为26.5%(9/34),原位宫颈癌组织BMX阳性表达率为68.0%(17/25),浸润性宫颈癌组织BMX阳性率为88.5%(46/52),组间比较差异有统计学意义(χ2=34.804,P<0.001),两两比较差异均有统计学(P<0.05),见图 1。Western blot结果显示,7例原位宫颈癌组织中BMX的表达明显高于7例正常宫颈组织(P<0.05),见图 2。
2.2 转染结果
Western blot检测结果显示,HeLa-野生型细胞中BMX蛋白的表达高于HeLa-BMX+/-细胞(t=9.527,P<0.001),说明本研究成功构建低表达 BMX的HeLa-BMX+/-细胞,见图 3。
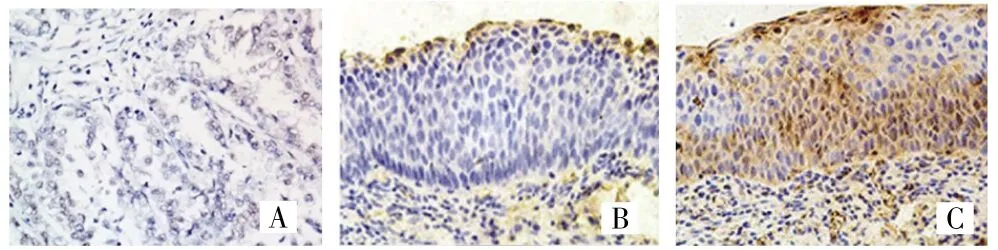
图1 BMX在不同宫颈组织中的表达(×100)Fig.1 Expression of BMX in different cervical tissues(×100)
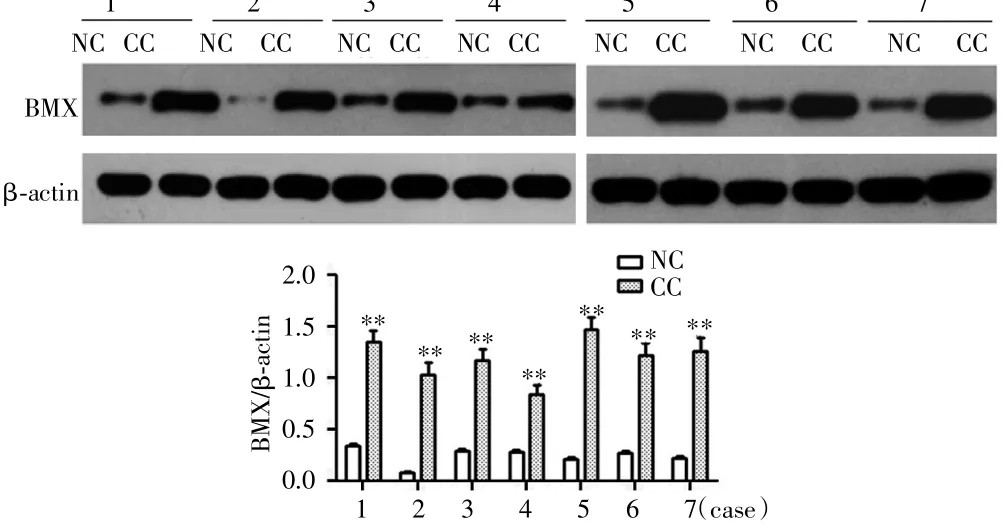
图2 Western blot法检测宫颈癌和正常宫颈组织中BMX的表达Fig.2 Western blot analysis of BMX expression in cervical cancer

图3 Western blot检测BMX蛋白的表达Fig.3 The expression of BMX detected by Western blot
2.3 BMX对宫颈癌细胞生长速度及细胞周期的影响
MTT法检测结果显示,HeLa-BMX+/-细胞的生长速度较HeLa-野生型细胞慢,见图4。流式细胞术检测结果显示,与HeLa-DMSO细胞比较,HeLa-BMX-IN-1细胞中 G0/G1 期细胞比例较高[(50.4±5.7)%vs(42.5±4.3)%,t=7.234,P<0.001],而 G2/M 期细胞比例较低[(22.9±2.9)%vs(29.1±3.1)%,t=5.491,P<0.001];与HeLa-野生型细胞比较,HeLa-BMX+/-细胞中G0/G1期细胞比例亦较高[(52.1±6.5)%vs45.9±5.7)%,t=5.715,P<0.001],而 G2/M 期细胞比例较低[(19.5±1.4)%vs(25.4±3.6)%,t=5.873,P<0.05],见图5。
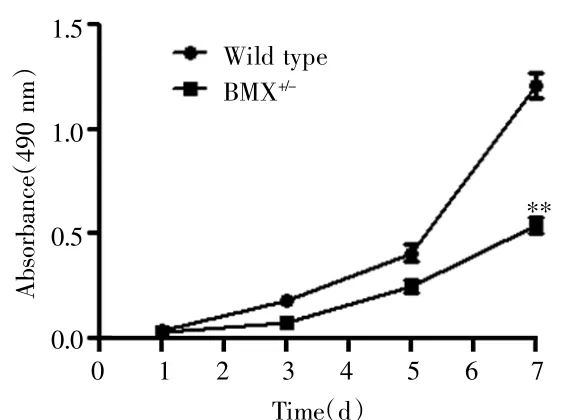
图4 HeLa-BMX+/-细胞和HeLa-野生型细胞的细胞生长曲线Fig.4 The growths curve of HeLa-BMX+/-cells and HeLa-wild type cells
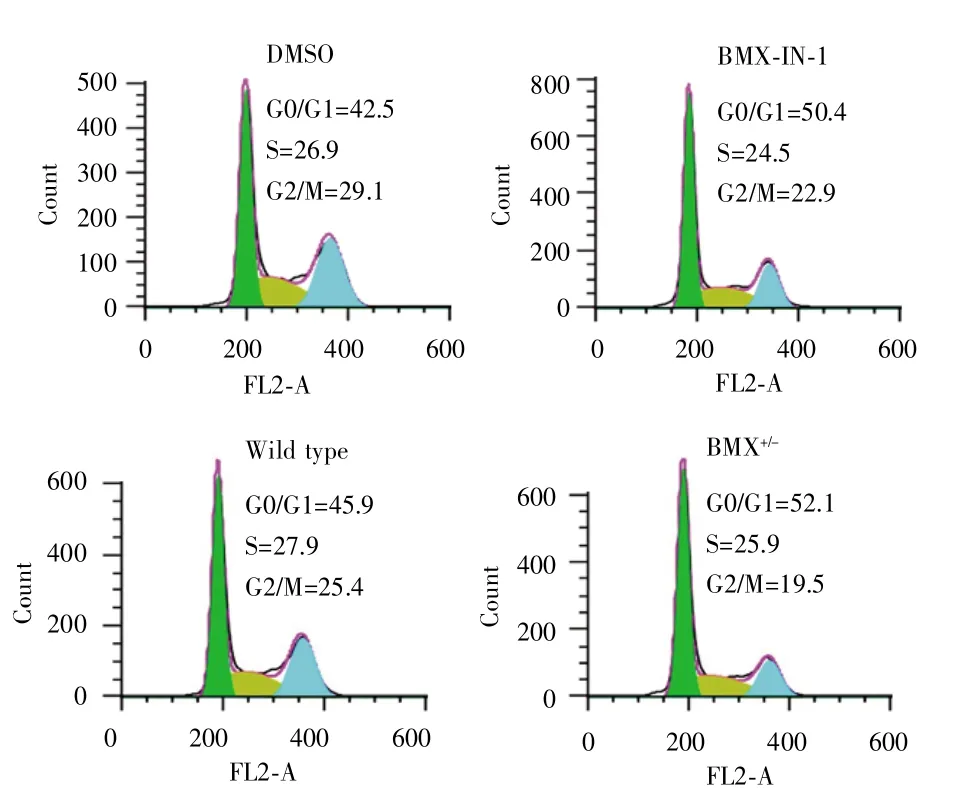
图5 BMX对宫颈癌细胞周期的影响Fig.5 The effect of BMX on cell cycle of cervical cancer cells
2.4 BMX通过激活PI3K/Akt/mTOR信号通路促进宫颈癌细胞活力
Western blot结果显示,BMX和p-Akt在HeLa-BMX+/-细胞中的表达低于HeLa-野生型细胞,差异均有统计学意义(t=6.282,8.117,均P<0.001);两种细胞的总Akt表达水平差异无统计学意义(t=2.035,P=0.126),见图6A。DMSO处理后HeLa-BMX+/-细胞中p-Akt和p-mTOR的表达低于HeLa-野生型细胞;与DMSO处理组比较,MK-2206处理和雷帕霉素处理后HeLa-野生型和BMX+/-细胞中p-Akt和p-mTOR的表达均受抑制,见图6B。MTT检测结果显示,DMSO处理后,HeLa-BMX+/-细胞生长速度较HeLa-野生型细胞慢;MK-2206和雷帕霉素处理后,HeLa-野生型和HeLa-BMX+/-细胞生长均较DMSO处理的细胞慢,见图6C。
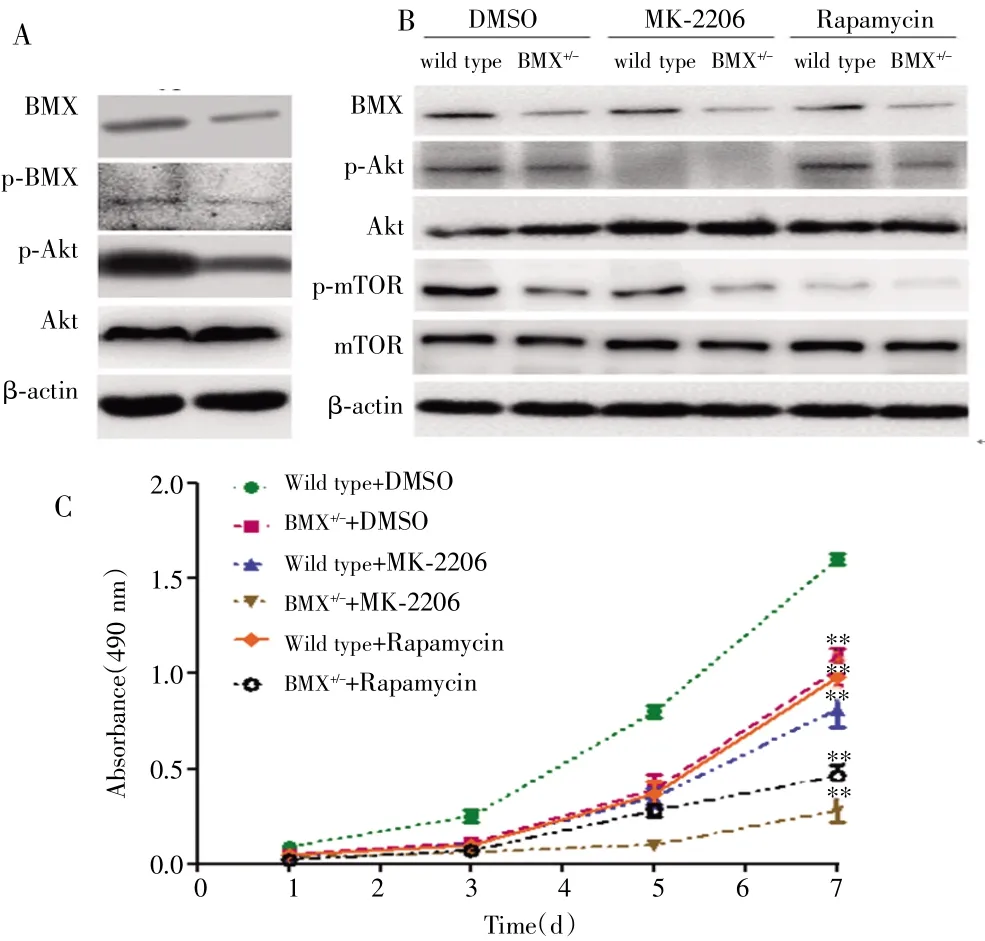
图6BMX对PI3K/Akt/mTOR信号通路的影响Fig.6 Effect of BMX on the PI3K/Akt/mTOR signaling pathway
3 讨论
TEC激酶家族是第二大非受体蛋白酪氨酸激酶家族,BMX是该家族的成员之一。研究报道BMX可能参与造血细胞、心内膜、动脉内皮以及其他细胞的免疫反应、炎症和细胞因子信号传导[13]。此外,BMX在肾癌、膀胱癌等肿瘤中表达,参与细胞生长、转化、迁移、存活、凋亡[8-9]。本研究用免疫组织化学法检测正常宫颈、原位宫颈癌和浸润性宫颈癌组织样本中BMX的表达。结果显示,BMX在宫颈癌组织中的表达高于正常子宫颈组织,随机选择正常子宫颈组织和宫颈癌组织各7例,然后采用Western blot法检测BMX的表达,亦发现BMX在宫颈癌组织中高表达,提示BMX可能参与宫颈癌的发生发展。为此,本研究构建重组BMX-TALEN质粒并转染HeLa细胞,成功构建低表达BMX的HeLa-BMX+/-细胞,然后采用Western blot检测,结果发现HeLa-野生型细胞中BMX的表达明显高于HeLa-BMX+/-细胞,而 HeLa-BMX+/-细胞生长较HeLa-野生型细胞慢,且BMX-IN-1处理的HeLa细胞G0/G1期细胞比例明显增加,而G2/M期细胞比例明显降低,说明敲低BMX表达后,细胞被阻滞在G0/G1期,从而抑制了肿瘤细胞增殖,减弱细胞增殖和活力。
目前,研究已证实的宫颈癌发展机制主要与PI3K/Akt/mTOR、丝裂原活化蛋白激酶(MAPKs)细胞外信号相关激酶(ERK1/2)、Janus激酶 2(JAK2)/信号转导和转录激活因子-3(STAT3)、JAK3/STAT5、NF-κB、Wnt/β-catenin 和 c-Jun N-末端激酶(JNK)/p-38 等信号通路有关[14-15]。尤其PI3K/Akt/mTOR信号通路与肿瘤细胞增殖和存活密切相关[10],其活性异常可导致细胞恶性转化,促进肿瘤细胞迁移、黏附、肿瘤血管生成和细胞外基质降解[16]。GUO等[9]研究发现膀胱癌细胞中BMX过度表达可提高Akt的活性,而敲除BMX则抑制Akt的活性。本研究Western blot结果显示,HeLa-BMX+/-细胞中BMX和p-Akt表达较HeLa-野生型细胞降低,两种细胞的Akt表达水平相当,说明敲除BMX可以降低HeLa-BMX+/-细胞中p-Akt/Akt的表达,BMX能增强p-Akt/Akt的活性。进一步采用MK-2206和雷帕霉素作用HeLa-野生型和HeLa-BMX+/-细胞后,发现p-AKT和p-mTOR表达受抑制,且细胞生长变缓,提示BMX可能激活Akt的磷酸化,而mTOR作为一个典型的下游因子亦受到影响,BMX可能通过PI3K/Akt/mTOR途径促进宫颈癌细胞增殖和肿瘤形成,但BMX如何调节这一通路仍有待进一步研究。
