维生素D调控Wnt/β-catenin信号通路抑制乳腺癌干细胞活性
2019-10-24沙昱彤黄家明卢珍萍梁欢征宗梅杨学攀施洪飞朱明明
沙昱彤 黄家明 卢珍萍 梁欢 征宗梅 杨学攀 施洪飞 朱明明
作者单位:210023 南京 南京中医药大学第二临床医学院营养教研室
乳腺癌是常见的恶性肿瘤之一,我国乳腺癌死亡率位居全部恶性肿瘤第四位,严重威胁女性健康[1]。肿瘤干细胞是具有自我更新、快速增殖、多向分化和多药耐药等特性的肿瘤细胞亚群,是肿瘤形成及不断生长的根源[2]。因此,靶向肿瘤干细胞被认为是肿瘤预防和治疗的理想策略。维生素D为脂溶性维生素,是固醇类衍生物。近年研究发现,维生素D可抑制人乳腺癌细胞MCF-7迁移和侵袭[3],且可减少MCF-7细胞的肿瘤干细胞数量[4]。然而,目前关于维生素D对乳腺癌干细胞的作用及其作用机制鲜有报道。本研究以乳腺癌SUM159细胞为研究对象,初步探讨维生素D对乳腺癌干细胞活性的干预作用及其可能的作用机制,以期为阐明维生素D抗肿瘤活性提供新的依据。
1 材料与方法
1.1 主要材料与试剂
乳腺癌细胞株SUM159购自中国科学院上海细胞库。维生素D购自中国阿拉丁公司;胰蛋白酶、不完全RP-MI1640培养基(含双抗)购自南京凯基生物科技发展有限公司;胎牛血清购自美国Gibco公司;四甲基偶氮唑盐(MTT)购自中国索莱宝公司;逆转录试剂盒和qPCR试剂盒购自南京诺唯赞公司;蛋白提取试剂盒购自南京凯基生物科技发展有限公司;BCA蛋白测定试剂盒购自碧云天;CD133和CD44抗体购自北京博奥森生物技术有限公司;Oct-4、Nanog、p-GSK-3β、β-catenin和c-Myc抗体购自美国Cell Signaling Technology公司;GAPDH抗体购自中国proteintech公司;二甲基亚砜(DMSO)购自中国索莱宝公司。
1.2 乳腺癌SUM159细胞的培养
将乳腺癌SUM159细胞置于含10%胎牛血清、0.08 U/L青霉素、0.08 g/L链霉素的不完全RP-MI1640培养基,于37℃、5%CO2恒温培养箱中培养,每2 d换液1次;待细胞长满至80%左右,用0.25%胰蛋白酶溶液进行消化、传代。取对数生长期细胞进行后续实验。
1.3 MTT法检测乳腺癌SUM159细胞的活力
取对数生长期乳腺癌SUM159细胞,制成细胞悬液,接种于96孔板,每孔1 500个细胞,置于37℃、5%CO2恒温培养箱中培养。24h后,分别加入1 μmol/L、5 μmol/L、10 μmol/L 和 20 μmol/L 的维生素 D,同时设置0.1%DMSO对照组,每组设置6个复孔。培养48 h,避光加入5 g/L MTT溶液20 μL,继续孵育4 h。弃上清液,加入 DMSO 200 μL,孵育震荡 10 min,待结晶溶解后,用酶标仪测定490 nm波长处各孔的吸光度(OD)值,分别计算各组细胞存活率。细胞存活率=(处理组OD值/对照组OD平均值)×100%。根据MTT结果筛选最佳药物浓度梯度进行后续实验。
1.4 无血清乳腺癌细胞干细胞CSCSUM159的悬浮培养
将SUM159细胞接种于无血清培养基(serum-free medium,SFM)中,于 37℃、5%CO2恒温培养箱中连续悬浮培养5 d,富集乳腺癌干细胞CSCSUM159。于接种细胞1 d和5 d观察肿瘤干细胞球的形成情况,并在显微镜下获取图像。SFM成分:含双抗无血清培养基RP-MI1640、1%B27、5 μg/mL 胰岛素、4 g/L BSA、10 ng/mL人碱性成纤维细胞生长因子和20 ng/mL表皮生长因子。
将SUM159细胞接种到无血清培养基,分别加入1 μmol/L、5 μmol/L 和 10 μmol/L 维生素 D,同时以0.1%DMSO培养SUM159细胞作为对照,于37℃、5%CO2恒温培养箱中连续悬浮培养5 d。显微镜下观察CSCSUM159细胞数量及成球大小变化,并于第5天收集细胞,分析维生素D对乳腺癌干细胞的干预作用。
1.5 Western blot法检测蛋白表达水平
收集各组细胞,加入IP裂解液,裂解40 min,收集上清液作为细胞总蛋白,并根据BCA法进行蛋白定量。取40~60 μg蛋白质样品进行聚丙烯酰胺凝胶电泳、转膜、封闭,加入一抗(孵育的一抗分别为CD133、CD44、Oct-4、Nanog、p-GSK-3β、β-catenin、c-Myc和GAPDH,稀释比例为1∶1 000),4℃冰箱过夜。用1×TBST洗涤液洗涤3次,每次5 min。加入二抗(稀释比例为1∶5 000),室温孵育1 h。用1×TBST洗涤液洗涤6次,每次5 min。采用ECL化学发光液显影。以GAPDH作为内参。
1.6 Real-time qPCR法检测mRNA表达水平
常规收集各组细胞,按照TRIzol法提取总RNA,测定RNA浓度,并逆转录合成cDNA,按Real-time qPCR试剂盒说明书配置反应体系。Real-time qPCR反应条件:预变性95 ℃ 30 s,1个循环;95 ℃ 10 s,60 ℃ 30 s,40个循环;95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。引物序列见表1。采用2-△△Ct计算目的基因的相对表达量。△△Ct值=(处理组靶基因Ct值-处理组GAPDH Ct值)-(对照组靶基因Ct值-对照组GAPDH Ct值)。实验重复3次。

表1 Real-time qPCR引物序列Tab.1 Sequence of Real-time qPCR primers
1.7 统计学方法
采用GraphPad Prism 5.0和SPSS 21.0进行数据分析。计量数据采用均数±标准差(χ±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,若组间差异有统计学意义,则采用Dunnett-t检验进行多重比较。以P<0.05为差异有统计学意义。
2 结果
2.1 维生素D对乳腺癌SUM159细胞活力的影响
MTT结果显示,对照组、1 μmol/L维生素D组、5 μmol/L维生素D组、10μmol/L维生素D组和20μmol/L维生素D组的细胞存活率分别为100.00%、83.70%、76.71%、65.03%和37.89%,组间比较差异有统计学意义(F=79.01,P<0.01)。与对照组比较,1 μmol/L、5 μmol/L、10 μmol/L 和 20 μmol/L 维生素 D 组细胞的存活率均显著降低(P<0.01),见图1。显微镜下观察发现,随着维生素D浓度增加,SUM159细胞数逐渐减少,见图2。以上结果表明,不同浓度维生素D均可抑制乳腺癌SUM159细胞的活力,因此本研究选择1 μmol/L、5 μmol/L 和 10 μmol/L 维生素 D 进行后续实验。

图1 维生素D对乳腺癌SUM159细胞存活率的影响Fig.1 Effect of Vitamin D on the viability of SUM159 cells

图2 显微镜下观察不同浓度维生素D作用乳腺癌SUM159细胞的情况(×100)Fig.2 Effect of Vitamin D on the viability of SUM159 cells by microscope(×100)
2.2 无血清悬浮培养富集乳腺癌干细胞CSCSUM159
显微镜下观察可见SUM159细胞在SFM中悬浮培养5 d可形成悬浮肿瘤细胞球,且随着培养天数增加,肿瘤细胞球体积增大、数目增多,见图3。Western blot检测结果显示,与乳腺癌SUM159细胞比较,悬浮细胞球肿瘤干细胞特性标志物CD133、CD44、Oct-4以及Nanog蛋白表达上调,蛋白条带颜色加深、条带变宽,见图4。Real-time qPCR检测结果显示,与乳腺癌SUM159细胞比较,乳腺癌干细胞CSCSUM159中CD133、CD44、Oct-4和Nanog的mRNA表达水平分别为 3.32±0.93、14.46±3.15、7.48±0.64、19.71±1.01,差异均有统计学意义(t=6.20,7.94,20.13,30.88;P=0.025,0.015,0.002,0.001),见图 5。上述结果表明无血清悬浮培养可有效富集乳腺癌干细胞。
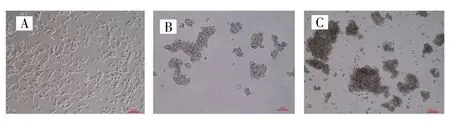
图3 显微镜观察乳腺癌中肿瘤干细胞球的生长情况(×100)Fig.3 The growth of breast cancer stem cell spheres observed by microscope(×100)
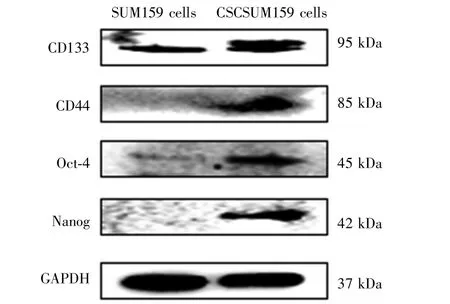
图4 SUM159和CSCSUM159细胞中肿瘤干细胞标志物的蛋白表达水平Fig.4 The protein expression levels of breast cancer stem cells markers in SUM159 and CSCSUM159 cells
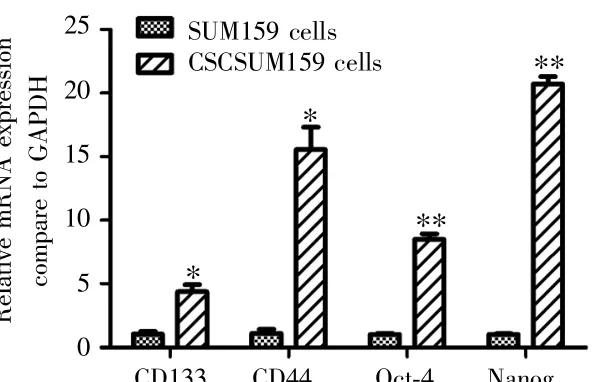
图5SUM159和CSCSUM159细胞中肿瘤干细胞标志物的mRNA表达水平Fig.5 The mRNA expression levels of breast cancer stem cells markers of SUM159 and CSCSUM159 cells
2.3 维生素D对乳腺癌干细胞CSCSUM159活力的影响
显微镜下观察可见,与对照组相比,1 μmol/L、5 μmol/L和10 μmol/L维生素D作用均使乳腺癌干细胞CSCSUM159的成球数量减少,且成球大小较对照组小;乳腺癌干细胞成球的数量和大小随着维生素D浓度的增加而减少和变小,见图6。Western blot检测结果显示,与对照组比较,不同浓度维生素D作用均可降低乳腺癌干细胞CSCSUM159干性标志物CD133、CD44和Nanog的表达水平,且随着维生素D浓度增加,抑制效果增强,见图7。以上结果表明,维生素D可抑制乳腺癌干细胞CSCSUM159的活力。
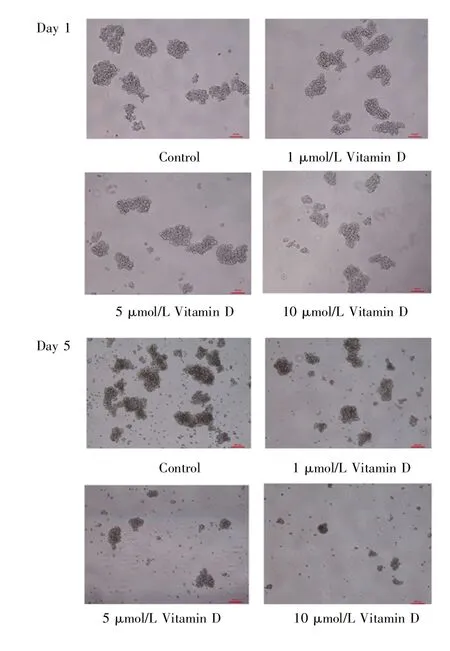
图6 显微镜观察维生素D干预对乳腺癌干细胞CSCSUM159生长的影响(×100)Fig.6 Effect of Vitamin D on growth of CSCSUM159 observed by microscope(×100)
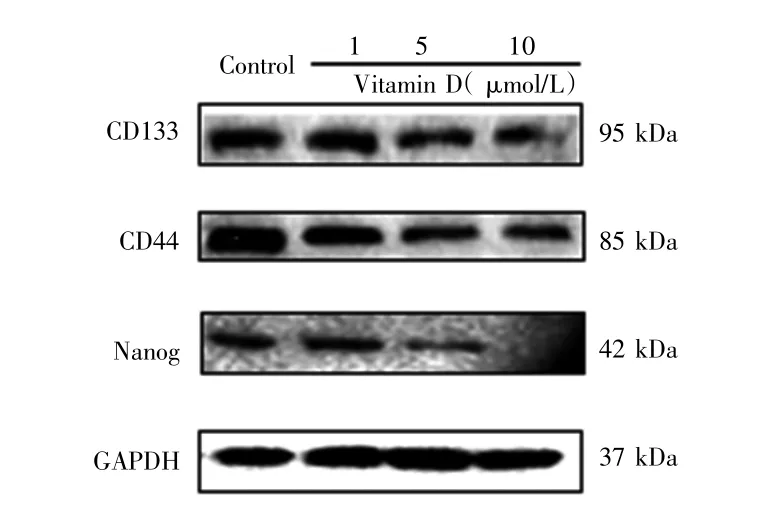
图7 维生素D对乳腺癌干细胞CSCSUM159干性标志物蛋白表达的影响Fig.7 Effect of Vitamin D on the protein expression of breast cancer stem cells markers of CSCSUM159 cells
2.4 维生素D对乳腺癌干细胞CSCSUM159中Wnt/β-catenin信号通路活性的影响
Western blot检测结果显示,与对照组相比,不同浓度维生素D均可下调Wnt/β-catenin信号通路中p-GSK-3β、β-catenin和c-Myc蛋白的表达水平,见图8。Real-time qPCR检测结果显示,与对照组相比,不同浓度维生素D亦可下调CSCSUM159细胞中β-catenin、c-Myc和 cyclin-D1的 mRNA表达水平(P<0.05),见表 2、图 9。
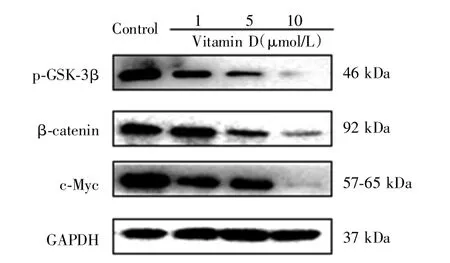
图8 不同浓度维生素D对乳腺癌干细胞CSCSUM159中Wnt/β-catenin信号通路相关蛋白表达水平的影响Fig.8 EffectofVitamin D on the protein expression of Wnt/β-catenin signaling pathway in CSCSUM159 cells

表2 不同浓度维生素D对乳腺癌干细胞CSCSUM159中β-catenin、c-Myc和cyclin-D1 mRNA表达的影响Tab.2 Effect of Vitamin D on the mRNA expression of β-catenin,c-Myc and cyclin-D1 in CSCSUM159 cells
3 讨论
肿瘤干细胞是肿瘤组织中极少的一部分肿瘤细胞,具有与干细胞相似的生物学特性,如无限增殖、自我更新和多向分化潜能等。研究表明,肿瘤干细胞在肿瘤发生发展过程中发挥关键调控作用[2]。肿瘤干细胞表达特征性标志物,其中乳腺癌干细胞标志物包括CD133、CD44、Oct-4、Nanog和 ALDH1A1 等[5-6]。无血清悬浮培养法是目前分离乳腺癌干细胞最常用的方法之一[7-8]。本研究采用无血清悬浮培养方法获取乳腺癌干细胞,发现与常规贴壁培养相比,无血清悬浮培养可富集肿瘤细胞球,且分离的肿瘤细胞球中乳腺癌干细胞标志物CD133、CD44、Oct-4以及Nanog的蛋白和mRNA表达水平均显著上调,说明该培养模型可有效富集乳腺癌干细胞CSCSUM159。
维生素D为一组含环戊氢烯菲环结构,并具有钙化醇生物活性的一类物质,是人体必需的营养物质之一。维生素D可调节体内钙磷代谢,参与细胞代谢和组织功能的调节,且在细胞的分化增殖中发挥重要的调节作用[9]。近年来,有研究发现维生素D还具有抗肿瘤作用,可抑制肿瘤细胞的增殖、迁移、侵袭及血管生成[9]。流行病学研究表明,乳腺癌患者往往表现为低维生素D水平,呈现血清维生素D缺乏状态[10],且维生素D缺乏可增加乳腺癌发病风险[10-11]。据报道,维生素D可抑制人乳腺癌细胞MCF-7的迁移和侵袭[3],同时可减少MCF-7细胞中肿瘤干细胞的数量[4]。查阅相关文献[12-13]发现,维生素D 在10 μmol/L浓度范围即可对肿瘤发挥抑制作用,本研究采用不同浓度维生素 D(1 μmol/L、5 μmol/L、10 μmol/L 和 20 μmol/L)干预乳腺癌SUM159细胞,结果亦发现不同浓度维生素D均可抑制乳腺癌细胞SUM159活力。进一步采用 1 μmol/L、5 μmol/L 和 10 μmol/L 浓度的维生素 D干预乳腺癌干细胞CSCSUM159,发现均可抑制乳腺癌干细胞球形成,且随着浓度升高,其对乳腺癌干细胞球数量和大小的抑制作用增强;同时维生素D还可显著下调乳腺癌干细胞标志物CD133、CD44和Nanog的表达,说明维生素D对乳腺癌干细胞CSCSUM159的活性具有抑制作用,与上述文献报道一致。
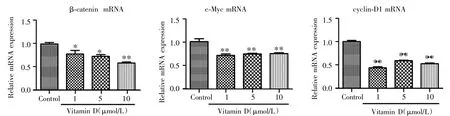
图9 不同浓度维生素D对乳腺癌干细胞CSCSUM159中β-catenin、c-Myc和cyclin-D1 mRNA表达的影响Fig.9 Effect of Vitamin D on the mRNA expression of β-catenin,c-Myc and cyclin-D1 in CSCSUM159 cells
有研究发现肿瘤干细胞活性受Wnt、Notch、Hedgehog和Bmi等信号通路调控,其中Wnt/β-catenin信号通路是调控多种肿瘤干细胞活性的关键信号通路[14]。LIU 等[15]研究发现,miR-221/222可通过抑制Wnt/β-catenin信号通路的负调节因子,激活Wnt/β-catenin信号通路,从而促进乳腺癌的侵袭性。XIONG等[16]发现,通过调控乳腺癌细胞LRP6和DVL2的磷酸化水平,可抑制Wnt/β-catenin信号通路活性,进而抑制乳腺癌细胞生长。而ZHENG等[17]研究亦发现维生素D可通过抑制Wnt/β-catenin信号通路诱导乳腺癌MCF-7干细胞对他莫昔芬的敏感性。以上研究结果表明,Wnt/β-catenin信号通路在乳腺癌及乳腺癌干细胞中具有调控作用。c-Myc和 cyclin-D1[18]是Wnt/β-catenin信号通路的下游靶基因,而p-GSK-3β和β-catenin是该信号通路的关键分子[19]。本研究结果显示,维生素D可下调乳腺癌干细胞CSCSUM159中p-GSK-3β、β-catenin及c-Myc的蛋白表达水平,同时下调β-catenin、c-Myc和cyclin-D1的 mRNA表达水平,表明维生素D对Wnt/β-catenin信号通路活性具有调控作用,提示维生素D可能通过调控Wnt/β-catenin信号通路对乳腺癌干细胞活性发挥干预作用。
综上所述,本研究发现维生素D可抑制乳腺癌干细胞活性,可能与其调控Wnt/β-catenin信号通路活性有关,为维生素D应用于乳腺癌治疗提供新的思路。
