miR-125b-5p对喉鳞状细胞癌细胞能量代谢及增殖的影响
2019-10-24陈永果邢军
陈永果 邢军
作者单位:274400 菏泽 1曹县人民医院耳鼻喉科;250117 济南 2山东省肿瘤医院放疗科
喉鳞状细胞癌(laryngeal squamous cell carcinoma,LSCC)是喉癌最常见的病理类型,约占头颈部细胞癌的25%[1]。手术切除是早期LSCC最有效的治疗方式,目前缺乏早期诊断的生物标志物,易误诊为晚期癌症转移,5 年生存率不理想[2-3]。微小 RNA(miRNA)是内源性单链非编码RNA,广泛参与细胞增殖、分化、迁移、转化和凋亡[4-6]。如miR-503通过靶向程序性细胞死亡蛋白4促进LSCC的发生[7];miR-26b通过靶向ATF2抑制喉癌的顺铂耐药。miRNAs可能是LSCC发生和治疗的新靶点[8]。糖酵解过程需要表达几种负责将葡萄糖转化为乳酸的酶,己糖激酶2(hexokinase 2,HK2)是其一[9-11]。miR-125b-5p 在HK2的3'-UTR处存在结合位点[12],HK2可能在糖酵解中发挥关键功能,在癌细胞能量代谢中发挥重要作用。本研究通过检测miR-125b-5p在LSCC细胞中的表达和功能,并分析HK2的调节作用,旨在探讨miR-125b-5p对LSCC能量代谢和增殖的影响及其可能的机制。
1 材料与方法
1.1 主要材料和仪器
LSCC细胞系和人正常支气管上皮细胞系购自美国 Sciencell公司;RNA逆转录试剂盒购自日本TaKaRa公司;miR-125b-5p模拟物和模拟对照miRNA(5'-UUCUCCGAACGUGUCACGUTT-3')购自中国锐博生物科技有限公司;Lipofectamine 2000购自美国Thermo Fisher Scientific公司;miRNeasy Mini试剂盒购自美国Qiagen公司;One Step PrimeScript miRNA cDNA合成试剂盒购自中国Takara公司;抗HK2抗体购自美国Cell Signaling Technology公司;葡萄糖摄取比色测定试剂盒和乳酸盐比色测定试剂盒购自美国Milpitas公司。
1.2 方法
1.2.1 细胞培养与转染 LSCC细胞和人正常支气管上皮细胞置于Dulbecco改良的含10%胎牛血清Eagle培养基,于37℃、5%CO2中培养。实验分为miR-125b-5p转染组(miR-125b-5p模拟物转染LSCC)和对照组(空质粒转染LSCC细胞)。取对数生长期的LSCC细胞置于6孔板中培养。孵育过夜后,将miR-125b-5p模拟物和模拟对照miRNA经Lipofectamine 2000根据制造商的说明将miRNA转染到LSCC细胞中。转染12 h后,用含10%FBS的新鲜DMEM替换培养基培养7 d,细胞转染培养环境为100 U/mL青霉素、100 μg/mL链霉素、含5%CO2的37°C湿润环境。
1.2.2 RT-qPCR检测LSCC细胞miR-125b-5p的表达水平 采用miRNeasy Mini试剂盒从LSCC细胞系中提取miRNA。使用NanoDrop-2000分光光度计测量RNA的浓度,将miRNA逆转录成cDNA,使用ABI7500实时PCR系统进行RT-qPCR。PCR扩增反应体系:2×Taq Master Mix 10 μL,Primer set 1 μL,probe 0.4 μL,cDNA 8.6 μL。PCR 扩增条件为:95.0 ℃3 min,95.0 ℃ 12 s,62.0 ℃ 40 s,95.0 ℃ 12 s,循环40次。以β-actin为内参对照。采用2-ΔΔCt法分析miR-125b-5p的相对表达水平。miR-125b-5p的RT-qPCR引物序列:Forward primer(5'-3')为TCCCTGAGACCCTAACTTGTGA;Reverse primer(5'-3')为 AGTCTCAGGGTCCGAGGTATTC。β-actin的RT-qPCR引物序列:Forward primer(5'-3')为 TGCGGGTGCTCGCTTCGGCAGC;Reverse primer(5'-3')为 CCAGTGCAGGGTCCGAGGT。
1.2.3 CCK-8实验检测LSCC细胞的增殖能力 将miR-125b-5p转染组和对照组细胞接种于96孔板中,每孔 1 000 个细胞。分别在 0 h、24 h、48 h、72 h 和96 h时间点用CCK-8测定LSCC细胞的活力。向培养基中加入10 μL CCK-8试剂,并在37℃下再孵育2 h。用酶标仪检测450 nm处每孔的吸光度(OD)。实验重复3次取平均值。细胞增殖率的计算公式:细胞活力=[(OD加药-OD空白)/(OD加药0-OD空白)]×100%。其中,OD加药为具有细胞、CCK-8溶液和药物溶液的孔的吸光度;OD空白为具有培养基和CCK-8溶液而没有细胞的孔的吸光度;OD加药0为具有细胞、CCK-8溶液而没有药物溶液的孔的吸光度;细胞活力指细胞增殖活力或细胞毒性活力。
1.2.4 平板集落形成实验检测LSCC细胞集落形成能力 将miR-125b-5p转染组和对照组的LSCC细胞接种在6孔板中,每孔500个细胞。在37℃下培养2周后,在室温下用甲醇固定15 min,0.1%结晶紫染色。采用磷酸盐-盐水(PBS)洗涤2次,并用显微镜计算集落数。集落抑制率=(1-miR-125b-5p转染组落形成数/对照组集落形成数)×100%。
1.2.5 检测miR-125b-5p与HK2的3'-UTR结合情况 采用 TargetScan(www.targetscan.org/vert_71/)预测miR-125b-5p的下游靶基因,在HK2的3'-UTR1370-1377的核苷酸处发现miR-125b-5p结合的靶位点(CCUCAGGGA)。为检测HK2是否是miR-125b-5p的功能靶标,通过在miR-125b-5p转染组或对照组下转染野生型和突变体(3'-UTR mut)并进行荧光素酶报告基因测定。
1.2.6 流式细胞术检测LSCC细胞的凋亡情况 将miR-125b-5p转染组和对照组的细胞转染48 h后,通过离心获取细胞并用预冷PBS洗涤2次。用1×膜联蛋白结合剂将细胞沉淀重悬浮。将5 μL膜联蛋白V和1 μL碘化丙啶加入100 μL细胞悬浮液中,在室温下温育15 min后,将400 μL 1×膜联蛋白结合缓冲液加入细胞悬液中,用流式细胞仪分析LSCC细胞的凋亡情况。实验重复3次取平均值。每个样品随机计数4个视野,按公式计算凋亡指数(AI)。AI=凋亡细胞数/(凋亡细胞数+正常细胞数)。
1.2.7 Western blot检测LSCC细胞HK2蛋白的表达水平 采用NP-40缓冲液裂解细胞,获得miR-125b-5p转染组和对照组LSCC细胞的总细胞裂解物。采用Bradford法测定蛋白质浓度。通过15%SDS PAGE分离每个样品的20 μg蛋白质,并转移到聚偏二氟乙烯膜上。在室温下用5%脱脂牛奶封闭1 h后,将膜与抗HK2 抗体(1∶1 000)一起孵育,保持 2 h。然后用 Tris Bu盐水和TBST洗涤膜2次。用LI-COR Odyssey成像系统显现蛋白质条带。目的蛋白表达水平=目标蛋白的分光管密度/Mark蛋白的密度。
1.2.83H-2DG法测定葡萄糖摄取量 根据FISCHER等[12]报道,以细胞对3H-2DG摄取量反映葡萄糖的摄取情况。两组细胞无血清条件下培养24 h后换为低糖DMEM培养液,以1 mol/L异丙肾上腺素、10 mol/L去甲肾上腺素分别刺激细胞48 h,然后加入去甲肾上腺素,在加入药物同时加入37 kBq/mL3H-2DG,继续培养48 h,20 mol/L细胞松弛素终止反应。0.5 mol/L氢氧化钠裂解细胞15 min后,加入同体积0.5 mol/L盐酸中和。用BCA法测定蛋白含量,用液闪仪测定加入闪烁液中细胞裂解液的dpm值。不加任何激动剂只加入20 mol/L细胞松弛素培养48 h测得的dpm值为细胞非特异性结合的放射活性。细胞3H-2DG摄取量=(细胞总放射活性-非特异性结合的放射活性)/蛋白含量。
1.2.9 乳酸盐比色测定试剂盒检测乳酸产量 采用乳酸盐比色测定试剂盒,通过分光光度计检测乳酸盐吸光度,以蒸馏水调零,比色杯光径1.0 cm,读取空白管、对照管、标准管、测定管的340 nm吸光度(OD),2 h内检测完毕。乳酸产量(mmol/g)=[(OD测定-OD对照)/(OD标准-OD空白)]×5/待测样品蛋白浓度。
1.3 统计学方法
采用SPSS 20.0统计软件(美国IBM公司)进行数据分析。计量资料采用均数±标准差(χ±s)表示,组间比较采用独立样本t检验;LSCC细胞系和正常细胞系中的miR-125b-5p表达水平的比较采用配对样本t检验。本研究以双侧P<0.05为差异有统计学意义。
2 结果
2.1 miR-125b-5p在LSCC细胞系中表达下调
RT-qPCR实验结果显示,与人正常支气管上皮细胞相比,miR-125b-5p在LSCC细胞系中的表达降低(0.68±0.03vs0.22±0.05,t=7.025,P=0.001),见图 1。
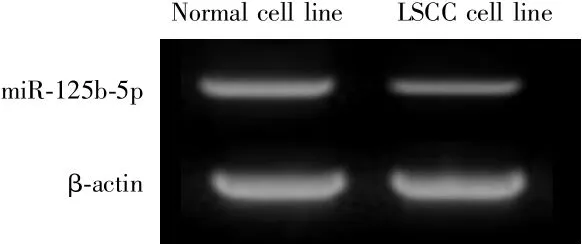
图1 miR-125b-5p的表达水平Fig.1 Expression of miR-125b-5p
2.2 miR-125b-5p的过表达抑制LSCC细胞的增殖能力
CCK-8实验结果显示,转染0 h、24 h和48 h后,miR-125b-5p转染组与对照组细胞增殖能力比较,差异均无统计学意义(P>0.05);转染72 h和96 h后,miR-125b-5p转染组LSCC细胞的增殖能力低于对照组,差异均有统计学意义(P<0.05)。见表1。

表1 转染后不同时间LSCC细胞的增殖能力Tab.1 Proliferative ability of LSCC cells at different time after transfection
2.3 miR-125b-5p过表达诱导LSCC细胞凋亡和降低集落形成能力
流式细胞术实验结果显示,miR-125b-5p转染组LSCC 细胞凋亡率高于对照组[(37.52±2.34)%vs(12.46±3.52)%,t=7.025,P<0.001)]。miR-125b-5p 转染组LSCC细胞的集落形成能力低于对照组(0.29±0.02vs1.02±0.03,t=5.689,P=0.005)。
2.4 miR-125b-5p与HK2的3'-UTR直接结合
荧光素酶报告基因测定实验结果显示,miR-125b-5p转染组的荧光素酶活性低于对照组(0.32±0.03vs1.01±0.02,t=7.543,P=0.001)。表明 miR-125b-5p与HK2的3'-UTR之间的直接结合。
2.5 miR-125b-5p过表达抑制LSCC细胞HK2蛋白表达
Western blot实验结果显示,miR-125b-5p转染组miR-125b-5p过表达的LSCC细胞中HK2的蛋白表达水平低于对照组(0.12±0.02vs0.75±0.03,t=5.875,P=0.023),见图2。表明miR-125b-5p可负调节LSCC细胞中HK2的表达。

图2LSCC细胞HK2蛋白表达Fig.2 Expression of HK2 protein in LSCC cells
2.6 miR-125b-5p过表达抑制LSCC细胞的糖酵解能力
3H-2DG摄取测定法实验结果显示,miR-125b-5p转染组LSCC细胞葡萄糖消耗低于对照组[(3.85±0.86)dpm/mgvs(10.52±1.34)dpm/mg,t=6.118,P=0.005]。miR-125b-5p转染组LSCC细胞的乳酸产生量亦低于对照组[(4.23±1.36)dpm/mgvs(10.96±2.45)dpm/mg,t=5.907,P=0.002]。
3 讨论
能量代谢通路紊乱与细胞线粒体功能异常有关,而乳酸和丙酮酸异常则可能与糖酵解途径有关[12-14]。糖酵解的一些代谢中间体也为脂类、氨基酸及其他生物合成提供前体和原料。从氧化磷酸化到癌细胞的有氧糖酵解重新编程,这一独特的代谢为探索癌症进展的分子机制提供了新的方向,而参与糖酵解酶的下调可能是抑制肿瘤发生的途径[15]。miRNAs是一类由发卡结构转录物形成的短单链非编码RNA,通过与编码蛋白mRNA的3'-UTR区域进行互补结合,抑制mRNA翻译或直接导致mRNA降解,负向调控基因表达。有研究发现在食管鳞状细胞癌中miR-125b-5p通过靶向高迁移率族蛋白A2,发挥肿瘤抑制作用[16]。在胆囊癌中亦发现miR-125b-5p的肿瘤抑制作用,且miR-125b-5p表达上调被认为是该病早期HBV阳性肝细胞癌的新型生物标志物[17]。miRNA参与调控肿瘤的发生和发展[18]。本研究发现,相较于人正常支气管上皮细胞,LSCC细胞中miR-125b-5p的表达下调,且过表达miR-125b-5p可抑制LSCC细胞活力和细胞集落形成能力,并诱导细胞凋亡,进一步分析发现,过表达miR-125b-5p亦可降低 LSCC细胞葡萄糖消耗和乳酸产生量,说明miR-125b-5p在喉鳞状细胞癌中可抑制有氧糖酵解,可能作为抑癌因子发挥作用。
miRNA在mRNA上的结合位置主要认为在3'-UTR上,但研究表明,miRNA也能结合到5'-UTR甚至CDS 区行使功能[19]。SHIVRAM 等[20]报道,结合到5'-UTR的miRNA常常起到转录激活的作用,这有可能是RISC复合物“撑”开了折叠的mRNA,方便转录起始因子或核糖体进入。因此,miRNA发挥作用是通过调控靶蛋白表达和功能进行。研究者已经在多种癌症中发现了HK2的过度表达,这与癌细胞的葡萄糖代谢增加有关[21]。因此,HK2有可能是miRNA调节癌症中糖酵解过程的靶基因,也即HK2是miR-125b-5p靶蛋白。miR-125b-5p抑制糖酵解、抑制增殖能力、促进凋亡和抑制集落的作用很可能是通过下调HK2而实施。据报道,在肝癌中miR-199a负调节HK2的表达,从而抑制葡萄糖消耗和乳酸产生。此外,miR-98通过靶向HK2抑制结肠癌中的Warburg效应。在本研究中,过表达miR-125b-5p亦抑制了LSCC细胞中HK2蛋白的表达,与上述研究结果一致。
综上所述,本研究发现miR-125b-5p可能通过靶向HK2并负调节HK2表达,从而降低LSCC细胞糖酵解,抑制细胞生长,诱导细胞凋亡,miR-125b-5p有望成为治疗LSCC的潜在治疗靶点。
