Box-Behnken模型响应面法优化以玉米芯为基质培养黑曲霉孢子的工艺
2019-10-23杨海雁于喆源
杨海雁,于喆源
(张掖市质量检验检测研究院,甘肃张掖734000)
柠檬酸是当代日常生活中应用最多,并具有重要商业价值的有机酸,由于其具有良好的安全性能、风味及金属螯合能力以及缓冲能力,被广泛应用于食品、医药、洗涤剂和化妆品等领域,其中64%的柠檬酸应用于食品饮料,22%应用于去垢剂和洗涤剂,约10%应用于医药和营养品,2%应用于化妆品[1]。此外,柠檬酸也是重要的化工原料,用于合成聚合物[2],应用于纳米医学[3]和组织工程学等领域[4]。全球产量已经达到170 万吨,并且其需求正以每年3.5%~4.0%的速度增长[5]。我国是柠檬酸的主要生产国和出口国,年产量占世界总产量的53%[6]。
我国柠檬酸生产工艺广泛使用黑曲霉(Aspergillus niger)做生产菌种。作为非常重要的柠檬酸生产菌种,它可以利用不同的底物生产柠檬酸,产酸率高,副产物较少。但是黑曲霉菌株的产酸能力和产酸营养条件是制约柠檬酸生产能力的瓶颈[7]。国内外关于黑曲霉发酵生产柠檬酸的研究比较多,但是主要集中在高产菌种的选育、发酵原料的研究、发酵过程优化等,关于营养物质对黑曲霉产孢能力影响的研究较少[8]。黑曲霉的产孢能力直接影响产生的黑曲霉的数量进而影响其产柠檬酸的能力。据资料显示[9],玉米芯中含有丰富的适宜黑曲霉生长的营养物质,因此本研究尝试以玉米芯作为基础培养基,比较分析葡萄糖、蔗糖、淀粉、果糖等5 种碳源,玉米浆、麸皮浸出液、硫酸铵、氨水等6 种氮源以及碳源和氮源浓度对黑曲霉产孢能力的影响,筛选产孢能力最强的碳源,并确定其最佳添加量;以确定的碳源为基础,并在此基础上,通过进行响应面设计,以黑曲霉孢子的数目为响应值,以上述条件为影响因素,找到黑曲霉孢子生长的最佳条件,以期对黑曲霉孢子的进一步研究及利用奠定基础。
1 材料与方法
1.1 材料
黑曲霉(编号:CMCC(F)98003):中国食品药品检定研究院;葡萄糖、果糖、蔗糖、淀粉、糊精、硫酸铵、氨水(分析纯):国药集团化学试剂有限公司;玉米芯颗粒、玉米浆、麸皮、花生饼粉、黄豆饼粉:张掖市绿洲农贸交易市场。
1.2 仪器及设备
生化培养箱(SPX-250):上海跃进医疗器械有限公司;光学显微镜(ECLIPSE E200):尼康公司;立式高压灭菌锅(LMQ.C):山东新华医疗器械股份有限公司;生物安全柜(BHC-1300ⅡA2):苏州安泰空气技术有限公司;血细胞计数板(XB-K-25):玉环县求精医用仪器厂;电子天平(PLI502-S):梅特勒-托乐多公司;全自动定氮仪(SPD80):北京三品科创仪器有限公司。
1.3 方法
1.3.1 玉米芯基础培养基制备
取粉碎的玉米芯粉100 g 放入250 mL 的锥形瓶中,加入180 mL 纯化水,得到基础培养基。
1.3.2 孢子悬液制备
在无菌条件下用移液枪移取1.0 mL 孢子液至已灭菌的培养基中,玻璃珠打散后,用无菌水稀释至合适的倍数用于计数。
1.3.3 培养方法
将“1.3.2”项下加好孢子悬液的培养基放入恒温培养箱中,28 ℃培养 7 d。
1.3.4 玉米芯基本性质的测量
通过采用《食品安全国家标准食品中果糖、葡萄糖、蔗糖、麦芽糖、乳糖》测定[10],NY/T 2017-2011《植物中氮、磷、钾的测定》[11]标准中对总糖及氮元素的测量方法,确定试验用玉米芯中总糖含量56.0%,总氮含量1.6%。
1.3.5 孢子数的测定
将清洁干燥的25 mm×16 mm 血球计数板盖上盖玻片,再在盖玻片边缘滴一小滴摇匀的孢子悬液,让孢子液沿缝隙靠毛细作用自动进入计数室,计数室内不可有气泡。加样后静置5 min,待孢子沉降,然后将血球计数板置于显微镜载物台上,找到计数室进行计数。位于计数格划线上的孢子,取两边计数,另外两边不计。记下4 个角4 个大格和中央一大格的孢子数。每次重复观察计数不少于2 次,然后取平均值。计算可得每毫升孢子液中孢子数目。
1.3.6 麸皮浸出液制备
称取50 g 市售麸皮于500 mL 锥形瓶中,加入100 mL 纯化水,静置15 h,用两层纱布过滤,滤液待用。
1.3.7 单因素试验设计
黑曲霉生长的条件除了适宜的温度和湿度,最重要的就是碳源和氮源,因此本试验分别考察不同种类的碳源、氮源以及碳源浓度、氮源浓度,对黑曲霉在“1.3.1”所述玉米芯基础培养基中产孢能力的影响。在无菌条件下用移液枪移取1.0 mL 稀释好的孢子液于已灭菌的培养基中,按表1 所示,进行试验。
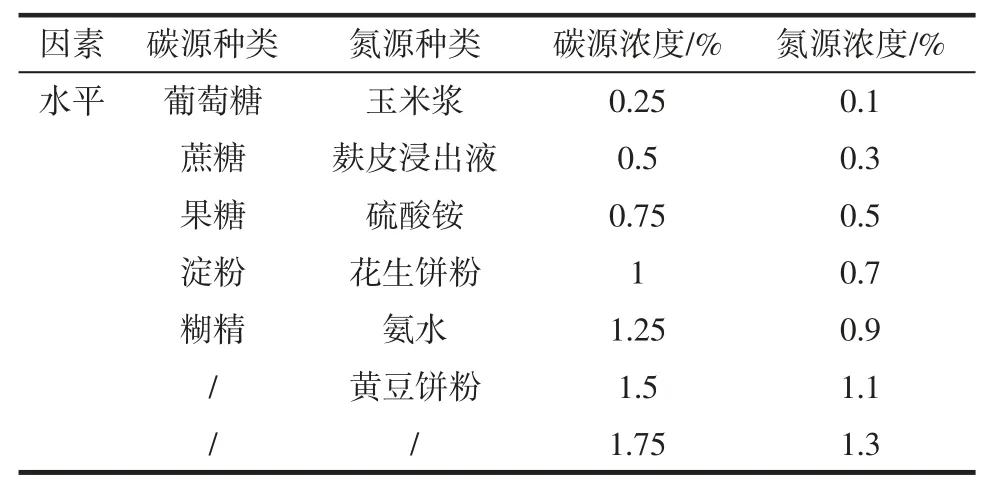
表1 单因素试验设计Table 1 Design of single-factor experiment
2 结果与分析
2.1 单因素试验
2.1.1 碳源种类的确定
在以玉米浆为氮源,玉米浆浓度0.45%,碳源浓度0.7%,其他因素不变的条件下,分别按表1 所示,选取不同碳源加入玉米芯基础培养基中,121 ℃灭菌30 min 后进行试验,结果见图1。
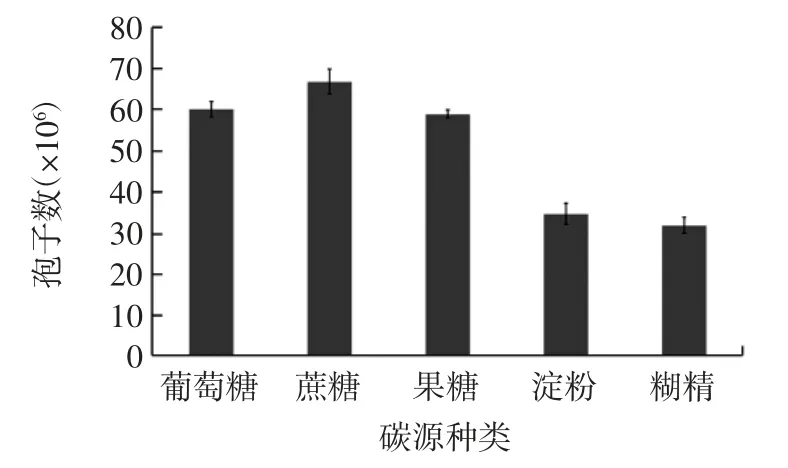
图1 碳源种类对黑曲霉孢子生长的影响(n=3)Fig.1 Effect of carbon source type on growth of Aspergillus niger spores(n=3)
由图1 可见,添加碳源的种类不同,黑曲霉产孢能力亦不同。当碳源为蔗糖时,黑曲霉孢子数达到最大值;当碳源为淀粉和糊精时,黑曲霉孢子数明显较小,蔗糖的产孢能力较其他糖高出11%~101.2%。原因可能是黑曲霉易于快速吸收单糖,蔗糖是双糖其水解变为二分子的单糖,含有单糖的浓度较高,能为黑曲霉提供足够的碳源,更利于黑曲霉孢子的生长[12-13];而淀粉、糊精是多糖化合物,其成分复杂且粘稠,致使溶解氧较少,有碍于黑曲霉的生长,且糊精在水中的粘性比淀粉大,故使黑曲霉孢子更难以利用[14-15]。因此,在实际试验中,添加碳源种类选取蔗糖为中心值。
2.1.2 碳源浓度的筛选
在玉米浆为氮源,氮源浓度0.45%,蔗糖为碳源,其他因素不变的条件下,分别按表1 所示,选取不同浓度的碳源加入玉米芯基础培养基中,121 ℃灭菌30 min后进行试验,结果见图2。
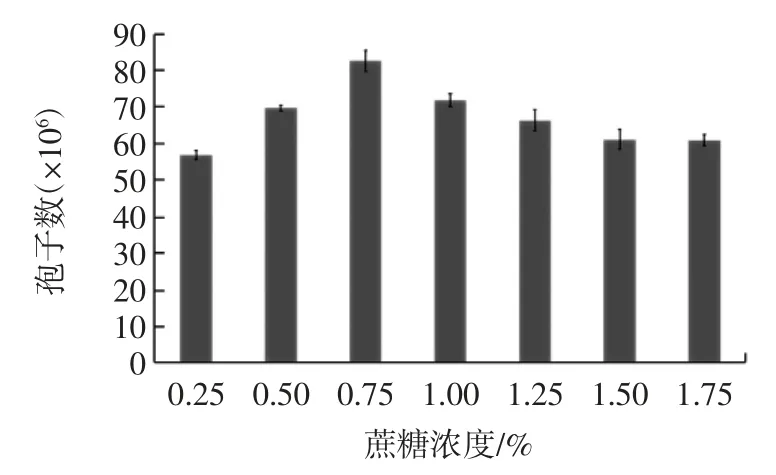
图2 碳源浓度对黑曲霉孢子生长的影响(n=3)Fig.2 Effect of carbon source concentration on growth of Aspergillus niger spores(n=3)
由图2 可见,随着碳源浓度的增加,黑曲霉产孢能力先增大后减小。当碳源浓度为0.75%时,黑曲霉孢子数达到最大值;当碳源浓度为0.25%时,黑曲霉孢子数为最小值。原因可能是黑曲霉适合在较高浓度的碳源中生长,浓度过低时不能为其生长提供足够的能量,而浓度过高时因为高渗透压等原因对其生长起抑制作用[16-17],不利于黑曲霉孢子的产生。因此,在实际试验中,以添加浓度为0.75%的蔗糖为中心值。
2.1.3 氮源种类的确定
在以蔗糖为碳源,碳源浓度为0.75%,氮源浓度0.45 %,其他因素不变的条件下,分别按表1 所示,选取不同氮源加入玉米芯基础培养基中,121 ℃灭菌30 min 后进行试验,其中麸皮浸出液按方法1.3.6 进行制备,结果见图3。
由图3 可见,氮源的种类不同,黑曲霉产孢能力亦不同。其中当氮源为硫酸铵时,黑曲霉孢子数达9.1×107个,当氮源为氨水时黑曲霉孢子数达7.1×107个,两者处于同一数量级。但较其他有机类氮源高出29%~103%。无机氮源的产孢能力明显大于有机氮源。原因一方面可能是无机氮源成分比较单一,且氮元素以铵根离子的形式在培养基中游离,黑曲霉孢子能够快速吸收利用;另一方面可能是无机氮源能够影响培养基的pH 值,使其更符合黑曲霉的最佳生长条件[3]。而有机氮源成分复杂,氮元素主要以化合态的形式存在,黑曲霉吸收利用较慢[18]。因此,在实际试验中,添加氮源种类选取硫酸铵为中心值。
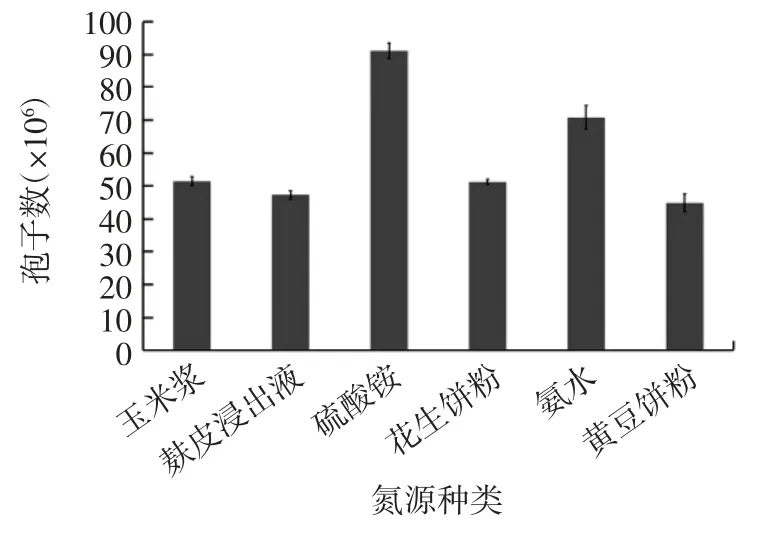
图3 氮源种类对黑曲霉孢子生长的影响(n=3)Fig.3 Effect of nitrogen source type on growth of Aspergillus niger spores(n=3)
2.1.4 氮源浓度的筛选
在硫酸铵为氮源,蔗糖为碳源,碳源浓度0.75%,其他因素不变的条件下,分别按表1 所示,选取不同浓度的氮源加入玉米芯基础培养基中,121 ℃灭菌30 min 后进行试验,结果见图4。
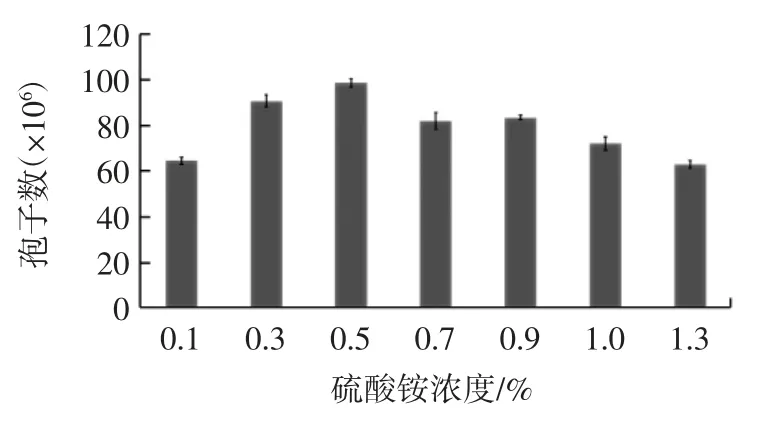
图4 氮源浓度对黑曲霉孢子生长的影响(n=3)Fig.4 Effect of nitrogen source concentrtion on growth of Aspergillus niger spores(n=3)
由图4 可见,随着氮源浓度增加,黑曲霉产孢能力先增大后减小。当氮源浓度为0.50%时,黑曲霉孢子数达到最大值,培养效果最佳。原因可能是当氮源浓度过低时不能满足黑曲霉孢子正常生长所需,当氮源浓度过高时由于溶液中离子浓度增大、pH 值变化等对黑曲霉孢子的生长起抑制作用[19-20],不利于黑曲霉孢子生长。因此,在实际试验中,以添加浓度为0.50%的硫酸铵为中心值。
2.2 响应面法优化
根据单因素试验结果的分析,氮源种类的不同对黑曲霉孢子的生长有显著的影响,硫酸铵明显优于其他种类氮源,所以在后续试验中,确定硫酸铵为氮源种类。选取2.1 项下碳源种类、碳源浓度、氮源浓度3 种因素为变量,运用Box-Behnken 响应面设计模型,以黑曲霉孢子数为响应值,通过建立响应面,得到黑曲霉孢子数与各因素变量的多项式方程,得出培养黑曲霉孢子的最佳条件。
2.2.1 响应面试验的建立
根据2.2 所述,选择碳源种类、碳源浓度、氮源浓度3 种因素为变量,建立三因素三水平的响应面优化试验,因素水平编码表如表2 所示。
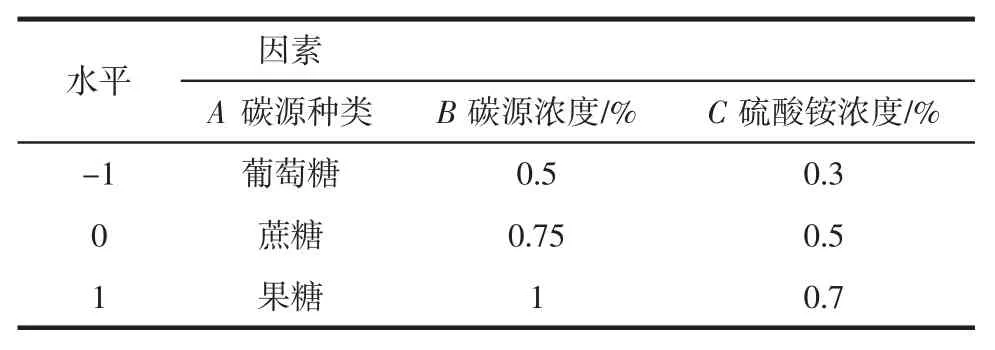
表2 响应面试验分析因素与水平Table 2 Analytical factors and levels of response surface experiemtns
采用Design-Expert8.0 软件,按照Box-Behnken组合设计[21-23],依据表2 所示因素水平设计试验方案,结果见表3,并进行方差分析,结果见表4。
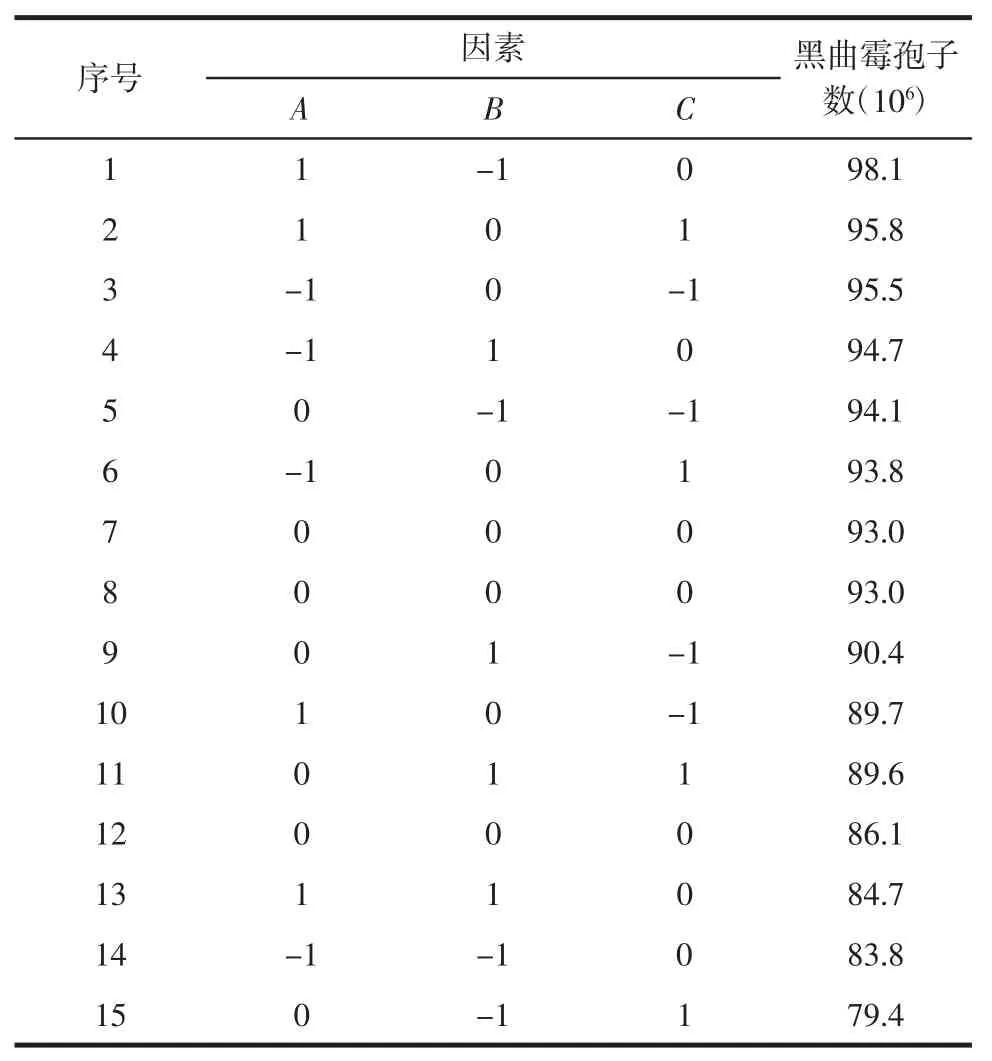
表3 响应面试验设计及结果(n=3)Table 3 Desing and results of response surface experiemtns(n=3)
2.2.2 响应曲面分析
采用Design-Expert8.0 软件对响应值与各因素编码值进行回归拟合后得到黑曲霉孢子数与各变量的二次多项式方程模型为:R=93.95-0.013A+4.89B-3.23C+3.60AC+1.10BC-3.72B2-1.94C2。
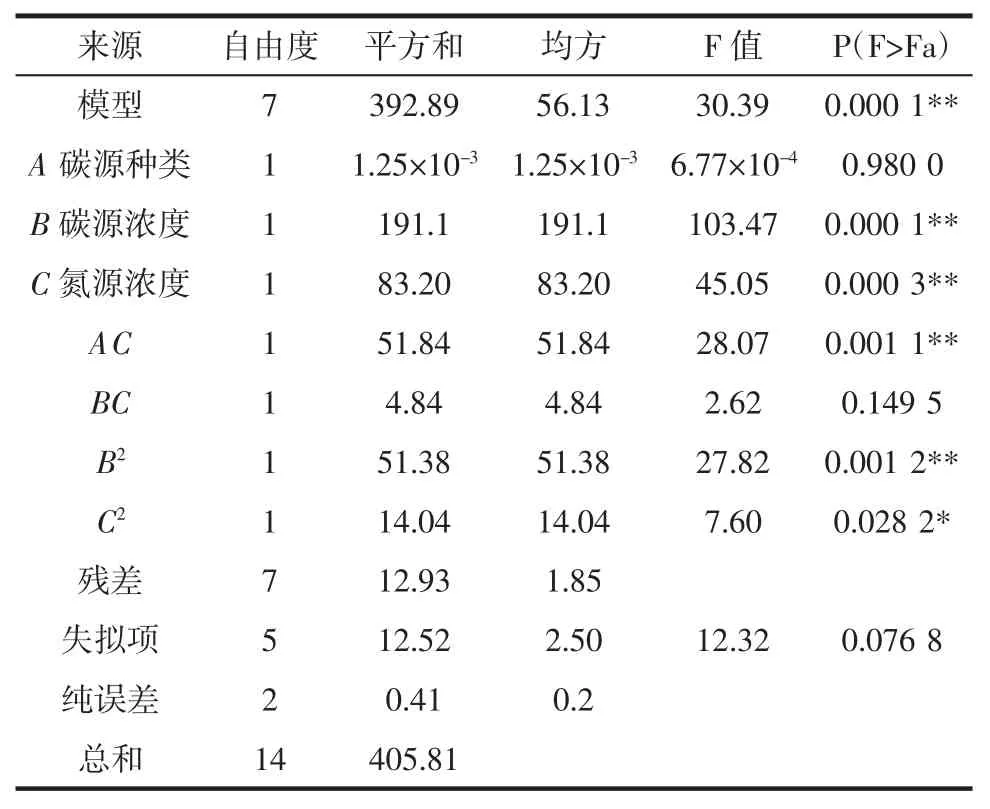
表4 方差分析Table 4 Analysis of variance
表4 可以看出,失拟项 P=0.076 8>0.05 不显著,说明该模型拟合良好;模型的均方差P=0.000 1<0.01,表明回归模型极显著;决定系数R2=0.968 1,校正系数Adj R2=0.926 3,说明选定因素对模型变化有较高相关性,模型对实测值具有较高的解释性,预测值具有较高可信度,可用此模型进行预测;变异系数CV %=1.49%,表明在该试验条件下,变异程度较小,具有较好的可重复性。由回归模型显著性分析可知:在选取的3 种考察因素中,碳源浓度和氮源浓度对黑曲霉孢子的产生有非常显著的影响,碳源种类与氮源浓度、碳源浓度和氮源浓度交互影响明显,其原因可能是,黑曲霉能快速吸收利用单糖,且其适宜在碳源浓度较高的环境中生长,氮源在选择使用硫酸铵时,其浓度能够明显影响培养基的pH 值,而黑曲霉在培养基pH=5 左右时生长最佳。所以碳源种类及浓度与氮源浓度存在明显的的交互交互关系,对黑曲霉孢子的产生有明显的影响[3,24]。其中,碳源种类与氮源浓度,碳源浓度和氮源浓度交互回归优化响应面如图5、图6所示。
2.2.3 优化条件的选取
根据模型预测,在以玉米芯和纯化水作为基础培养基培养黑曲霉孢子的最佳条件为:碳源种类为果糖,碳源浓度0.660%,氮源浓度0.278%,理论预测黑曲霉孢子数为9.57×107个。考虑到实际操作的可行性,确定最佳培养条件为:碳源种类为果糖,碳源浓度0.70 %,氮源浓度0.30%。在此条件下进行验证试验,3 次平行实验测得黑曲霉孢子数为9.48×107,9.61×107,9.57×107个,与模型预测值接近,表明模型能较好的预测黑曲霉孢子的生长情况。
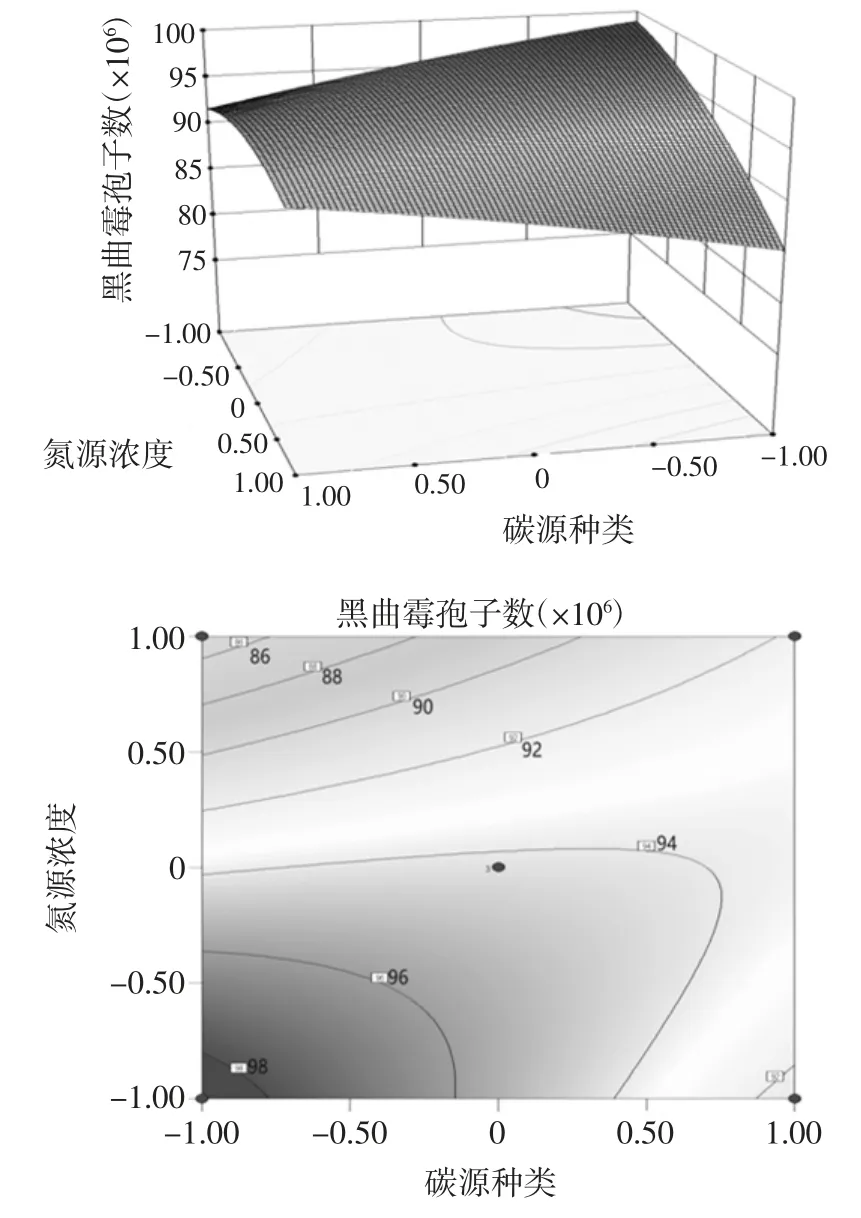
图5 碳源种类与氮源浓度交互作用的响应面及等高线图Fig.5 Response surface and contour map of interaction between carbon source type and nitrogen source concentration
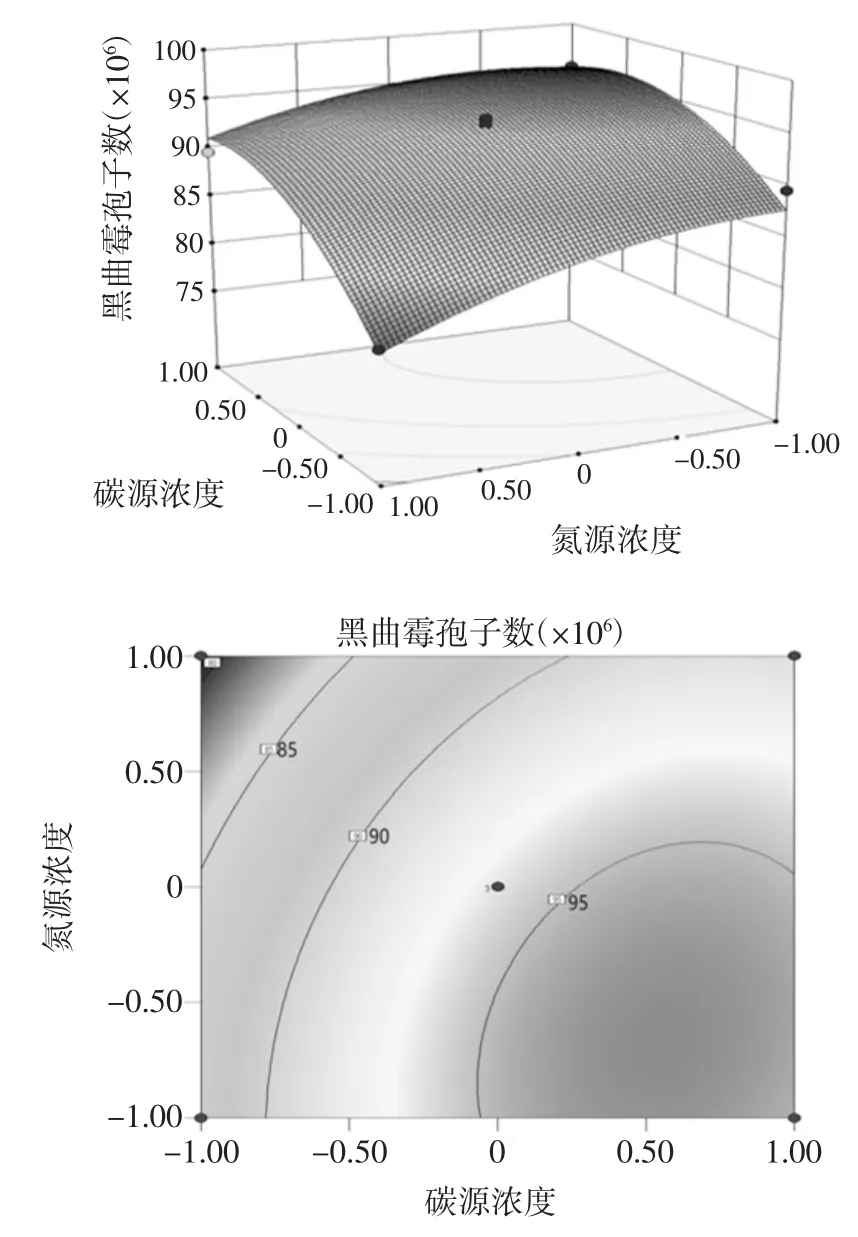
图6 碳源浓度与氮源浓度交互作用的响应面及等高线图Fig.6 Response surface and contour map of interaction between carbon source concentration and nitrogen source concentration
3 结论
本文采用响应面法,在单因素试验的基础上,最终确定对不同碳源种类,碳源浓度,氮源浓度3 个影响因素来考察对黑曲霉孢子生长的影响,建立的二次多项式数学模型具有良好的显著性。通过软件拟合结合实际,确定最佳培养条件为:碳源种类为果糖,碳源浓度0.70%,氮源浓度0.30%。通过验证试验,证明该模型拟合情况良好,表明采用响应面法优化黑曲霉孢子培养工艺切实可行。同时,该方法操作便捷、高效,且基础培养基采用农业副产品玉米芯作为原料,为农副产品的再利用提供了理论依据。
