小檗碱对肥胖小鼠脂肪组织纤维化及肠道菌群的调节作用研究
2019-10-23王杨孔敏宋晓瑜张嘉微李新莉
王杨,孔敏,宋晓瑜,张嘉微,李新莉
(大连医科大学基础医学院生物技术系生物制药教研室,辽宁大连116044)
黄连(Coptis chinensis Franch.)属毛茛科、黄连属多年生草本植物,具有清热燥湿,泻火解毒之功效。其主要成分为小檗碱,又称黄连素(berberine,BBR),是一种异喹啉类生物碱,作为传统的抗炎、抑菌药物在临床应用己久[1]。近年来在心血管疾病、糖脂代谢影响方面的研究显示小檗碱在降脂方面具有优异的治疗前景,其作用机制可能与调节肠道菌群结构、影响胆汁酸的合成与代谢、激活内脏脂肪组织相关基因的表达、激活腺自酸活化蛋白激酶(adenosine 5’-monophosphate-activated protein kinase,AMPK)途径、改善胰岛素抵抗等有关[2]。
肥胖人群白色脂肪组织中细胞外基质异常堆积,即发生了脂肪组织纤维化[3],是脂肪组织功能障碍的标志之一。肥胖伴有代谢综合征的患者较单纯肥胖的患者,脂肪组织纤维化程度更重,提示脂肪组织纤维化与肥胖所致代谢紊乱有关。已有研究[4-5]表明,肠道细菌与肥胖、糖尿病以及心血管疾病密切相关。一些降糖药物可改善糖尿病患者肠道菌群结构,减少慢性低度炎症,这为患者带来独立于降糖作用之外的获益[6-7]。AMPK 不仅是细胞能量代谢的感受器还是多种药物的作用靶点,激活AMPK 可能对于糖尿病、炎症和肿瘤的治疗具有着广泛的应用前景[8]。
本课题对小檗碱是否能通过AMPK 途径减轻肥胖小鼠的组织纤维化和肠道菌群失调进行研究。使用高脂乳剂建立小鼠肥胖模型,检测脂肪组织中肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)、转化生长因子-β1(transforming growth factor beta1,TGF-β1)和AMPK-α1 的表达水平,使用肠杆菌基因间重复共有序列基因扩增(enterobacterial repetitive intergenic consensus-polymerase chain reaction,ERIC-PCR) 和聚合酶链式反应——变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient gel electrophoresis,PCR-DGGE)技术分析小檗碱对肥胖小鼠肠道菌群的影响,初步探讨小檗碱减轻脂肪纤维化和肠道菌群失调的可能作用机制,为在新形势下更好的使用小檗碱这一老药提供试验依据。
1 材料与方法
1.1 材料与试剂
小檗碱(批号:2160951,规格:0.1g):东北制药集团沈阳第一制药有限公司;兔源抗β-actin 抗体、兔源抗 TNF-α 抗体、兔源抗 TGF-β1 抗体、兔源抗 AMPK-α1 抗体、辣根过氧化物酶标记的山羊抗兔免疫球蛋白G 多克隆抗体:武汉三鹰生物技术有限公司;Pierce ECL 化学发光试剂盒、硝酸纤维素膜:大连万泽贸易有限公司;RIPA 裂解液:北京索莱宝科技有限公司;粪便细菌DNA 提取试剂盒:成都福际生物技术有限公司;引 物 GC -341f (5′ -CGCCCGGGGCGCGCCCCGGG CGGGGCGGGGGCACGGGGGGCCTACGGGAGGCAG -CAG)、518r (5′ -ATTACCGCGGCTGCTGG)、ERIC -1(ATGTAAGCTCCTGGGGATTCAC)、ERIC-2(AAGTAAGTGACTGGGGTGAGCG):英潍捷基上海贸易有限公司;PCR-Mix:大连优萌威贸易有限公司;丙烯酰胺、甲叉双丙烯酰胺、尿素、去离子甲酰胺、琼脂糖、溴化乙锭(ethidium bromide,EB):大连羽铭生物科技有限公司;DL2000 Marker、DL100 Marker:大连宝生物工程有限公司。
试验动物:SPF 级KM 小鼠40 只,雌雄各半,体重18 g~22 g,由大连医科大学实验动物中心提供,动物合格证号:SCXK(辽)2008-0002,本实验通过大连医科大学伦理委员会同意。
1.2 仪器与设备
UVS-1 涡旋振荡器:北京优晟科技有限公司;HC-3018R 高速冷冻离心机(离心半径6 cm):安徽中科中佳科学有限公司;JY-spat 琼脂糖水平电泳仪、ST-Ⅰ型半干式转移电泳仪、DGGE 电泳仪:大连竞迈设备有限公司。
1.3 方法
1.3.1 高脂乳剂的制备
根据参考文献[9],取20 g 猪油于40 ℃水浴加热融化,置于乳钵中,加入10 g 胆固醇,1 g 丙硫氧嘧啶,充分搅拌,溶解。加入吐温-80、丙二醇各20 mL,研磨混匀,缓慢加入10%去氧胆酸钠水溶液20 mL,研磨乳化,加蒸馏水至100 mL,装入密闭容器中,冷藏。使用时于37 ℃水浴融化。
1.3.2 模型建立与分组
实验小鼠随机分为正常对照组(N)、肥胖模型组(F)、小檗碱高剂量(400 mg/kg)组(BH)和小檗碱低剂量(100 mg/kg)组(BL),每组 10 只。除正常对照组外,其他组小鼠连续灌服高脂乳剂(0.1 mL/10 g)12 周,建立肥胖模型,之后各组小鼠给予相应药物9 周。期间小鼠正常饮食和饮水,每周称量体重,于实验第13 周和第21 周收集鼠便适量,并在最后一天采用颈椎脱臼法处死小鼠,迅速剥离皮下腹股沟脂肪,将小鼠粪便与白色脂肪组织于-80 ℃保存备用。
1.3.3 Western-blot 检测 TNF-α、TGF-β1 和 AMPK-α1 的表达水平
取50 mg 左右脂肪加入0.5 mL 预冷的蛋白裂解液(radio-immunoprecipitation assay,RIPA),冰上匀浆20 次~40 次,直到95%的细胞被破碎,然后在冰浴中放置30 min,间断摇动。12 000 r/min 4 ℃离心15 min,将上清液转移到新的离心管中,用枪头小心剥去上层脂质层,吸下层清液,再离心,直至不出现明显的脂质层,即得脂肪组织总蛋白提取物,分装,-80 ℃保存备用。常规十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)电泳,每组肝组织蛋白上样量为15 μg,分离胶浓度10%,浓缩胶浓度5%,待预染Marker 充分被分开,停止电泳。用半干式电转仪进行转膜。脱脂奶粉封闭硝酸纤维素膜1 h。分别与一抗β-actin(体积比1 ∶500 稀释)、TNF-α(体积比 1 ∶500 稀释)、TGF-β1(体积比 1 ∶500 稀释)、AMPK-α1(体积比 1 ∶500 稀释)结合,4 ℃过夜,洗膜缓冲液(tris buffered saline tween,TBST)洗膜,于二抗辣根过氧化物酶标记的山羊抗兔免疫球蛋白G 多克隆抗体(体积比1 ∶5 000 稀释)孵育 2 h,化学发光(electrochemiluminescence,ECL),凝胶成像。以β-actin 为内参,采用Quantity One 4.6.2软件进行蛋白灰度值分析,各蛋白表达量是与内参的比值。
1.3.4 肠杆菌基因间重复共有序列基因扩增(enterobacterial repetitive intergenic consensus -polymerase chain reaction,ERIC-PCR)
使用试剂盒提取每只小鼠粪便细菌DNA,按说明书进行操作。以上、下游引物ERIC-1 和ERIC-2 进行ERIC-PCR 扩增,体系(25 μL)为:2×Easy Taq PCR SuperMix 12.5 μL,10 μmol/L 的上下游引物各 0.5 μL,DNA 模板 2 μL,去离子水补充至 25 μL。PCR 程序:预变性 94 ℃ 5 min;变性 94 ℃ 50 s,退火 49 ℃ 30 s,46 ℃30 s,延伸 72 ℃ 3 min,35 个循环;充分延伸 72 ℃ 9 min。PCR 扩增产品用3%琼脂糖凝胶电泳检测,以2 000 bp Marker 为参照。
1.3.5 聚合酶链式反应-变性梯度凝胶电泳
使用16S rRNA 基因V3 可变区上、下游引物GC-341f 和 518r,扩增体系同 1.6。PCR 程序:预变性 94 ℃5 min;变性 94 ℃ 30 s,退火 54 ℃ 30 s,延伸 72 ℃ 30 s,30 个循环;充分延伸72 ℃7 min。采用8%丙烯酰胺凝胶配制25%~50%DGGE 变性梯度凝胶 [其中100%浓度变性梯度凝胶含40%(体积分数)去离子甲酰胺和 7 mol/L 尿素],取 10 μL PCR 产物进行 DGGE 电泳,60 ℃、70 V 电泳5 h,电泳后取出凝胶使用0.125‰溴乙锭染色,拍照。切下PCR-DGGE 图谱中的优势条带,加入 20 μL 无菌水捣碎,于 95 ℃浸泡 10 min,37 ℃过夜,取上清液做模板进行PCR 扩增,引物为341f 和518r,PCR 反应体系和程序同 1.6。PCR 产物经测序,结果在GenBank 数据库中进行Blast 对比分析。
1.4 数据分析
采用Quantity One 4.6.2 软件分析ERIC-PCR 图谱中主要条带的分子量,对PCR-DGGE 图谱进行UPGMA 相似性聚类分析和多样性分析,所得数据应用SPSS 10.0 软件包处理,正态计量指标采用均数±标准差(± SD)表示,组间两两比较采用 LSD-t 检验;P 值<0.05 表示有显著性的差异,P 值<0.01 表示有及其显著性的差异。
2 结果与分析
2.1 小檗碱对肥胖小鼠体重的影响
小檗碱对肥胖小鼠体重的影响如图1 所示。
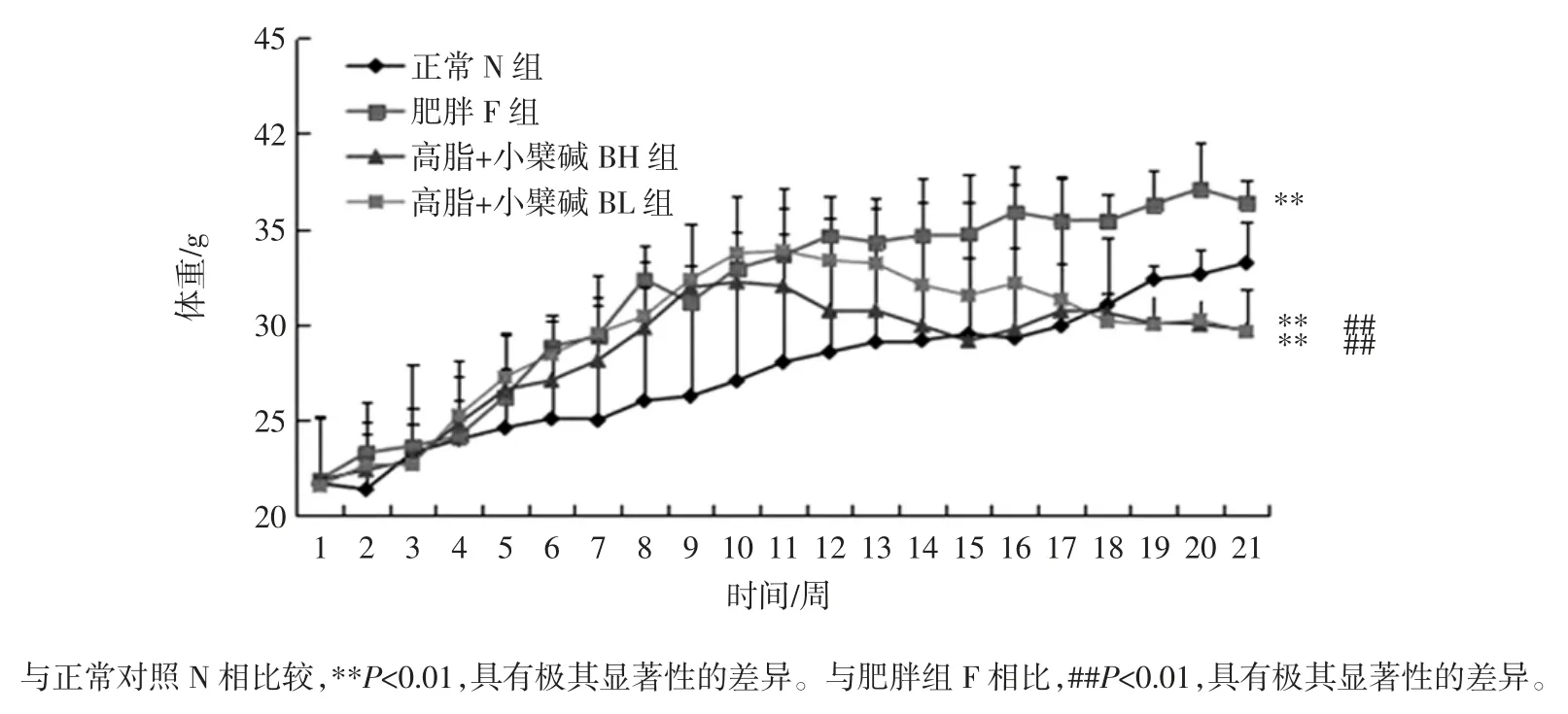
图1 小檗碱对肥胖小鼠体重的影响Fig.1 Effect of berberine on weight of obese mice
高脂乳剂灌胃12 周建立肥胖小鼠模型,F、BH 和BL 组小鼠体重均呈现明显上升趋势,与N 组小鼠相比具有极其显著性的差异(P<0.01)。之后各组小鼠开始灌服相应药物,从第13 周开始N 组和F 组小鼠体重仍继续上升,上升速度减缓。而小檗碱给药组小鼠体重均出现下降,其中高脂+小檗碱高剂量组(BH)小鼠体重明显减少,与F 组相比有及其显著性的差异(P<0.01)。以上结果说明,高脂乳剂导致小鼠体重明显增加,小檗碱能够降低肥胖小鼠体重。
2.2 Western-blotting检测TNF-α、TGF-β1和AMPK-α1的表达水平
Western-blot 检测肝组织中 TNF-α、TGF-β1 和AMPK-α1 的表达水平。分析各蛋白质条带灰度,进行半定量比较,以目的基因的条带灰度与管家基因β-actin的灰度比值表示蛋白质的表达水平,结果如图2 所示。
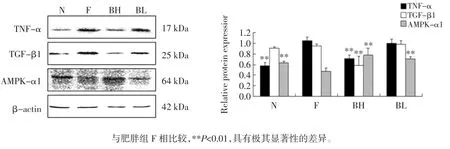
图2 Western-blot 法检测TNF-α、TGF-β1 和AMPK-α1 表达水平及各蛋白质与β-actin 灰度值比值Fig.2 The expression and gray scale value ratio of TNF-α,TGF-β1 and AMPK-α1
上述结果显示,与正常对照组N 相比,肥胖组小鼠脂肪组织中TNF-α 和TGF-β1 的表达水平升高,AMPK-α1 表达水平显著降低(P<0.01)。与肥胖组 F 相比,小檗碱给药组脂肪组织TNF-α 和TGF-β1 的表达水平有所降低,且BH 组具有极其显著性的差异(P<0.01),而 AMPK-α1 表达水平升高,BH 和 BL 组均具有极其显著性的差异(P<0.01)。
2.3 EIRC-PCR图谱分析
第 13 周(给药 1 周)和第 21 周(给药 9 周)小鼠肠道菌群ERIC-PCR 图谱如图3 所示。
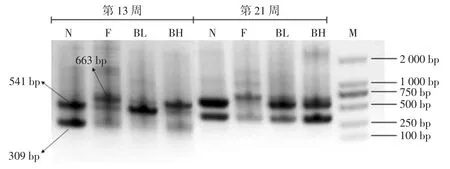
图3 小鼠肠道菌群ERIC-PCR 图谱Fig.3 ERIC-PCR profiles of intestinal microflora in mice
正常对照组(N)主要条带集中在540 bp 和310 bp附近。肥胖模型组(F)以663 bp 的条带为优势条带。第13 周,小檗碱给药组(BH,BL)以 540 bp 左右的条带为主。第21 周,正常对照组和肥胖模型组小鼠优势条带变化不大,但小檗碱给药组中310 bp 左右的条带强度明显增强,且此条带在小檗碱高剂量组中强度最强。以上研究结果表明高脂乳剂建立肥胖模型,小鼠肠道菌群结构发生明显改变,540 bp 和310 bp 左右的条带为小檗碱给药组小鼠肠道中的特征条带。
2.4 PCR-DGGE图谱分析
各组小鼠肠道菌群PCR-DGGE 图谱如图4 所示。
DGGE 图谱中优势条带测序结果如表1 所示。
DGGE 图谱中同一位置的条带代表相同的优势细菌,条带亮度则反映出这一细菌的相对含量。实验组各泳道条带较多,亮度较强,表明小鼠肠道菌群的种类和数量较多,肠道菌群结构的丰富度和多样性较高。在实验第 13 周和 21 周,毛螺科菌(Lachnospiraceae bacterium,条带b)、嗜酸乳杆菌(Lactobacillus acidophilus,条带 c)、普雷沃菌(Prevotella sp.,条带d)存在于小檗碱给药组为共有条带,说明毛螺科菌、嗜酸乳杆菌和普雷沃菌是小檗碱给药后小鼠肠道中的优势菌群,上述细菌在小檗碱高剂量组(BH)中强度最强,含量最大。费克蓝姆氏菌(Facklamia iqnava,条带 a)在高脂乳剂灌服的小鼠(F、BH、BL 组)肠道中存在,与肥胖组(F)相比,小檗碱给药组(BH、BL)中此条带的强度减弱,含量减少。第21 周,费克蓝姆氏菌(Facklamia iqnava)在各实验组中强度降低直至消失,这表明费克蓝姆氏菌(Facklamia iqnava)是肥胖小鼠与其他组小鼠肠道差异菌群。
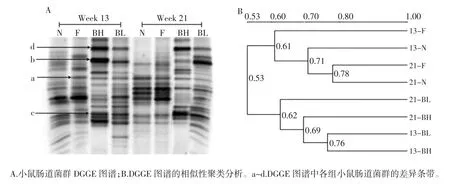
图4 小鼠肠道菌群DGGE 图谱和UPGMA 相似性聚类分析Fig.4 Representative DGGE profiles and UPGMA dendrograms of intestinal microflora

表1 DGGE 图谱中优势条带测序与参比序列对照结果Table 1 Comparative results of dominant band sequence and reference sequence in DGGE profile
UPGMA 分析DGGE 图的相似性,结果显示各组小鼠肠道菌群结构聚成两大簇,小檗碱高低剂量给药组聚成一簇,其他组聚成另一簇,两大簇之间相似性较低,仅为0.53,表明小檗碱对小鼠肠道菌群结构有明显影响。在第一簇中,肥胖组(13-F)与正常对照组(N)又分别聚成两小簇,二者相似性为0.61,表明肥胖小鼠肠道菌群结构与正常小鼠差别较大。其中第21 周,正常组和肥胖组小鼠肠道菌群结构有较高的相似性,为0.78,表明停止使用高脂乳剂灌胃,随着时间周期的加长,肥胖模型组小鼠肠道菌群结构趋于正常。
3 结论与讨论
肥胖主要以多种免疫细胞积聚在脂肪组织为特征,其中促炎巨噬细胞浸润和炎症相关的基因表达能促进胰岛素抵抗,是小鼠和人类肥胖最重要的表现。巨噬细胞可分为两型,分泌促炎细胞因子TNF-α 和白细胞介素(interleukin,IL-6、IL-1β)的 M1 巨噬细胞,分泌抗炎因子(IL-10、TGF-β)的 M2 巨噬细胞[10]。文献报道[2],高脂饲料喂养的小鼠,体重及内脏脂肪明显增加,出现糖耐量的异常,血清TNF-α 水平升高。TGF-β是引起各器官纤维化最重要的细胞因子之一,人血浆TGF-β1 水平与体重指数BMI 显著正相关,肥胖小鼠血清TGF-β1 水平、脂肪组织中TGF-β1 表达明显高于正常[11]。肥胖时升高的TGF-β1 又可引起脂肪组织纤维化,TGF-β1、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、基质金属蛋白酶抑制剂-1(tissue inhibitor of metalloproteinase,TIMP-1)等纤维化关键调控蛋白表达增加,同时脂肪组织AMPK 磷酸化受抑制。在 TGF-β1 造成的基质血管成分(stromal vascular fraction,SVF)细胞纤维化模型中,一些 AMPK 药物激动剂能够抑制纤维化生成和降解相关蛋白的异常激活[12]。本实验肥胖组小鼠脂肪组织中TNF-α 和TGF-β1 的表达水平升高,AMPK-α1 表达水平明显降低。小檗碱给药后 TNF-α 和 TGF-β1 的表达降低,而AMPK-α1 表达升高。上述结果表明肥胖小鼠脂肪组织发生纤维化,TGF-β1 等纤维化关键调控蛋白表达增加,同时脂肪组织AMPK 磷酸化受抑制。小檗碱给药后不仅使肥胖小鼠体重减轻,还明显抑制脂肪组织纤维化,激活肥胖小鼠脂肪组织AMPK 活性,抑制TGF-β1 表达。
肠道菌群与AMPK 关系密切[13],肠道菌群参与机体的能量代谢,诱发葡萄糖无氧酵解,促使AMPK 磷酸化释并放抑制炎症因子,起到抗炎作用。肠道菌群结构及功能失调,可诱导氧化应激,造成肠黏膜上皮细胞的损伤,AMPK 活性下降,促炎因子分泌增多,肠粘膜免疫屏障被破坏,导致局部炎症反应的发生。在肠道内,毛螺科菌和乳酸杆菌等参与碳水化合物发酵生成短链脂肪酸(short chain fatty acid,SCFAs),二者减少直接导致SCFAs 产量下降,进一步使肠道内pH 值升高,氨的产量和吸收增加[14]。而Facklamia iqnava 是新兴的病原体能够引起人类感染[15]。本实验中肥胖小鼠肠道菌群失调,以致病菌Facklamia iqnava 为优势菌群,益生菌如毛螺科菌和乳酸杆菌明显减少。小檗碱给药后毛螺科菌和嗜酸乳杆菌增加,成为优势菌群。
综上,高脂乳剂建立肥胖模型,小鼠脂肪组织出现纤维化,肠道菌群失调,益生菌含量减少,致病菌含量增加。小檗碱对肥胖小鼠脂肪组织纤维化的减轻和肠道菌群的调节作用机制不仅与激活AMPK,抑制TNF-α 和 TGF-β1 等纤维化相关蛋白的表达有关,还与调节肠道菌群失调,促生益生菌,进而增加AMPK活性有关。本研究以脂肪组织纤维化和肠道菌群为靶点,为进一步开展小檗碱相关药理需用研究提供了新思路。
