双季铵盐化合物的结构表征与抗菌性能测试
2019-10-22苏长鸣崔本行侯桂革王春华
苏长鸣,崔本行,侯桂革,王春华
(滨州医学院 药学院,山东 烟台 264003)
有害细菌对人和动、植物有极大危害,严重影响人们的健康,甚至危及生命[1-2]。随着人们对生活环境逐渐重视,对于有害细菌的抑制及杀灭要求不断提高。近几年来,涌现出大量新型的季铵盐类杀菌剂,同时也出现了大量的相关市售产品,如十二烷基二甲基苄基氯化铵(洁尔灭)、十二烷基二甲基苄基溴化铵(新洁尔灭)[3]等。长链烷基季铵盐类杀菌剂具有独特的四价氮结构,其亲水的阳离子和疏水的长链[4]与细菌表面结合后,通过改变细菌菌膜的电势致使细菌菌膜破裂,进而达到杀死细菌的目的。该类消毒剂大部分为单季铵盐[5-6],如新洁尔灭是单季铵盐为主要组分的代表类市售产品。然而,近期研究发现,细菌对于单季铵盐的耐受性增高,敏感性下降,使得单季铵盐类产品的使用受到限制。因此,开发双季铵盐杀菌剂具有重要的研究价值[7]。
本课题组长期致力于增强季铵盐的抗菌效果研究,并取得了一定进展[4,8-10]。本研究以二溴丙烷和N,N-二甲基乙醇胺为基本原料,合成了2种具有双季铵基团的季铵盐(QAS-1、QAS-2,图1),通过FTIR、NMR和元素分析表征了两者的结构,并采用二倍稀释法[11-12]测定了抗菌性能。
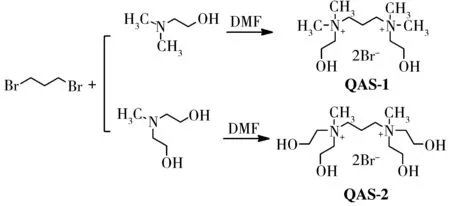
图1 QAS-1和QAS-2的合成路线Fig.1 Synthesis routine of QAS-1 and QAS-2
1 实验部分
1.1 试剂与仪器
无水甲醇、乙醚、N,N-二甲基甲酰胺(DMF)、二甲基亚砜(DMSO)、N-甲基二乙醇胺、1,3-二溴丙烷、N,N-二甲基乙醇胺、醋酸氯己定(CA苯扎氯铵(BZK))均为分析纯,购自国药集团化学试剂有限公司;DF-101S集热式恒温加热磁力搅拌器(郑州长城科工贸有限公司);傅立叶变换红外光谱仪(Perkin-Elmer公司);Bruker Avance 400核磁共振仪(德国Bruker公司);KYC 1102C型双层空气摇床(上海福玛实验设备有限公司);SPX-250B-G型培养箱(上海博讯实业有限公司医疗设备厂)、Vario EL cube元素分析仪(Elementar公司)。
1.2 QAS-1的合成
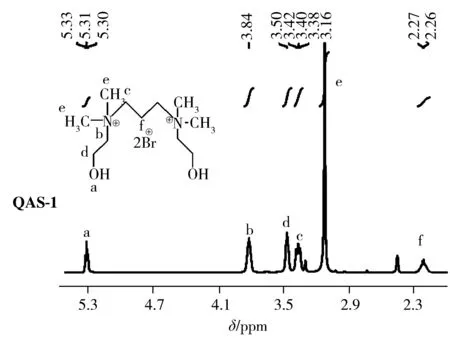
取1,3-二溴丙烷(2.0 g,10.0 mmol)和N,N-二甲基乙醇胺(1.78 g,20.0 mmol)置于装有3 mL DMF的25 mL圆底烧瓶中,薄层分析法(TLC)跟踪检测,60 ℃下搅拌回流反应5 h,无水乙醚沉淀得到粗产物,重结晶得白色固体QAS-1(3.25 g,85%)。熔点:125~128 ℃。IR(cm-1):3 313(br),2 967(m),1 480(m),1 370(m),1 080(s),1 045(s),997(s),938(s),922(s),849(m)。1H NMR(400 MHz,DMSO-D6)δ:5.31(t,J=4.9 Hz,2H,—OH),3.84(t,J=6.2 Hz,4H,—CH2),3.50(t,J=6.2 Hz,4H,—CH2),3.40(t,J=8.3 Hz,4H,—CH2),3.16(s,12H,—CH3),2.27(m,J=4.6 Hz,2H,—CH2)。13C NMR(100 MHz,DMSO-D6)δ:65.42,60.87,55.29,51.64,17.32。Elemental analysis(%) calcd for C11H28Br2N2O2(378.05):C 34.75,H 7.42,N 7.37;Found:C 34.72,H 7.38,N 7.32。
1.3 QAS-2的合成
取1,3-二溴丙烷(2.0 g,10.0 mmol)和N-甲基二乙醇胺(2.14 g,20.0 mmol)置于装有3 mL DMF的25 mL圆底烧瓶中,TLC跟踪检测,60 ℃下搅拌回流反应5 h,无水乙醚沉淀得到粗产物,重结晶得白色固体QAS-2(3.10 g,83%)。熔点:92~95 ℃。IR(cm-1):3 267(br),2 956(m),1 476(m),1 076(s),1 047(s),950(s),897(m)。1H NMR(400 MHz,DMSO-D6)δ:5.30(t,J=4.8 Hz,4H,—OH),3.85(t,J=6.4 Hz,8H,—CH2),3.55(t,J=6.4 Hz,8H,—CH2),3.41(t,J=8.2 Hz,4H,—CH2),3.17(s,6H,—CH3),2.26(m,2H,—CH2)。13C NMR(100 MHz,DMSO-D6)δ:63.63,58.70,54.70,49.31,16.48。Elemental analysis(%) calcd for C13H32Br2N2O4(438.07):C 35.47,H 7.33,N 6.36;Found:C 35.40,H 7.37,N 6.34。
1.4 抗菌活性测试
供试菌株:细菌有金黄色葡萄球菌(S.Aureus(ATCC6538))、大肠杆菌(E.Coli(ATCC25922))、绿脓杆菌(P.Aeruginosa(ATCC9027))、变形杆菌(Proteusvulgaris(CMCC(B)49027));真菌有白色念珠菌(CanidiaAlbicans(ATCC10231)。醋酸氯己定(CA)和苯扎氯铵(BZK)为阳性对照品。
菌液的配制:取复苏后的菌液于EP管中,1 000 r/min下离心5 min,弃去培养液,用磷酸盐缓冲液配成1.0×108、1.0×106CFU/mL的菌液,备用。
样品及对照品溶液的配制:分别取CA、BZK、QAS-1和QAS-2样品25 mg,配制成浓度为2 500、1 600、1 000、500、100 mg·L-1的待测药液。
抑菌圈的测定:取0.1 mL浓度为1.0×108CFU/mL的菌液涂布于培养基中,将高压灭菌后的圆形滤纸片(直径6.0 mm)分别贴在培养基中。设置2 500、1 000、500、100 mg·L-1药液组,每组滴加待测液7 μL,另设置空白对照组,于37 ℃恒温培养箱培养10 h,测定抑菌圈的直径。实验重复3次,结果取平均值。
最低抑菌浓度(MIC)的测定:设置浓度组别为800、400、200、100、50、25、12.5、6.25、3.125 mg·L-1,另设空白对照组,各组试管分别加入0.1 mL浓度为1.0×106CFU/mL菌悬液。各组试管均置于37 ℃培养箱中培养24 h,记录MIC值。
最低杀菌浓度(MBC)的测定:将药品有效抑菌浓度药液0.1 mL移种至培养皿,并置于37 ℃培养箱中培养24 h。记录菌落数,以培养皿中计数少于5个菌落作为最低杀菌浓度(MBC)。
1.5 细胞毒性测试
以QAS-1为代表,采用MTT法测定QAS-1对人正常肝细胞(LO2)和人永生化表皮细胞(HaCat)的细胞毒性。培养细胞至对数生长期,制备细胞悬液,接种于96孔培养板中,每孔200 μL,于37 ℃二氧化碳培养箱中培养12 h,弃培养液,加入100 μL制备好的QAS-1、BZK、CA溶液,继续培养12 h,弃上清液,加入200 μL MTT溶液(10%),于37 ℃孵育4 h后,弃去上清液,加入150 μL DMSO,于570 nm处测定吸光度值,评价QAS-1的细胞毒性[13-14]。
2 结果与讨论
2.1 合成与结构分析
本研究通过一步法分别合成了2种具有双季铵基团的季铵盐(QAS-1和QAS-2),并通过FTIR、NMR和元素分析确证了其结构(图2)。由图可见,QAS-1的1H NMR中,5.31 ppm处的三重峰对应对称羟基上的2个质子,3.84 ppm和3.40 ppm处的峰对应与N相连的亚甲基上的质子,3.50 ppm处对应与—OH连接的亚甲基上的质子,3.16 ppm处的12个氢对应季铵盐中4个甲基的质子,2.27 ppm处的氢对应丙烷中间亚甲基上的质子;在QAS-2的1H NMR中,相同的羟基质子氢在5.30 ppm处,中间桥联丙基的氢分别在3.42 ppm和2.26 ppm,16个亚甲基氢的化学位移在3.85 ppm和3.55 ppm处,6个甲基氢的化学位移在3.17 ppm处。13C NMR显示(图3),51.64 ppm对应与羟基相连的2个亚甲基碳,55.29 ppm则对应4个甲基上的碳原子,65.42 ppm和60.87 ppm对应与氮原子直接相连的亚甲基的2个碳原子,而17.32 ppm对应丙基中间的碳原子;QAS-2的羟乙基中碳的化学位移在63.63、54.70 ppm,桥联丙基碳的化学位移在58.70 ppm和16.48 ppm,甲基碳在49.31 ppm处。另外,红外光谱数据显示,3 313 cm-1和3 267 cm-1处的吸收峰对应官能团—OH的吸收峰。以上结构分析均证实了双季铵盐QAS-1和QAS-2结构的正确性。
该方法操作简便,制备得到的双季铵盐QAS-1和QAS-2,产率均在80%以上。目标产物均为白色固体,极性较大,在石油醚、乙醚、丙酮等非极性或弱极性有机溶剂中不易溶解,易溶于水、甲醇、乙醇、DMF、DMSO。
2.2 抗菌活性分析
2.2.1 药物对菌种的抑菌圈直径本研究采用纸片法测试季铵盐的抗菌性能,所得3次结果取平均值。在100、500、1 000 mg·L-1质量浓度下,QAS-1和QAS-2对大肠杆菌、绿脓杆菌、变形杆菌和白色念珠菌的抑菌圈直径均不超过7.0 mm(表1~2),与阳性对照药(CA、BZK)相比,抑菌圈相对较小,说明QAS-1和QAS-2对革兰氏阴性菌和真菌的抗菌性能较差。在相同浓度条件下,2种季铵盐与空白组相比无显著性差异,且QAS-1、QAS-2的抑菌圈直径大小相近,说明两者对革兰氏阴性菌及真菌的作用效力并无明显差别。但高浓度下,QAS-2对真菌的作用能力强于QAS-1。在质量浓度为100 mg·L-1时,QAS-1和QAS-2对金黄色葡萄球菌的抑菌圈直径分别为7.1、7.5 mm,与CA、BZK活性相当;在质量浓度为500、1 000 mg·L-1时,两者对金黄色葡萄球菌的抑菌圈直径逐渐增大,分别为7.6、8.3 mm(QAS-1)和8.1、9.5 mm(QAS-2),且QAS-2的抑菌圈直径要明显大于QAS-1。显著性分析结果显示,QAS-1、QAS-2对金黄色葡萄球菌作用与空白组相比存在明显差异。总体来看,两者对金黄色葡萄球菌的抑菌圈直径随着药物浓度的增加而增加,具有一定的剂量依赖性,且在低浓度时,两者抑菌能力差别不大,高浓度下QAS-2抑菌能力优于QAS-1。

表1 QAS-1与QAS-2对革兰氏阴性菌的抑菌圈直径Table 1 Diameter of zones of inhibition of Gram-negative bacteria of QAS-1 and QAS-2 d/mm
diameters of zone are expressed as mean ±SD(n=3), compared with the blank group(抑菌直径取平均值±标准偏差(X±S),X为3次结果的平均值,各组同空白组纸片的直径比较);**P<0.01,*P<0.05

表2 QAS-1与QAS-2对革兰氏阳性菌和真菌的抑菌圈直径Table 2 Diameter of zones of inhibition of Gram-positive bacteria and fungus of QAS-1 and QAS-2 d/mm
diameters of zone are expressed as mean ±SD(n=3), compared with the blank group(抑菌直径取平均值±标准偏差(X±S),X为3次结果的平均值,各组同空白组纸片的直径比较);**P<0.01,*P<0.05
2.2.2 药物对菌种的最低抑菌浓度(MIC)最低抑菌浓度(MIC)的测定结果见表3。QAS-2对金黄色葡萄球菌、大肠杆菌、变形杆菌、绿脓杆菌的MIC值均为200 mg·L-1,表现出较弱的抗菌活性。而QAS-2对白色念珠菌的MIC值为50 mg·L-1,表明其对真菌的抑菌效果优于细菌。QAS-1对5种菌株的抑菌活性均较差,其MIC值为100 mg·L-1或200 mg·L-1,但对革兰氏阳性菌即金黄色葡萄球菌的MIC值低于其他的细菌。相比而言,QAS-2对真菌的抑菌活性比QAS-1强,对其余细菌菌株的抗菌活性两者相当。

表3 QAS-1与QAS-2的最低抑菌浓度(MIC)Table 3 Determination of minimal inhibition concentration(MIC) of QAS-1 and QAS-2 ρ/(mg·L-1)
2.2.3 最低杀菌浓度(MBC)最低杀菌浓度(MBC)的测定结果见表4。对于细菌,QAS-1和QAS-2的MBC值为200 mg·L-1或400 mg·L-1,而BZK和CA的MBC值分别为50、25 mg·L-1,说明对细菌而言,QAS-1和QAS-2的杀菌效果弱于BZK和CA。而对于真菌,QAS-1和QAS-2的MBC值均为100 mg·L-1,说明其对真菌的杀菌效果比对细菌好,但比CA和BZK的效果差。该结果与MIC的规律基本一致。QAS-2对革兰氏阴性菌(绿脓杆菌、变形杆菌)的MBC为200 mg·L-1,对革兰氏阳性菌(金黄色葡萄球菌)的MBC值为400 mg·L-1,即QAS-2对革兰氏阴性菌的杀菌效果优于革兰氏阳性菌;2种季铵盐的杀菌能力相当,但QAS-1对大肠杆菌的杀伤能力强于QAS-2。

表4 QAS-1与QAS-2的最低杀菌浓度Table 4 Determination of minimum bactericidal concentration of QAS-1 and QAS-2 ρ/(mg·L-1)
2.2.4 抗菌作用机理研究选取QAS-1为代表药物,研究其对金黄色葡萄球菌的杀菌作用机理。未加入QAS-1的金黄色葡萄球菌扫描电子显微镜(SEM)及透射电子显微镜(TEM)图显示,细菌形态饱满、细胞圆润,具有完整的细胞壁结构(图4A、B)。经QAS-1作用12 h后,细菌形态扭曲,局部发生塌陷,TEM显示细胞壁破裂,胞内物质流出,菌体濒临死亡(图4C、D)。QAS-1的作用时间增加至24 h,发现大量的细菌形态发生皱缩、塌陷(图4E、F),此时的细菌已不具备完整的结构,细菌细胞壁破裂,内容物流出,细菌死亡[12]。这可能是带正电荷的季铵盐吸附在带负电的细菌表面,引起细胞膜破裂,导致细胞质外流,从而达到了杀灭细菌的目的。

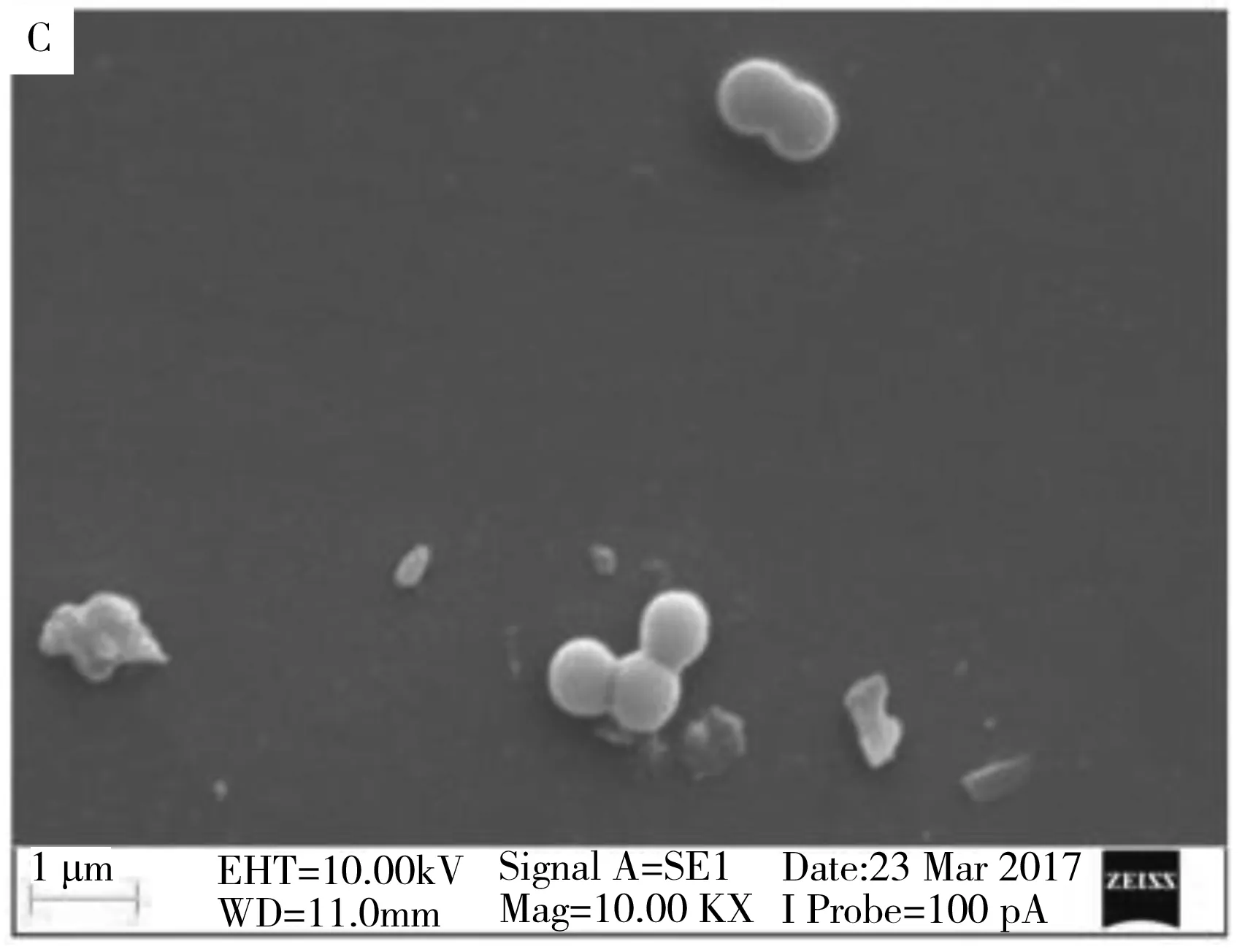
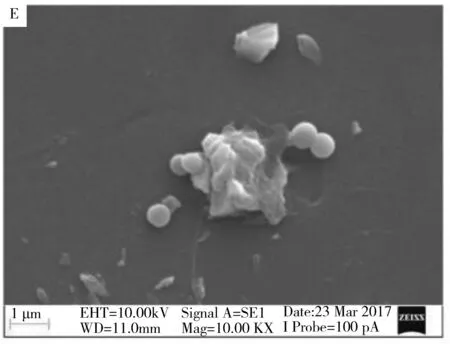

表5 QAS-1对HaCat和LO2的细胞毒性Table 5 Cytotoxicity of QAS-1 toward HaCat and LO2 cells
2.3 细胞毒性分析
本研究采用MTT法测试了QAS-1对人正常肝细胞(LO2)和人永生化表皮细胞(HaCat)的细胞毒性,相应的细胞半数致死量(IC50)值见表5。结果显示,QAS-1对LO2和HaCat的IC50值均高于90 mg·L-1,该数值远大于阳性药BZK、CA的IC50值,表明该季铵盐对LO2和HaCat的细胞毒性显著低于阳性药。BZK、CA为常用消毒剂主要成分,其较强的细胞毒性使得此类消毒剂的应用受到限制。相比而言,QAS-1毒性明显低于阳性药,预示着该类季铵盐在临床使用方面具有潜在价值[15-16]。
3 结 论
本文以二溴丙烷、N,N-二甲基乙醇胺、N-甲基二乙醇胺为原料合成双季铵盐QAS-1和QAS-2,并通过FTIR、NMR和元素分析对其结构进行了表征,测试了2种季铵盐对S.aureus、E.coli、P.Aeruginosa、Proteusvulgaris和CanidiaAlbicans5种菌株的抗菌性能,并通过SEM及TEM研究了该类季铵盐的杀菌作用机理。结果显示,2种双季铵盐对所选菌株均具有一定的抑菌活性,且对真菌的杀菌效果显著优于细菌;作用机理研究显示,该类季铵盐通过作用于细菌细胞壁,破坏细菌细胞壁的完整性,从而达到杀灭细菌的作用。毒性实验显示QAS-1对细胞的杀伤能力明显低于阳性对照组CA和BZK。总体来看,该类季铵盐的合成工艺简单,水溶性和抗菌活性良好,细胞毒性小,在抗菌领域中具有潜在的应用价值,为开发具有高效、低毒的新型抗菌药物提供了实验基础。
