胃癌免疫治疗的研究进展△
2019-10-22张李琛张进萍邹云莲
张李琛,张进萍,邹云莲#
1昆明理工大学医学院基础医学系,昆明650000
2云南省第一人民医院/昆明理工大学附属医院临床基础医学研究所,昆明650000
胃癌起源于胃壁最表层的黏膜上皮细胞,是常见的消化系统恶性肿瘤,也是中国发病率极高的恶性肿瘤。传统的胃癌治疗方法包括根除性手术、放疗和化疗。胃癌起病隐匿,患者确诊时往往已处于晚期阶段,肿瘤细胞已经扩散,无法采用传统的方法进行治疗。2014年,癌症基因组图谱(The Cancer Genome Atlas,TCGA)联合课题组提出了新的胃癌分子分型,包括Epstein-Barr病毒(Epstein-Barr virus,EBV)阳性型、微卫星不稳定(microsatellite instability,MSI)型、基因组稳定型和染色体不稳定型[1],有助于胃癌个体化治疗靶向药物的筛选。近年来,随着对胃癌分子生物学特点的不断认识,新的胃癌治疗方案不断出现,单克隆抗体靶向药物治疗和免疫治疗给胃癌患者带来了希望。肿瘤免疫疗法是应用免疫学原理和方法,激活患者自身的免疫系统,增强患者机体抗肿瘤的免疫应答,从而抑制肿瘤生长的新疗法[2]。目前,针对胃癌的免疫疗法主要包括天然免疫疗法、肿瘤疫苗疗法、过继性免疫疗法、单克隆抗体类免疫检查点抑制剂疗法。
1 天然免疫疗法
天然免疫又称固有免疫,是机体进行免疫应答的基础,是人类生来就具备的一种免疫功能,具有遗传性。天然免疫治疗对多种病原体均能够发挥作用,但是其启动并不需要抗原的刺激,且不针对某一特定的病原体[3]。目前,常用的天然免疫疗法主要为免疫佐剂疗法,其中,细胞因子(cytokine,CK)作为免疫佐剂在临床中的应用最为常见。
免疫佐剂又称非特异性免疫增强剂,是与抗原共同或预先注入机体内能够增强机体对抗原的免疫应答能力或改变免疫应答类型的辅助物质,其本身不具有抗原性[4]。香菇多糖是目前胃癌治疗应用最多的非CK免疫佐剂,其是从优质香菇的子实体中分离得到的多糖,通过刺激免疫细胞成熟、分化和增殖,改善宿主的机体平衡,恢复和提高宿主细胞对淋巴因子、激素和其他生理活性因子的反应性,从而间接地发挥抗肿瘤的作用[5]。研究表明,香菇多糖联合化疗对老年胃癌患者具有较好的治疗效果,能够改善患者血清白细胞介素-2(interleukin-2,IL-2)、白细胞介素-6(interleukin-6,IL-6)水平,提高患者机体的免疫功能和生活质量,具有较高的安全性[6]。
CK是免疫细胞受到抗原、有丝分裂原或其他因子的刺激时所产生的具有生物活性的一类小分子蛋白质的总称,其可以调节机体的免疫功能,促进淋巴细胞的活化、增殖和分化。IL-2是临床常用的CK,它是由多种免疫细胞产生的小分子糖蛋白,主要作用为增强机体对不同抗原的识别能力,增强肿瘤的免疫活性,促进免疫细胞的增殖和分化,诱导生成淋巴因子激活的杀伤(lymphokine-activated killer,LAK)细胞,促进自然杀伤(natural killer,NK)细胞的增殖,增强NK细胞的杀伤力[7]。研究表明,IL-2联合化疗治疗晚期胃癌具有较好的效果[8]。但是,单独应用CK进行治疗可能会产生全身性不良反应,因此,目前,CK多在胃癌的过继性免疫治疗中作为刺激剂辅助使用,主要对促进淋巴细胞的增殖、分化以及改善肿瘤微环境具有辅助作用[9]。
2 肿瘤疫苗疗法
肿瘤疫苗疗法属于主动免疫疗法,通过注射肿瘤抗原激活患者机体的特异性免疫应答,其可以诱导细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)对抗原呈递细胞表面人类白细胞抗原(human leucocyte antigen,HLA)Ⅰ类分子上的肿瘤抗原进行识别,并活化CD4+辅助性T淋巴细胞[10]。肿瘤疫苗主要包括肿瘤细胞疫苗、树突状细胞(dendritic cell,DC)疫苗、多肽疫苗、基因工程疫苗等。幽门螺杆菌(helicobacter pylori,Hp)与胃癌的发生有关,1994年,世界卫生组织(WHO)将Hp列为Ⅰ类致癌因子。Hp疫苗是世界上第一个完成Ⅲ期临床试验的疫苗,即将正式上市。近年来,DC融合疫苗联合CK诱导的杀伤(cytokine-induced killer,CIK)细胞治疗胃癌的研究逐渐兴起,DC融合疫苗与CIK细胞共培养后可以促进CIK细胞的成熟,进而促进胃癌细胞的凋亡,发挥抗肿瘤的效应[11],具有一定的应用前景。近年来,有学者进行了关于“个性化疫苗”的研究,其均是以肿瘤新生抗原为基础进行的,不同的是,一种是使用肿瘤新生抗原所对应的抗原肽作为疫苗[12],一种是使用肿瘤新生抗原所对应的RNA作为疫苗[13]。肿瘤新生抗原是肿瘤细胞在基因变异的基础上产生的具有特异性氨基酸序列变异的蛋白,这种蛋白在无氨基酸序列变异的情况下不具有抗原性,但氨基酸序列一旦发生变异,便会引起一系列的免疫反应[14]。这为胃癌的肿瘤疫苗治疗提供了新的思路。
3 过继性免疫疗法
过继性免疫疗法是指将体外扩增的具有高度特异性的肿瘤杀伤性免疫效应细胞回输至肿瘤患者体内,直接或间接激发机体免疫应答从而杀伤肿瘤细胞,以达到治疗肿瘤的目的。过继性免疫疗法根据其是否具有肿瘤靶向性可分为非特异性过继性免疫疗法和特异性过继性免疫疗法。
3.1 非特异性过继性免疫疗法
传统的过继性免疫疗法如LAK疗法、CIK疗法等为非特异性疗法,因无肿瘤靶向性,无法特异性杀伤肿瘤细胞,因此临床疗效有限。
3.2 特异性过继性免疫疗法
肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte,TIL)疗法是将浸润至肿瘤组织的淋巴细胞进行分离,再通过体外扩增的方式回输至患者体内的一种疗法。由于浸润至肿瘤组织的淋巴细胞具有识别肿瘤的特异性,因此,TIL疗法属于特异性过继性免疫疗法。该疗法对胃癌具有一定的治疗效果。然而,由于TIL的分离与制备均较困难,因此,其临床应用受到了严重的阻碍。近年来,随着T细胞基因工程技术的发展,新型肿瘤特异性过继性免疫疗法取得了里程碑式的研究进展,其中,以嵌合抗原受体T(chimeric antigen receptor T,CART)细胞免疫疗法最具代表性。CART细胞是一种嵌合抗原受体细胞,其通过基因工程技术将能够识别肿瘤特异性抗原的受体表达于T淋巴细胞表面,使T淋巴细胞能够通过单链可变区(single-chain fragment variable,ScFV)识别肿瘤相关抗原(tumor associated antigen,TAA),并通过细胞信号转导激活T淋巴细胞,释放CK,从而发挥抗肿瘤的作用。此外,CART细胞由于不受主要组织相容性复合体(major histocompatibility complex,MHC)的限制,无需抗原呈递细胞呈递肿瘤抗原,使其杀伤肿瘤细胞的活性实现最大化。CART细胞的结构可分为ScFV、铰链区、跨膜区、共刺激区和T淋巴细胞活化区5个部分。因此,CART细胞免疫疗法是通过重新构造载体以提高治疗安全性和有效性的方法[15]。CART技术经过数年的发展已经趋于成熟,首代嵌合抗原受体(chimeric antigen receptor,CAR)无共刺激区,仅有铰链区[16]和T淋巴细胞活化区,无法持续刺激T淋巴细胞的增殖。第二代CAR引入了共刺激区,共刺激分子可激活T淋巴细胞内的c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)、胞外信号调节激酶(extracellular signal-regulated kinase,ERK)、核因子κB(nuclear factor-kappa B,NF-κB)等信号转导通路,不仅可以促进T淋巴细胞的增殖,还可以促进CK的分泌[17-19]。但是,CART细胞在体内的存活时间短,并且对肿瘤细胞的杀伤能力仍然不够。第三代CAR在第二代CAR的基础上将两个共刺激区进行串联,使T淋巴细胞在无外源性共刺激分子的作用下仍可不断增殖,而且共刺激分子可以激活JNK、NF-κB等信号转导通路。但是,CART细胞进入肿瘤微环境后仍然会受到制约,治疗实体瘤的效果较差[20]。第四代CAR是应用编码CAR以及CAR反应性启动子的载体构建CAR,使CAR作为一种载体表达CK,从而产生更好的治疗效果[21],但是CK的毒性很难控制。目前,CART技术已经发展至第五代,第五代CAR是在第四代CAR的基础上整合了一个“开关”[22],仅当T淋巴细胞被激活时才会分泌CK,这样就可以在一定程度上预防CK的毒性。Han等[23]发现,人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)-CART细胞可以明显促进HER2过表达胃癌细胞的凋亡,延长小鼠的存活时间,这为CART应用于人类胃癌的治疗提供了一定的参考依据。除了HER2外,国内外使用上皮细胞黏附分子(epithelial cell adhesion molecule,EPCAM)[24]、癌胚抗原(carcinoembryonic antigen,CEA)[25]、黏蛋白 1(mucin 1,MUC1)[26-27]以及胃癌单克隆抗体MG7[28]等进行了人体临床试验或临床前试验(表1),但是,相比于血液系统肿瘤,单一的CART疗法在胃癌中的疗效有限,这主要与胃癌免疫微环境有关。与传统的治疗方法相比,具有靶向胃癌相关抗原并携载CK的新一代CART疗法和CART联合单克隆抗体等方法均可以改善胃癌的免疫微环境,在临床前研究中显示出更好的抗肿瘤效果。
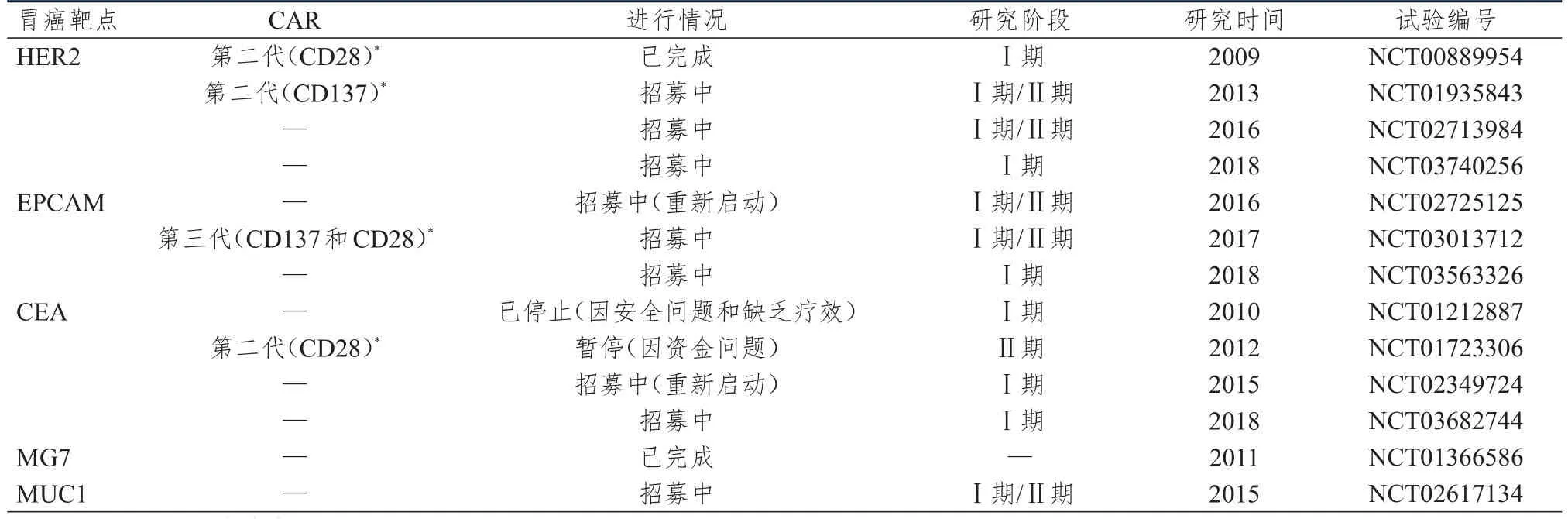
表1 CART细胞免疫疗法治疗胃癌的临床试验研究
4 免疫检查点抑制剂疗法
免疫检查点抑制剂疗法为一种负反馈疗法,主要是利用单克隆抗体进行治疗,单克隆抗体特异性地与相关位点结合,激活T淋巴细胞,进而达到杀伤肿瘤细胞的目的。在众多的免疫检查点抑制剂中,以程序性死亡受体1(programmed cell death 1,PDCD1,也称PD-1)和细胞毒性T淋巴细胞相关蛋白 4(cytotoxic T-lymphocyte associated protein 4,CTLA4)在胃癌中的应用最为广泛且有效。PD1是表达于活化的T淋巴细胞、B淋巴细胞和单核细胞上的一种抑制性受体,可以与程序性死亡受体配体 1(programmed cell death 1 ligand 1,PDCD1LG1,也称PD-L1)和程序性死亡受体配体2(programmed cell death 1 ligand 2,PDCD1LG2,也称PD-L2)结合,其中,PD-L1主要表达于肿瘤细胞表面,PD-L2主要表达于抗原呈递细胞表面,PD-1与PD-L1结合可诱导T淋巴细胞凋亡,进而使肿瘤细胞逃避免疫监视,发生免疫逃逸[29]。例如派姆单抗(Pembrolizumab)是一种具有高度选择性的人源化单克隆抗体,可阻断PD-1与其配体PD-L1结合,阻断负性调控通路,恢复T淋巴细胞的活性,增强机体的抗肿瘤免疫应答。然而在2017年,有研究发现,肿瘤小鼠模型和人类的肿瘤相关巨噬细胞(tumor-associated macrophage,TAM)均可表达PD-1,并且发现PD-1能够抑制的吞噬功能,这意味着PD-1抗体可能通过激活T淋巴细胞和巨噬细胞两种方式向肿瘤发起攻击,这一发现将对肿瘤的PD-1/PD-L1抗体治疗具有重要意义[30]。TCGA团队于2014年提出的胃癌分型中,PD-L1和PD-L2在EBV阳性胃癌中均高表达[1]。因此,采用免疫检查点抑制剂疗法治疗晚期胃癌具有巨大的潜力和可行性。派姆单抗治疗晚期胃癌具有较强的抗肿瘤活性和可控的安全性[32]。由于抗肿瘤效果良好,美国食品药品管理局(FDA)批准派姆单抗用于治疗肿瘤表达PD-L1(联合阳性评分≥10分)的既往接受过两种或两种以上治疗(包括含铂和含氟尿嘧啶的化疗以及HER2/neu靶向治疗)后疾病发生进展的复发性局部晚期或转移性胃或胃食管交界性腺癌。2018年7月,派姆单抗正式在中国上市。
CTLA4也是一种可以对免疫系统进行负调控的调节因子,是第一个应用于临床的T淋巴细胞免疫检查点。T淋巴细胞的活化需要T淋巴细胞表面表达的CD28+分子与抗原呈递细胞所表达的B7分子结合,而CTLA4是T淋巴细胞上的一种跨膜受体,其配体也是B7分子,CTLA4和CD28可竞争结合 B7-1(CD80)和B7-1(CD86)复合物。CD28+与B7复合物结合可促进T淋巴细胞的活化,CTLA4与B7复合物结合可抑制T淋巴细胞的活化[33]。CTLA4单克隆抗体可特异性地与CTLA4分子结合,抑制CTLA4与B7分子的结合,阻断CTLA4通路,激活T淋巴细胞,从而杀伤肿瘤细胞。第一个在胃癌的临床治疗中使用的CTLA4抑制剂为Tremelimumab[34],虽然该疗法的总体疗效较低,但是在使用该药物出现缓解的患者中却显示出了持续的抗肿瘤能力。
5 小结与展望
免疫疗法是21世纪的新型肿瘤治疗方法,首先在黑色素瘤、血液肿瘤的治疗中取得了显著的效果,并在胃癌的临床治疗中显示了巨大的潜力。天然免疫疗法、肿瘤疫苗疗法、过继性免疫疗法、单克隆抗体类免疫检查点抑制剂疗法的广泛应用为晚期胃癌的治疗提供了可能。免疫治疗联合其他治疗仍是胃癌治疗未来的发展方向。但如何最大程度地使患者获益的同时减少不良反应的发生仍然是胃癌免疫治疗领域亟待解决的重要难题。今后应进一步对免疫疗法在胃癌治疗领域中的应用进行深入的研究。
