蜂王浆调节小鼠免疫功能研究
2019-10-22周明良喻建辉余春涛江平屿
周明良,喻建辉,余春涛,江平屿
(江西汪氏蜜蜂园有限公司,江西南昌 330100)
0 引言
蜂王浆是蜜蜂巢中培育幼虫的5~15日青年工蜂咽头腺的分泌物[1],也就是成年蜜蜂采食花粉后,自身分泌出的一种不同于蜂蜜的乳状物质,天然的蜂王浆颜色为乳白色,由于其中成分的高低或者环境差异,有时也会呈现微黄色,此乳状物就像哺乳动物的乳汁,是供给将要变成蜂王的幼虫的食物,营养成分较为复杂,并且极具营养价值和免疫功能,也是蜂王一直都要食用的食物,在保健功能食品上有着极为重要的应用价值,也可以应用于医疗中,是介于食品与药品之间的纯天然保健食品[2]。
蜂王浆成分比较复杂,其中含有维生素A族以及B族物质,另外蛋白质和糖类是其中含量较多的物质,脂类物质液存在蜂王浆中,除去这些大分子物质,还有一些人体需要的氨基酸,在蜂王浆中也有发现。据研究,蜂王浆中含有26种以上的游离氨基酸[3]。10-羟基-α-癸烯酸,是人们较为熟知的王浆酸,生物术语上一般简写成10-HDA。王浆酸是自然界中很稀有的物质,一般来说是蜂王浆中特有的物质,常常代表着蜂王浆品质的优劣。蜂王浆食用营养价值极高,在蜂王浆的总脂肪酸中占有的比例在50%以上,同时还具有抗菌、抗病、抑制癌细胞生长等作用[4]。
许多国内外营养学家对蜂王浆进行了大量的研究认为,蜂王浆是一种可供人类直接食用的、具有高活性成分的超级营养食品。其中,周爱萍等人[5]通过动物试验研究发现,分别经口给予小鼠不同剂量的蜂王浆30 d,能明显增加抗体生成细胞数,高剂量试验中还能提高小鼠NK细胞活性率,表明蜂王浆具有调节小鼠免疫的功能。张敬等人[6]观察蜂王浆冻干粉对小鼠免疫功能影响时发现,蜂王浆冻干粉可以提高小鼠单核巨噬细胞系统和细胞免疫。同时还有研究表明,蜂王浆除了能满足蜂王和幼虫的基本新陈代谢以外,还可以调节身体机能和免疫功能[7-8]。
试验通过采用不同剂量的蜂王浆灌胃小鼠,通过观察其体重的变化,脏器/体重的比值、NK细胞活性率、淋巴细胞转化率、半数溶血值及抗体生成细胞数来研究蜂王浆对小鼠免疫功能的影响。
1 材料和方法
1.1 样品
由江西汪氏蜜蜂园有限公司提供的蜂王浆软胶囊,其中内容物中蜂王浆冻干粉的比例为34%,于4℃下保存,供试验用。
1.2 试验动物及环境
SPF级昆明种雌性小鼠200只,体重18~22 g,由长沙市天勤生物技术有限公司提供,饲料也由该单位提供,试验共分为两大组,每大组有小鼠40只,免疫一组进行NK细胞的活性测定、进行ConA诱导的小鼠淋巴细胞转化试验;免疫二组,进行脏体比值测定、半数溶血值(HC50)的测定和抗体生成细胞数的测定。试验期间,控制环境温度为22~24℃,湿度为50%~56%。
1.3 剂量设计
人体推荐摄入量为3.0 g/日剂量的设计需参考人体,以其每日推荐量来确定,其每日推荐摄入量为3.0 g/日,相对剂量设计来说,也就是0.05 g/(kg·bw),根据该推荐量设置3个剂量组,5倍的低剂量组0.25 g/(kg·bw)、10倍的中剂量组0.5 g/(kg·bw)、30倍的高剂量组 1.5 g/(kg·bw),分别取汪氏牌蜂王浆软胶囊内容物5.0,10.0,30.0 g加植物油定容至200 mL,按0.1 mL/10 g·bw体积给小鼠灌胃,对照组给予相同体积的植物油。每天1次,连续灌胃至少30 d。
1.4 仪器与试剂
动物台秤、分析天平、洁净工作台、二氧化碳培养箱、离心机、722型分光光度计、恒温水浴箱、酶标仪、显微镜等。
无菌手术器械、游标卡尺、微量注射器、细胞计数器、24孔和96孔平底细胞培养板,96孔U型细胞培养板、玻璃平皿、纱布、试管、玻片架、200目筛网、计时器、血色素吸管、载玻片等。
SRBC、生理盐水、Hank's液、RPMI1640培养液、小牛血清、青链霉素、ConA、1%冰醋酸、1 mol/L的HCl溶液、酸性异丙醇、MTT、PBS缓冲液(pH值7.2~7.4)、补体(豚鼠血清)、SA缓冲液、琼脂糖、都氏试纸、YAC-1细胞、乳酸钠、硝基氯化四氮唑、吩嗪二甲酯硫酸盐、氧化型辅酶Ⅰ、0.2 mol/L的Tris-HCl缓冲液、2.5%Triton、印度墨汁、0.1%的碳酸钠、鸡红细胞、甲醇、Giemsa染液等。
1.5 试验方法
1.5.1 脏器/体重比值测定
称量后处死小鼠,取出脾脏和胸腺,在电子分析天平上称量,计算脏器/体重比值。
1.5.2 ConA诱导的小鼠淋巴细胞转化试验(MTT法)
取脾,在无菌环境下,将小鼠的脾脏取出,小平皿中装有适量无菌Hank's液,然后把小鼠的脾脏放入,制成细胞悬液,细胞悬液需要经过筛网过滤,过滤目数在200目即可,离心前需要用Hank's液清洗,清洗次数2~3次。过滤后的细胞悬液还需要经过离心,每次离心10 min(转速1 000 r/min)。细胞悬液是用来活细胞计数,所以需要将处理好的细胞悬液放在1 mL完全培养液中,细胞浓度不宜过高或过低,一般设置在3×106个/mL,此时需要用RPMI1640培养液来对其进行调整,细胞悬液经过调整后要分成2孔加入24孔培养板中,每孔1 mL,在其中一孔加75μL ConA液(相当于7.5μg/mL),另一孔作为对照,设置培养时间为72 h,培养环境中需要5%二氧化碳,控制温度为37℃。培养时,需要注意不能直接等时间结束后取出,在结束前4 h要吸取上清液0.7 mL,用不含小牛血清的RPMI1640培养液0.7 mL进行补充,与此同时还应该加入MTT(5 mg/mL),也就是相当于50μL/孔的量继续培养,时间为4 h。酸性异丙醇要在培养结束后的时候加入,每孔加入1 mL,轻轻吹气搅打混匀,使得紫色结晶的物质完全溶解。溶解后才能分装在培养板中,每个培养板为96孔,每个孔都需要作平行,数目为3个,测定光密度值使用酶标仪,设置570 nm波长。淋巴细胞的增殖能力就可以用光密度值来表示,即用ConA孔的光密度值减去不加ConA孔的光密度值。
1.5.3 抗体生成细胞检测(Jerne改良玻片法)
取羊血,使用生理盐水洗涤,洗涤次数2~3次,之后需要以转速2 000 r/min离心10 min,SRBC需要用生理盐水配成质量分数为20%的细胞悬液,每鼠腹腔注射0.2 mL。4 d后,将小鼠处死、取脾,在无菌环境下将小鼠的脾脏取出,小平皿中装有适量无菌Hank's液,然后把小鼠的脾脏放入,制成细胞悬液,细胞悬液需要经过筛网过滤,过滤目数在200即可,离心前需要用Hank's液清洗,清洗次数2~3次。细胞悬液是用来活细胞计数用,所以需要将处理好的细胞悬液放在8 mL完全培养液中,细胞浓度不宜过高或过低,一般设置在5×106个/mL。表层培养基需要稍微加热使其完全溶解,溶解后、要用2倍浓度的Hank's液与表层培养基等量混合,Hank's液酸碱度应调节为pH值7.4,混合后分装小试管,每管0.5 mL,再向管内加入用SA液配制的10%SRBC 20μL(V/V)、20μL脾细胞悬液 (5×106个/mL),准备好刷有薄层琼脂糖的玻片,快速将悬液混合,混合后倒在玻片上,玻片扣在玻片架上应保持水平,待琼脂糖凝固,放入二氧化碳培养箱中温育,温育时间为1.5 h,然后用SA液稀释的补体,补体比例为(1∶8) 加入到玻片凹槽内,继续温育1.5 h后,计数溶血空斑数来表示抗体生成水平。
1.5.4半数溶血值(HC50)的测定
取羊血,然后使用生理盐水洗涤,洗涤次数2~3次,SRBC需要用生理盐水配成质量分数为2%的细胞悬液,每鼠腹腔注射0.2 mL。4 d后,取血样品放在离心管,方式也略有不同,用摘除眼球的方法,样品血不能立即处理,需要放置1h,血样品会凝固,然后从管壁上取下,血清要分离,以转速2 000 r/min离心10 min,这样血清会分离得比较充分,收集血清。血清需要稀释一定的倍数,以200倍为佳,稀释液用SA,取1 mL置试管内,用SA缓冲液配制10%(V/V) SRBC和补体(1∶8) 分别加入0.5 mL和1 mL。这里的对照管加SA缓冲液。置恒温水浴中保温,温度37℃,时间30 min,保温后要使用冰浴停止反应。以转速2 000 r/min离心10 min,取上清胞100μL搅拌,之后再加入2.5%Triton 100μL,这些孔都需要设置平行孔,一般要设置3个,处理好后放在二氧化碳培养箱中培养4 h,二氧化碳体积分数为5%,培养温度37℃,然后将96孔培养板放在离心机中离心5 min处理,转速设置为1 500 r/min,然后吸取每个孔的上清液100μL,同样也要放在平底96孔的培养板中培养一段时间。除了这个处理,LDH基质液也要及时加入等量的覆盖混匀,由于室温的不同,一般反应3~10 min,每孔加入1 mol/L的HCl 30μL,在酶标仪处测定光密度(OD),测定波长设置为490 nm。

1.6 试验数据统计
1 mL,加都氏试剂3 mL。SRBC用SA缓冲液配制的10%(V/V),使用0.25 mL,空白对照用等量的都氏试剂,分别于波长540 nm处测定各管光密度值。溶血素的量以半数溶血值(HC50)表示,按下式计算:

数据需要经过转化和统计分析,试验中采用Excel,Spss软件进行。用Spss软件分析时,如果方差齐,波动较小,那么单因素方差分析之后,再进行总体比较,发现差异的时候要用Dunnett法对剂量组进行比较。如果方差不齐,对原始数据有适当的转化是正常的,这样使得数据满足方差齐性,用转换后的数据进行统计;如果达不到方差齐,则改用秩和检验进行统计,发现总体比较有差异,采用Tamhane'sT2检验进行两两比较,该方法不要求方差齐性。
1.5.5 NK细胞活性的测定(乳酸脱氢酶测定法)
受试小鼠采用颈椎脱臼的方法处死,将小鼠的脾脏作为观察对象,取脾时要在无菌环境下,将取出的脾脏小心碾碎,制成一定浓度的细胞悬液,并采用Hank's液洗2~3次。经过洗涤后,对悬液进行离心10 min(转速1 000 r/min) 处理,丢弃浮起的上清液,将细胞浆弹起。用灭菌水0.5 mL处理20 s即可,经此方法处理可以裂解红细胞,然后再加入0.5 mL Hank's液及8 mL Hank's液,同样要采用离心的处理,以转速1 000 r/min离心10 min即可。将样品进行重悬处理,小牛血清的RPMI1640完全培养液的质量分数10%,1 mL处理即可,计数前要处理,用1%冰醋酸稀释,计数活细胞采用苔酚蓝染色的方法,(活细胞数达95%以上的样品才可以采用),细胞浓度不宜过高或过低,这里调整为2×107个/mL,得到效应细胞,生长良好的YAC-1细胞才可以用作有效的试验,需经过传代24 h,细胞浓度需要使用RPMI1640完全培养液,调整为4×105个/mL,得到靶细胞;靶细胞和效应细胞都取100μL(由于浓度的不同,所以对应的效靶比为50∶1),取好后混匀加入U型培养板中,培养板使用96孔;靶细胞自然释放,先加靶细胞100μL搅拌,之后再加入培养液100μL混合均匀,靶细胞最大释放孔先加靶细
2 结果与分析
2.1 样品对正常小鼠体重的影响:
表1 免疫一组小鼠体重(±s,g)

表1 免疫一组小鼠体重(±s,g)
组别 动物数/只 初始体重 中期体重 末期体重 增重对照组低剂量组中剂量组高剂量组10 10 10 10 12.68±1.66 13.19±2.06 13.51±1.55 12.44±2.12 19.85±1.25 19.82±1.20 19.81±1.12 19.92±1.24 28.19±1.93 28.00±1.18 28.36±1.99 27.61±2.18 32.53±1.89 33.01±2.27 33.32±2.36 32.36±3.01
表2 免疫二组小鼠体重(±s,g)

表2 免疫二组小鼠体重(±s,g)
组别 动物数/只 初始体重 中期体重 末期体重 增重对照组低剂量组中剂量组高剂量组10 10 10 10 19.64±1.21 19.68±1.18 19.62±1.03 19.71±1.16 27.60±1.98 27.82±1.79 27.57±1.91 28.30±1.89 32.30±2.87 33.05±2.37 32.43±3.56 33.17±2.78 12.66±2.13 13.37±1.74 12.81±2.68 13.46±1.99
由表1,表2可见,各剂量组在体重方面,从试验初期、中期、末期来看与对照组比较,差异性均无显著性 (p>0.05)。
2.2 样品对小鼠免疫器官脏器/体重比值的影响
表3 样品对小鼠免疫器官脏器/体重比值影响(±s,g)

表3 样品对小鼠免疫器官脏器/体重比值影响(±s,g)
组别 动物数/只脾脏/体重/% p值 胸腺/体重/% p值对照组低剂量组中剂量组高剂量组10 10 10 10 0.465±0.079 0.491±0.136 0.528±0.101 0.551±0.121 0.335 0.319±0.064 0.340±0.095 0.361±0.076 0.371±0.074 0.467
由表3可见,样品各剂量对小鼠脾脏/体重比值和胸腺/体重比值无显著影响(p>0.05)。
2.3 样品对小鼠细胞免疫功能的影响
表4 样品对小鼠ConA诱导的淋巴细胞转化能力的影响(±s)

表4 样品对小鼠ConA诱导的淋巴细胞转化能力的影响(±s)
组别 动物数/只加ConA的OD值不加ConA的OD值淋巴细胞增殖能力(OD差值) p值对照组低剂量组中剂量组高剂量组10 10 10 10 0.223±0.020 0.231±0.014 0.218±0.025 0.220±0.014 0.189±0.025 0.190±0.016 0.169±0.037 0.155±0.027 0.035±0.022 0.041±0.023 0.050±0.023 0.065±0.024-0.869 0.333 0.015
由表4可见,样品高剂量组小鼠淋巴细胞转化能力明显高于对照组(p<0.05)。
2.4 样品对体液免疫的影响
2.4.1 样品对小鼠抗体生成细胞数的影响
表5 样品对小鼠抗体生成细胞数的影响(±s)

表5 样品对小鼠抗体生成细胞数的影响(±s)
组别 动物数/只 溶血空斑数(个/106个脾细胞) p值对照组低剂量组中剂量组高剂量组10 10 10 10 120±59 153±72 170±64 206±54-0.511 0.198 0.011
由表5可见,高剂量组小鼠抗体生成细胞数与对照组比较显著提高(p<0.05)
2.4.2样品对小鼠半数溶血数值(HC50)的影响
样品对小鼠半数溶血数值(HC50)的影响(±s) 见表 6。
表6样品对小鼠半数溶血数值(HC50)的影响(±s)

表6样品对小鼠半数溶血数值(HC50)的影响(±s)
组别 动物数/只 半数溶血值 p值对照组低剂量组中剂量组高剂量组10 10 10 10 144.33±25.77 161.08±20.80 171.18±33.59 181.75±34.16-0.440 0.115 0.018
由表6可见,高剂量组小鼠半数溶血数值(HC50)与对照组比较显著提高(p<0.05)。
2.5 样品对小鼠NK细胞活性的影响
表7 样品对小鼠NK细胞活性的影响(±s)
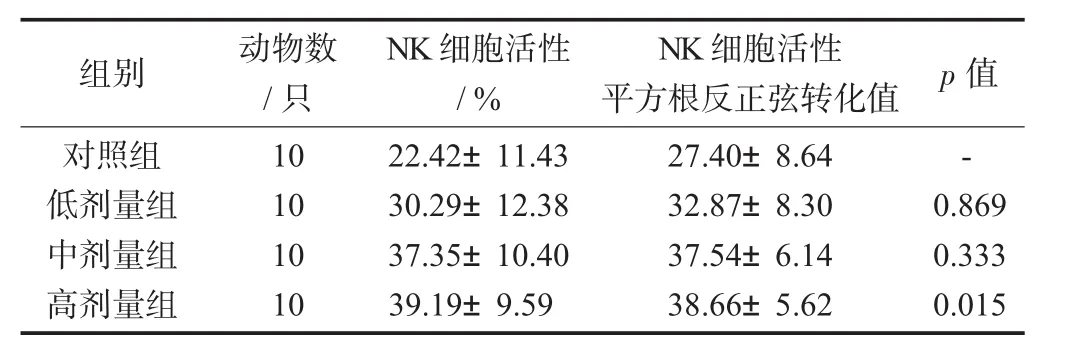
表7 样品对小鼠NK细胞活性的影响(±s)
组别 动物数/只NK细胞活性/%NK细胞活性平方根反正弦转化值 p值对照组低剂量组中剂量组高剂量组10 10 10 10 22.42±11.43 30.29±12.38 37.35±10.40 39.19±9.59 27.40±8.64 32.87±8.30 37.54±6.14 38.66±5.62-0.869 0.333 0.015
由表7可见,中、高剂量组小鼠NK细胞活性与对照组比较显著提高(p<0.05或p<0.01)。
3 结论
在试验条件下,经口灌胃给予小鼠0.25,0.50,1.50 g/(kg·bw) 剂量的汪氏牌蜂王浆软胶囊30 d,与对照组比较0.50,1.50 g/(kg·bw) 剂量能显著提高小鼠NK细胞活性,1.50 g/(kg·bw) 剂量能显著提高小鼠半血溶血值、抗体生成细胞数、淋巴细胞转化能力(p<0.05),各剂量对小鼠体重增长、胸腺/体重比值、脾脏/体重比值均无明显影响(p>0.05)。表明蜂王浆具有增强小鼠免疫力的功能。
综上所述,蜂王浆在对小鼠免疫功能的影响有一定的调节作用,正常小鼠在灌食一定剂量的蜂王浆后,其体重并未发生明显变化,脏器/体重比值也未观察到明显变化。中、高剂量的蜂王浆能明显提高小鼠NK细胞活性,高剂量蜂王浆能明显提高小鼠半血溶血值、抗体生成细胞数、淋巴细胞转化能力。蜂王浆所含营养物质较多,营养成分特别复杂,就目前已有的研究来说,蛋白质是蜂王浆干物质的主要成分,蜂王浆中的蛋白质有12种以上,此外还有许多小肽类物质。蜂王浆中含有很多酶类蛋白质,如胆碱酯酶、超氧化物歧化酶(SOD)、谷胱甘肽酶和碱性磷酸酶等[9]。另外,蜂王浆中还含有许多脂类有机酸,蜂王浆的特征性成分是短链羟基脂肪酸,已检测到的有:10-羟基2-癸烯酸(10-HDA)、癸酸、2-十二碳烯二酸、10-羟基癸酸、3-羟基癸酸、9-十四烯酸、9-十六烯酸、琥珀酸、十三烷酸、棕榈酸、亚油酸、花生酸、月桂酸、亚麻酸等多种游离脂肪酸[10-11],其中10-HDA是蜂王浆中十分重要的物质,是特有的不饱和脂肪酸[12],因其在不同温度、不同保存时间的蜂王浆中含量稳定[13-15],因此成为评价蜂王浆品质的重要指标。由于蜂王浆中营养成分物质太多,具体是哪些组分对免疫功能进行调节仍需要进一步研究。
