牙龈卟啉单胞菌血凝集素黏附结构域ha2基因在大肠杆菌中的融合表达和纯化
2019-10-22曾凤娇刘建国白国辉
曾凤娇,杨 琳,刘建国,田 源,陈 靖,白国辉
(1.遵义医科大学 研究生院,贵州 遵义 563099;2.贵州省普通高等学校口腔疾病研究特色重点实验室,贵州 遵义 563099;3.贵阳市口腔医院,贵州 贵阳 550002)
牙周病是危害人类牙齿及全身健康的主要口腔疾病,发病率高,严重影响着1/3成人以及超过50%的65岁以上老年人的牙齿健康[1]。牙龈卟啉单胞菌(Porphyromonasgingivalis,P.gingivalis)对于慢性牙周病具有明确的致病作用[2],P.gingivalis主要通过其菌体表面的多种毒力因子发生致病作用[3]。
牙龈素是P.gingivalis重要的毒力因子,有研究表明其在细菌逃避免疫防御机制中也发挥了一定的作用[4],对于牙周组织的破坏过程中产生重要的影响。rgpA基因是牙龈素的编码基因之一,其中有一段名为血凝集素黏附结构域(hemagglutinin A,hagA)的功能基因,分别编码HA1、HA2、HA3、HA4结构域。有学者对4个结构域进行功能分析,认为HA2为P.gingivalis的关键区域,能够调控介导细菌凝集并黏附至牙周组织,破坏牙周组织形态[5]。
本文在原核表达质粒pET21a-ha2成功构建的基础上,检测其在大肠杆菌中的表达,并纯化鉴定表达产物,为课题组后期SIgA型抗HA2特异性抗体的检测和疫苗在动物体内的表达检测奠定基础。
1 材料与方法
1.1 材料 原核表达质粒pET21a-ha2、Rosetta感受态细胞由贵州省普通高等学校口腔疾病研究特色重点实验室提供。异丙基-β-D-硫代半乳糖苷(IPTG)、SDS-PAGE凝胶制备试剂盒、BCA蛋白浓度测定试剂盒、Ni-NTA琼脂糖凝胶6FF(索莱宝公司,北京);DNA Marker(BM5000)(Biomed,北京);PageRuler预染蛋白Ladder(thermo,美国)。
1.2 方法
1.2.1ha2 基因片段的菌液PCR鉴定ha2基因片段PCR反应退火温度为58℃,反应产物1%琼脂糖凝胶电泳检测(见表1)。
表1ha2基因引物序列

引物名称引物序列(5'—3')产物大小(bp)HA2 F端5'-GACACGCTAGCGCCACCATGCAGACTTCACGGAAACGTT-3'408HA2 R端5'-GACACCTCGGAGTTAGTTTGGCGCCATTGGCTTCCGTGGAAAG-3'
1.2.2 HA2蛋白的诱导表达 将质粒pET21a-ha2 通过热激活法转化大肠杆菌感受态细胞BL21(Rosetta DE3),取20 μL菌液接种到培养基中过夜培养,菌液PCR挑选阳性克隆,琼脂糖凝胶电泳检测。将阳性克隆菌株继续扩大培养,加入终浓度为0.5 mol/L IPTG诱导,筛选最佳诱导温度25℃/37℃及时长3 h/过夜。SDS-PAGE电泳检测,0.1%考马斯亮蓝室温下染色1 h,考马斯亮蓝脱色液过夜脱色,观察是否有目的蛋白的表达。根据目的蛋白大小观察相应位置的蛋白条带是否有明显增强,选择适合的诱导条件。
1.2.3 HA2蛋白的纯化 菌体过夜诱导培养,收集细菌沉淀,按照1∶20比例加入裂解缓冲液,重悬,冰浴,使用高压均质机破菌,匀浆压力为550~700 bar,直至镜检破菌率达98%以上,离心收集上清及沉淀。HA2包涵体蛋白的大量表达纯化,使用包涵体洗涤剂洗涤包涵体,通过包涵体变性液变性蛋白质,进行包涵体复性,复性样品经Millipore超滤系统,超滤浓缩。纯化蛋白进行SDS-PAGE电泳检测,使用20 mmol/L Tris-HCl透析液去除咪唑,冻干机真空进行蛋白浓缩备用。
1.2.4 HA2纯化蛋白测序鉴定 纯化蛋白由上海捷瑞生物科技有限公司完成测序。
1.2.5 HA2蛋白BCA法测定含量 参照BCA试剂盒说明书,将标准液用PBS梯度稀释,将HA2蛋白用PBS稀释2倍,样本和标准浓度梯度液各20 μL和200 μL BCA工作液加入微孔,反应后酶标仪测定OD562的值。
2 结果
2.1 原核表达质粒pET21a-ha2 菌液PCR结果 pET21a-ha2菌液PCR筛选(见图1),其中菌液1#~6#均显示在408 bp处出现特异性条带,片段大小与预期一致。证明转化子经平板筛选,获得正确含有目的基因的菌液。
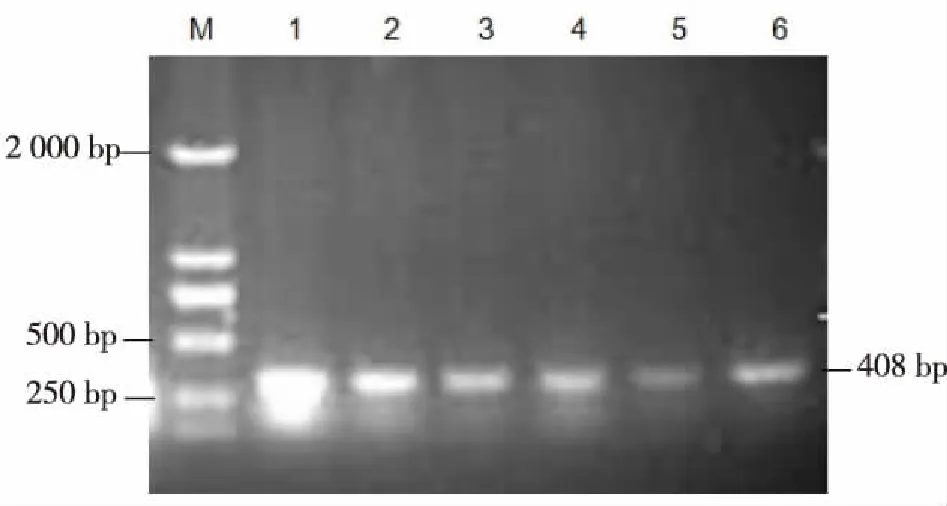
1-6:编号1#-6#的菌液样本。图1 pET21a-ha2菌液PCR
2.2 Rosetta诱导表达结果 HA2蛋白的SDS-PAGE电泳结果见图2:含有质粒pET21a-ha2的Rosetta经IPTG诱导成功表达HA2蛋白(15 kD),与预计目的蛋白大小相同。泳道1为诱导前少量表达,经诱导后目的蛋白大量表达,泳道4较泳道3中表达量多,显示HA2蛋白主要是存在于超声后的沉淀物中,极少数存在于超声液的上清之中,说明该蛋白表达类型主要为包涵体蛋白。温度37 ℃/3 h诱导与25 ℃过夜诱导无明显差别,由于低温情况更加有利于可溶性蛋白的表达,因此认为25 ℃过夜培养可以作为HA2蛋白诱导表达的良好条件。

M : 蛋白质Marker ;1 : 诱导前;2 : 诱导后;3 : 超声后上清液;4 : 超声后沉淀物。图2 Rosetta/pET21a-HA2蛋白诱导表达
2.3 HA2蛋白的纯化
2.3.1 HA2蛋白纯化结果 表达产物经过变性复性过纯化柱,SDS-PAGE电泳显示泳道1在15 kD条带上可见较宽的目的条带,泳道2上清穿透液有近半HA2蛋白未能与凝胶内的His标签结合,可能由于变性复性过程中对于目的蛋白的活性有影响所致。在泳道3、4处出现与目的蛋白大小相同条带,提示HA2蛋白在NTA-20、NTA-50洗脱液中被洗脱;泳道5、6中未见目的蛋白条带,说明NTA-250洗脱液无法将HA2蛋白洗脱(见图3)。
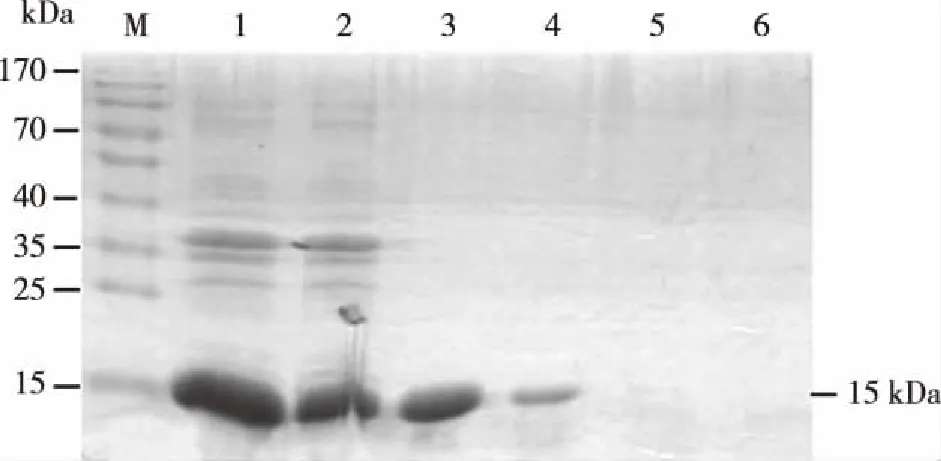
M: 蛋白质分子量Marker;1: 复性后样品;2: 上清穿透液;3: NTA-20洗脱液;4: NTA-50洗脱液;5、6: NTA-250洗脱液。图3 HA2诱导纯化表达
2.3.2 经Ni-NTA层析分离纯化后的目的蛋白 预期蛋白质大小处见纯化后的蛋白为单一条带,大小与预期相同,证明纯化产物中没有杂蛋白(见图4)。
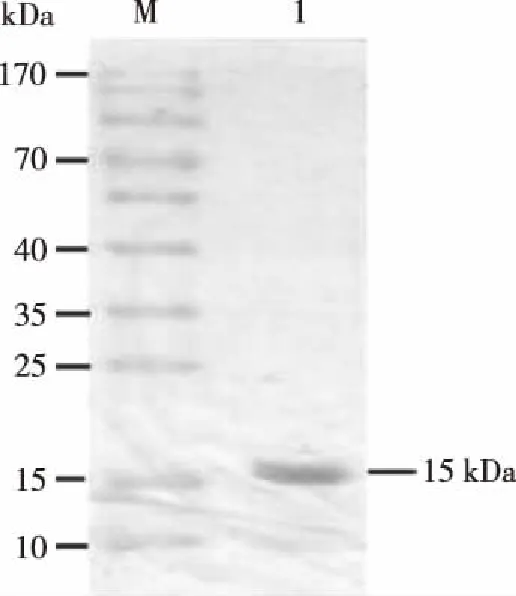
M:蛋白质分子量Marker;1:纯化后HA2蛋白。图4 HA2纯化后蛋白
2.4 HA2蛋白测序 HA2蛋白测序结果经NCBI Protein比对,与W83型P.gingivalis的HagA蛋白序列同源性为99%(见图5)。

图5 纯化的HA2蛋白序列与NCBI Protein数据库比对结果
2.5 HA2纯化蛋白含量测定 用设定的BSA标准溶液浓度梯度,酶标仪测562 nm处吸光光度值,得到线性方程为y=1.108 1x+0.162 4,相关系数R=0.998 9(见图6)。根据测得HA2蛋白OD值为0.3910,计算出HA2蛋白总浓度为0.449 mg/mL。
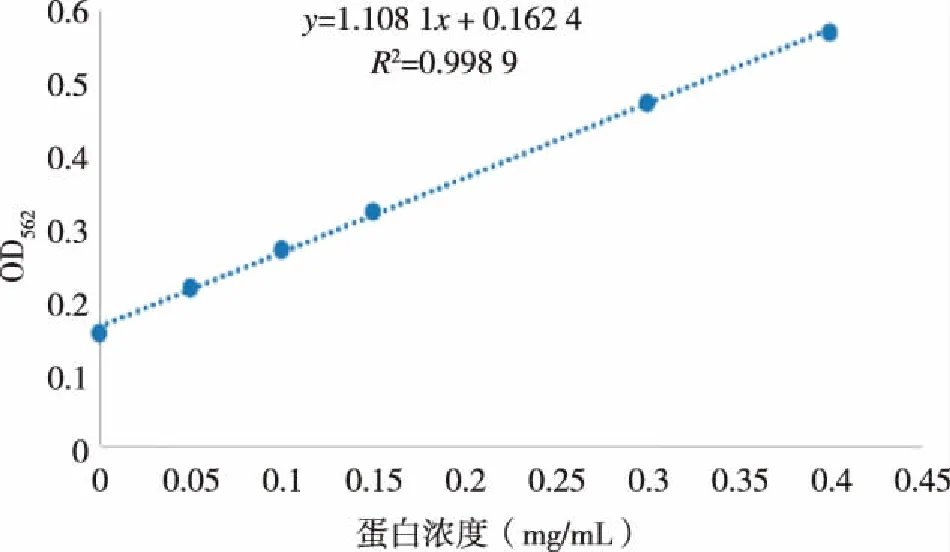
图6 纯化蛋白HA2蛋白含量标准曲线
3 讨论
近几年大肠杆菌表达体系因具有高效表达、培养周期短、成本低、易于纯化以及表达后不会因自身修饰作用影响蛋白生物活性等优点而在生产中被广泛应用[6]。大肠杆菌中表达量较高的蛋白往往会错误折叠而形成包涵体,目前的研究中主要通过以下两种方式来提高蛋白的产量和活性:一是通过改变大肠杆菌的生长条件,使蛋白可溶表达,或者促进重组蛋白与其它蛋白(如折叠酶、分子伴侣等)的融合表达;二是不断优化蛋白复性过程,使包涵体通过体外复性恢复其生物活性。因为易于分离纯化的包涵体中含有重组蛋白,如果能够在体外成功完成复性,就能实现重组蛋白的大量生产。有文献报道,蛋白包涵体的形成与半胱氨酸的存在有关[7-8]。目前包涵体的形成以及复性的机制尚不十分清楚,变复性的操作方法也不具有普遍性。经过大量高效复性的实验总结出了一些规律:例如聚集具有相对特异性,且由链间的疏水相互作用发生,以及折叠中间体可能存在不同的作用等[9]。实验室常用的包涵体变性剂主要有3种:即含N-十二烷基肌氨酸钠缓冲液A溶液、尿素以及盐酸胍,使用TritonX-100和去垢剂也可起到一些溶解包涵体的作用[10]。
ha2基因是牙龈卟啉单胞菌血凝集素黏附结构域关键区域,以ha2基因为目的基因构建相关牙周炎基因疫苗,能够为牙周炎的防治提供一个新方向。本实验中变性液运用EDTA 发挥螯合作用,β-ME打开蛋白间的二硫键,运用Urea溶解蛋白,完成包涵体的变性,在复性液中加入了氧化型和还原型谷胱甘肽,并加入glycerol以防止分子间的碰撞而影响构象,通过超滤的方式复性蛋白,得到了大量纯度较高的包涵体蛋白。在诱导条件中温度是非常重要的条件之一,低温可以降低菌体内蛋白合成速度、繁殖和抑制蛋白酶活性,让重组蛋白有足够的时间形成二硫键并正确折叠,降低包涵体蛋白的生成,同时使可溶性蛋白的表达量得到有效的增高[11-13],因此本实验选择25℃过夜培养作为HA2蛋白的最佳诱导条件。经过对实验条件的优化,pET21a-ha2成功在大肠杆菌中表达,并成功纯化出HA2蛋白,为课题组后期SIgA型抗HA2特异性抗体的检测和疫苗在动物体内的表达检测奠定了基础。
