蛇床子素对APP/PS1小鼠学习记忆功能及脑内Aβ产生的影响
2019-10-22刘义伟李祖高张洋洋石京山
李 菲,刘义伟,李祖高,张洋洋,石京山
(遵义医科大学药理学教研室暨基础药理教育部重点实验室暨特色民族药教育部国际合作联合实验室,贵州 遵义 563099)
阿尔茨海默病(Alzheimer’s disease,AD),老年痴呆的主要类型,是最常见的神经退行性疾病之一,早期临床表现为近期记忆障碍,随着疾病发展,呈现进行性加重的认知障碍,从而困扰着中老年人的身心健康。AD典型的病理特征包括β淀粉样蛋白(β-amyloid,Aβ)沉积、tau蛋白过度磷酸化、特定脑区神经细胞丢失等[1]。其中,Aβ在AD的发生发展过程中起着关键作用,因而,减少脑内Aβ沉积仍是防治AD的重要策略。
蛇床子为伞形科草本植物蛇床的果实,其主要化学成分蛇床子素(osthole,OST)具有抗炎、镇静、抗肿瘤、降血压、抗心律失常、保护神经元等作用[2-6],并能够改善动物记忆损害[7]。为进一步验证OST抗痴呆的作用及机制,本实验采用APP/PS1转基因小鼠观察OST干扰后小鼠的认知功能及行为的改变,并分析OST对AD典型病理特征Aβ的影响。
1 材料与方法
1.1 动物 SPF级APP/PS1雄性转基因小鼠16只,同龄同性别野生型(wild type,WT)小鼠8只,购于江苏集萃药康生物科技有限公司。
1.2 药物与试剂 蛇床子素(纯度99.90%)购于MCE(MedChemExpress),批号:HY-N0054;Aβ1-42、Aβ1-40、APP、ADAM10、BACE1、β-actin抗体购于Abcam公司。
1.3 实验方法
1.3.1 动物分组 WT对照组(WT,n=8)、APP/PS1对照组(APP/PS1,n=8)、APP/PS1+OST给药组(APP/PS1+OST,n=8)。自小鼠9月龄始每天给予OST 10 mg/kg,对照组小鼠给予同等体积的双蒸水,每日灌胃给药1次,连续12周。
1.3.2 筑巢行为实验 进行筑巢行为实验时,小鼠单笼操作,更换新玉米芯颗粒垫料并均匀铺开,加入筑巢用软纸,分别于6、12、24 h观察动物筑巢行为。根据课题组前期实验经验对筑巢评分文献[8]的评分标准进行调整,本实验采用4分法对动物筑巢行为进行评价:1分,没有可见的巢;2分,有不明显的巢,筑巢用纸较散乱,占据空间超过笼子的1/2;3分,中等程度的巢,可见较为明显的巢,筑巢用纸占据空间超过笼子的1/3不足1/2;4分,完整的巢,可见碗状巢,或者筑巢用纸占据空间不超过笼子的1/3。
1.3.3 Morris水迷宫 白色圆形水盆划分为4象限,隐藏平台(水下2 cm)置于第三象限。前4 d行定位航行实验:小鼠头向上面朝盆壁入水,记录小鼠找到隐藏平台的时间,若60 s内未找到则引导其至平台。使小鼠停留于平台10 s。每只小鼠每天训练3次,每次从不同象限入水(除平台所在的第三象限),训练间隔1 h。第5天为空间探索:移除平台,允许小鼠自由游泳60 s,记录小鼠在原平台所在象限的停留时间及穿越原平台位置的次数。最后通过系统记录的相应指标,进行数据处理分析。
1.3.4 形态学观察 小鼠深度麻醉后透心灌注取脑组织进行石蜡包埋,行冠状面连续切成5 μm的切片,进行Nissl染色。光学显微镜观察海马CA3及DG区神经元形态及数量;每张切片计数3个不同视野的神经元。
1.3.5 Western blot检测 提取小鼠海马组织总蛋白,SDS-PAGE胶分离蛋白后转移至PVDF膜,5%的脱脂奶室温封闭90 min后用Aβ1-42、Aβ1-40、APP、ADAM10、BACE1、β-actin抗体(1∶2 000)置于4 ℃冷库孵育12 h,再用相应的HRP标记的二抗(1∶5 000)室温孵育2 h,经ECL反应,最后采用Quantity One 全自动凝胶成像分析系统进行曝光显影,并以β-actin为内参对目的条带灰度值进行分析。
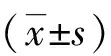
2 结果
2.1 OST对APP/PS1小鼠筑巢行为的影响 给药期间每月观察1次小鼠筑巢行为,每次观察3个时间点:6、12、24 h。最后1次筑巢行为结果如图1所示,APP/PS1小鼠与WT小鼠相比筑巢行为略微变差,给予OST灌胃后小鼠筑巢行为有所改善,可见较为完整的巢穴,但筑巢行为评分在各组小鼠间的差异没有统计学意义。

图1 OST对APP/PS1小鼠筑巢行为的影响
2.2 OST对APP/PS1小鼠学习记忆功能的影响 结果如图2所示:定位航行试验中各组小鼠随着训练次数的增加,找到平台所需要时间逐渐缩短。训练至第4天,APP/PS1对照组小鼠逃避潜伏期明显长于WT对照组小鼠(P<0.05),给予OST后,逃避潜伏期显著缩短(P<0.05,见图2A)。第5天的空间探索实验结果(见图2B)显示,APP/PS1对照组小鼠在目标象限停留时间百分比明显低于WT对照组小鼠,给予OST则明显改善。

A:定位航行成绩;B:空间探索成绩;n=8,#:P<0.05,##:P<0.01 vs WT;*:P<0.05 vs APP/PS1。图2 OST对APP/PS1小鼠空间学习记忆功能的影
2.3 OST对小鼠海马神经元形态及数量的影响 结果如图3所示:WT对照组小鼠海马CA3及DG区神经元形态结构完好、排列紧密整齐;APP/PS1小鼠神经元结构损坏、排列松散且紊乱;给予OST后使神经元形态得以改善。对各组小鼠海马CA3及DG区域存活神经元进行量化分析发现,APP/PS1小鼠存活神经元数量明显减少(P<0.01),给予OST后明显的抑制了神经元的丢失(P<0.05)。
2.4 OST对小鼠海马组织Aβ的影响
2.4.1 OST对小鼠海马组织Aβ含量的影响 Western blot法检测小鼠海马组织中Aβ含量,结果(见图4)显示APP/PS1对照组小鼠海马组织Aβ1-40及Aβ1-42含量明显高于WT小鼠(P<0.01),而OST则明显降低Aβ1-40及Aβ1-42的含量(P<0.01)。

上图:尼氏染色代表图;下图:海马CA3和DG区神经元数量统计图;n=4,##:P<0.01 vs WT;*:P<0.05 vs APP/PS1。图3 OST对APP/PS1小鼠海马CA3和DG区神经元形态及数量的影响

Aβ1-40和Aβ1-42蛋白的代表性条带及其灰度值分析结果;n=4,##:P<0.01 vs WT;**:P<0.01 vs APP/PS1。图4 OST对小鼠海马组织Aβ含量的影响
2.4.2 OST对小鼠海马组织Aβ产生的影响 Aβ主要由APP经酶切途径产生,本实验观察了APP的含量及其淀粉样剪切途径的限速酶BACE1及非淀粉样剪切途径的关键酶ADAM10的蛋白表达水平。结果(见图5)显示,与WT小鼠相比,APP/PS1小鼠海马组织APP、BACE1蛋白水平明显增加,而ADAM10却明显降低(P<0.01);经OST治疗后明显降低APP、BACE1蛋白水平,增加ADAM10的蛋白表达(P<0.01)。

APP、BACE1和ADAM10蛋白表达水平的代表性条带及其灰度值分析结果;n=4,#:P<0.05,##:P<0.01 vs WT;*:P<0.05,**:P<0.01 vs APP/PS1。图5 OST对小鼠海马组织APP含量及其剪切途径的影响
3 讨论
本实验APP/PS1小鼠至12月龄时出现明显的学习记忆功能减退、海马神经元数量丢失及海马组织Aβ增多等特征。自9月龄始给予OST 10 mg/kg体重连续12周后,明显改善了APP/PS1小鼠认知功能的缺陷,预实验采用OST 5、10和20 mg/kg灌胃小鼠,发现OST 10和20 mg/kg时动物的一般表现较为正常,考虑的老龄APP/PS1小鼠的珍贵性,本实验仅选用了OST 10 mg/kg这一有效量进行OST作用的分析。给予OST后APP/PS1小鼠行为改变表现为Morris水迷宫定位航行实验OST小鼠找到平台所需的时间减少;空间探索实验结果显示OST小鼠在原平台所在项目的停留时间百分比及跨越原平台位置的次数明显增加,说明OST具有抗AD的作用,与文献报道一致[7]。小鼠筑巢行为受多个脑区的共同调节,集体筑巢行为反映小鼠的社交行为,而个体筑巢行为反映小鼠与情景记忆相关的执行功能及其他的非认知功能。AD小鼠脑内因Aβ的沉积破坏了多脑区的功能可能会出现筑巢行为的异常,本实验结果显示12月龄APP/PS1小鼠筑巢功能评分有下降趋势,但与同龄野生型小鼠相比没有统计学差异。既往有研究报道[9]Tg2576小鼠(一种AD模式小鼠)个体筑巢行为至12月龄时没有明显的改变,但集体筑巢行为受到损伤。个体筑巢行为的影响因素比集体筑巢行为复杂,涉及小鼠的基因背景、生长及饲养环境、筑巢材料及实验方法等均会不同程度的影响小鼠的个体筑巢行为。加之本实验采用动物数量的限制,每组仅8只小鼠,可能样本量不足也是原因之一,另外本实验仅观察了小鼠个体筑巢行为,这样导致筑巢行为部分相关信息被掩盖。当然还有其他可能的关键因素,并未从本实验中获知。
AD 脑内呈现明显的海马组织神经元缺失[10-11]。尼氏小体是神经元胞体和树突内的一种特征性结构,当神经元受到损伤时,尼氏小体数量减少,形态改变,甚至溶解,Nissl染色呈蓝色团块或颗粒状,以此特征性观察神经元形态并判断存活神经元的数量。本结果显示APP/PS1小鼠海马神经元数量显著减少且形态萎缩、排列紊乱,而OST改善了海马神经元的形态,存活的神经元数量多于APP/PS1小鼠。
Aβ在细胞外异常增加并沉积成老年斑是AD的特征性病理变化[10-11],而Aβ的产生主要是由APP 经淀粉样途径剪切而成,其中Aβ1-42及Aβ1-40易于在脑内聚集,引发神经细胞毒性[12]。脑内异常增多的Aβ导致神经元受损丢失,且损伤程度与Aβ含量密切相关[13]。本实验中,12月龄的APP/PS1小鼠与野生型小鼠相比,海马组织Aβ1-42及Aβ1-40含量均增加,与文献报道一致[14-15]。而OST有效地减少了APP/PS1小鼠海马组织的Aβ负担。APP经淀粉样剪切途径的限速酶BACEI和γ-分泌酶剪切后,产生具有神经毒性的Aβ。本实验结果显示APP/PS1小鼠海马组织不仅APP蛋白水平增加,BACEI蛋白表达水平也显著增加,给予OST后,降低了APP和BACEI蛋白表达,提示OST降低Aβ的含量与减少其产生有关。最近报道显示,OST明显降低APP的蛋白水平,并认为与OST上调miRNA-101a-3p从而导致APP的mRNA下降有关[16]。ADAM10属于解聚素和金属蛋白酶家族,具有促进胚胎大脑发育和海马神经再生的作用。ADAM10剪切APP不产生神经毒性的Aβ。且ADAM10蛋白表达的减少与AD密切相关,说明ADAM10在AD病理过程中起着重要的作用[15]。本实验APP/PS1小鼠海马组织ADAM10蛋白表达较同月龄的野生型小鼠少,给予OST后增加了ADAM10的蛋白表达。这些结果提示OST可能通过减少APP的蛋白水平,增加APP的非淀粉样途径剪切,减少APP的淀粉样途径剪切,从而减少AD小鼠海马组织Aβ的含量。当然,对于AD另一特征性病理变化tau蛋白的高度磷酸化,也有报道显示OST能够降低AD模型小鼠脑内tau蛋白的磷酸化水平[17]。
综上所述,OST具有改善AD小鼠学习记忆障碍的作用,并对AD特征性病理改变也具有明显的减轻作用。综合文献报道和本次实验结果,提示OST有望成为防治AD的候选化合物。
