自组装短肽水凝胶RADA16-I在卵巢癌细胞培养中的应用研究
2019-10-22高露瑶蔡国徽敖弟书
高露瑶,蔡国徽,敖弟书,宋 鸿
(遵义医科大学 微生物学教研室,贵州 遵义 563099)
近年来用于细胞三维培养的支架材料得到了迅速发展,一些生物聚合材料(PLLA、PLGA、PLLA-PLGA共聚物)及生物材料(胶原、藻酸盐、琼脂糖等)在细胞培养中得到了广泛应用[1-2]。然而,理想的细胞支架材料必须有明确的组份及其适合细胞生长的孔隙率,就此而言,离子型纳米自组装短肽的成份纯净、性能稳定、无免疫原性且降解产物无毒,并具有较好的生物相容性及能自组装形成纳米级纤维网络结构等特点,被视为理想的细胞培养基质材料[3-5]。
目前,卵巢癌的病死率高居妇科恶性肿瘤的首位,然而对卵巢癌的发病机理至今尚不明确[6],限制了临床对卵巢癌的诊治,因此建立能模拟体内卵巢癌细胞生长特点的培养模型,将促进对卵巢癌发病机理的了解,同时也有利于临床药物的研发和筛选。本文拟构建卵巢癌细胞A2780纳米自组装短肽水凝胶三维培养模型,为探索理想的卵巢癌体外实验模型提供实验依据。
1 材料与方法
1.1 实验材料与仪器 人卵巢癌细胞系A2780购自南京赛博生物科技有限公司;RADA16-I([COCH3]-RADARADARADARADA-[CONH2])由上海波泰生物科技有限公司合成;Matrigel、I型胶原(Collagen I)购自美国BD公司;RPMI-1640培养基、胎牛血清购自美国Gibco公司;DNA荧光定量检测试剂盒、钙黄绿素AM、鬼笔环肽、DAPI均购自美国Sigma公司;活性氧检测试剂盒购自碧云天生物技术研究所;其余抗体均购自英国Abcam公司。
CO2培养箱(3131型,美国Thermo公司);荧光分光光度计(3001-1913型,美国Thermo公司);荧光倒置荧光显微镜(IX71型,日本Olympus公司);透射电镜(H-7650型,日本Hitachi公司)。
1.2 方法
1.2.1 透射电镜的观察 用0.01 mol/L PBS(pH=7.4)分别配制0.1 mg/mL RADA16-I、0.5 mg/mL Matrigel及0.06 mg/mL Collagen I,滴于透射电镜专用铜格上,用1%磷钨酸进行负染,室温晾干后透射电镜观察。
1.2.2 细胞粘附试验 参照文献[7]包被和水化基底膜,调整细胞密度为1×105/mL,分别将100 μL细胞悬液接种于包被BSA、纤维连接蛋白(fibronectin,FN)、RADA16-I、Collagen I和Matrigel的96孔培养板中,37 ℃常规培养1 h后,吸弃培养液,每孔加入10 μL MTT(5g/mL)试剂及100 μL培养液,37 ℃避光孵育4 h,吸弃培养液,每孔加入150 μL DMSO溶液,震荡后于492 nm波长处测各孔吸收光度值,按照公式:细胞粘附率(%)=(待测细胞OD-空白OD)/(对照细胞OD-空白OD)×100%,计算粘附率。
1.2.3 细胞培养 用0.25%胰酶消化获取细胞。将细胞分别与RADA16-I、Matrigel、Collagen I混合,3种支架材料终浓度分别为5、5、1.5 mg/mL,细胞终密度为1×106/mL。接种于RADA16-I中的细胞需用10%蔗糖洗涤1次,然后与RADA16-I水溶液混合,接种于培养板后,立即加入培养液,以促进RADA16-I发生自组装形成水凝胶,2 h后换液1次。其余两种材料与细胞混合后,需放置37 ℃培养箱2 h,再加入培养基。所有细胞置于37 ℃、5%CO2及饱和湿度常规培养,隔天换液。
1.2.4 细胞活性观察 取培养第3天的细胞-凝胶团,PBS洗涤3次,用4%多聚甲醛室温固定15 min后,再用PBS洗3次,加入 0.3%Triton X-100室温放置5 min,PBS洗3次,加入2 μmol/L的钙黄绿素AM至完全淹没凝胶,避光孵育45 min,PBS漂洗3次,荧光显微镜下观察细胞活性。
1.2.5 细胞形态观察 取培养第6天的细胞-凝胶团,PBS洗涤3次,用4%多聚甲醛室温固定15 min后,再用PBS洗3次,加入 0.3%Triton X-100室温放置5 min,PBS洗3次,加入8.3 μg/mL鬼笔环肽与细胞凝胶团室温作用20 min,PBS洗3次,加入2.5 μg/mL DAPI室温作用10 min,PBS漂洗3次,荧光显微镜观察拍照。
1.2.6 细胞DNA量的测定 取培养第3、6、9天的细胞-凝胶团,PBS洗涤后置于柠檬酸盐缓冲液中,-80 ℃储存。实验前反复冻融并振荡直至细胞完全溶解。按照试剂盒说明书操作,并以不同细胞密度所测得DNA含量制作细胞密度与DNA之间的校正曲线。
1.2.7 细胞粘附分子表达检测 细胞培养至第6天,4%多聚甲醛固定细胞-凝胶团,乙醇梯度脱水后进行石蜡包埋、切片(5 μm)。切片常规脱蜡水化,3%过氧化氢室温下孵育10 min以阻断内源性过氧化物酶活性,pH 6.0柠檬酸盐缓冲液微波加热10 min,自然冷却。2% BSA室温封闭60 min,阻断非特异性抗原,滴加E-cadherin(1∶500)、N-cadherin(1∶400)和Integrin-β1(1∶250)一抗工作液4℃过夜。16 h后取出,37 ℃复温30 min,滴加HRP标记山羊抗兔二抗(1∶50)工作液,37 ℃孵育60 min,DAB显色,苏木素复染,分化返蓝,乙醇梯度脱水,二甲苯透明,晾干后中性树胶封片,观察拍照。
1.2.8 ELISA检测细胞相关因子 细胞培养至第4天时,无血清培养基漂洗1次,更换完全培养液继续培养至第6天,收集上清,离心分装,-20℃储存。按照试剂说明书对细胞相关因子(VEGFA、EGF、FGF2、IGF1)进行检测,每个样本3个复孔。
1.2.9 细胞氧活性检测 细胞培养至第8天,按照试剂盒说明书加入10 μmol/L DCFH-DA至完全淹没凝胶,37 ℃孵育20 min,无血清细胞培养液洗涤3次,荧光显微镜观察拍照。
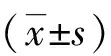
2 结果
2.1 透射电镜表征细胞支架材料的结构特征 透射电镜下可见RADA16-I、Matrigel和Collagen I呈长短不一的纤维状态,并且各纤维交错形成网络结构,与Collagen I和Matrigel相比较,RADA16-I所形成的纳米纤维较长,所形成的纤维网架结构也较密集(见图1)。

图1 透射电镜下细胞支架材料的结构特征观察
2.2 细胞对不同支架基质的粘附率 从图2可见,细胞对RADA16-I的粘附率相似于Matrigel及Collagen I(P>0.05),而均高于FN(P<0.05)。这说明化学合成的RADA16-Ⅰ与动物来源的基质材料相似,也有助于细胞的粘附,为后续纳米自组装短肽水凝胶中卵巢癌细胞生物学性状的研究奠定了基础。
2.3 细胞在不同支架材料上的形态及活力观察 细胞与支架材料混合后培养,在倒置显微镜下每天观察细胞生长情况。培养第1天可见细胞定植在支架材料凝胶中的不同层面上,细胞分布均匀,呈球形。培养第3天可见局部有小细胞团形成,并且细胞团随培养时间延长而增大,在整个培养过程中凝胶内细胞始终保持球形样外观(见图3A)。
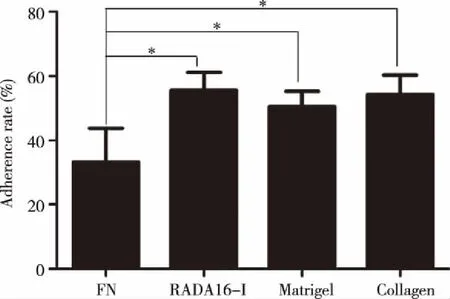
图2 不同支架材料对A2780细胞的粘附率
通过钙黄绿素-AM染色了解细胞在不同支架材料中的活性,可见细胞在各支架材料中分布均匀,且活性较好(见图3B)。鬼笔环肽/DAPI复染结果显示,细胞在RADA16-I和Matrigel中均呈不规则球形聚集,细胞核呈无规则排列,其中RADA16-I中有部分细胞向外伸展,而在Collagen I中细胞核聚集成梭形(见图3C),提示细胞基质对细胞的形态形成有一定影响。
A:培养第3天的细胞生长情况;B:培养第3天的细胞钙黄绿素-AM染色;C:培养第6天的细胞鬼笔环肽/DAPI复染,×200。图3 A2780细胞在不同细胞支架材料中显微镜观察结果
2.4 细胞在不同支架材料上的增殖情况 通过测定第3、6、9天不同支架材料中培养细胞的DNA量,了解细胞在3种不同支架材料中的增殖情况。由图4可见,卵巢癌细胞A2780在3种支架材料中均保持一定的生长速率,Matrigel和Collagen I中的细胞始终保持快速增殖,特别是Matrigel中细胞DNA量始终保持最高增长率,而RADA16-I中的细胞虽保持活跃增殖,但不及在Matrigel和Collagen I中增殖速度快。

图4 A2780细胞在不同细胞支架材料中的增殖情况
2.5 不同三维体系中粘附分子表达情况 通过免疫组织化学法分析3种支架材料中细胞相关粘附分子的表达情况,研究结果显示,细胞培养至第8天时,在RADA16-I中,整合素β1、E-钙黏蛋白、N-钙黏蛋白的表达均为阳性。在3种材料中,整合素β1在Matrigel中表达最高,Collagen-I次之,RADA16-I最少(见图5A),而E-钙黏蛋白、N-钙黏蛋白在Collagen-I中表达最高,Matrigel次之,RADA16-I最少(见图5B、C)。

A:整合素β1;B:E-钙黏蛋白;C:N-钙黏蛋白。图5 A2780细胞在不同细胞支架材料中粘附分子表达情况(×200)
2.6 不同三维体系中细胞相关因子表达水平 通过ELISA法检测3种材料中细胞相关因子(VEGFA、EGF、FGF2、IGF1)的分泌情况,结果显示:在3种培养体系中,4种血管生成因子均有分泌,其中在RADA16-I三维培养体系中,FGF2的分泌水平与Matrigel和Collagen I相比差异无统计学意义(见图6C),但IGF1的表达水平均高于Matrigel和Collagen I(P<0.05),EGF高于Matrigel培养体系(P<0.05),而VEGFA的分泌与之相反,均低于另外两种培养体系(见图6A、B、D)。
2.7 不同细胞支架内细胞氧活性的检测 通过活性氧检测支架中细胞内氧活性情况发现,培养过程中RADA16-I中的细胞与Matrigel和Collagen I中的细胞氧活性近似,均显示良好(见图7)。此外,实验中还发现随着细胞团增大,位于支架中央的细胞氧活性逐渐减弱。

A:VEGFA;B:EGF;C:FGF2;D:IGF1。图6 不同支架材料中细胞相关因子表达水平

图7 A2780细胞在不同细胞支架材料中培养第8天的细胞内活性氧情况(×200)
3 讨论
RADA16-I是纳米自组装短肽生物合成材料中具有代表性的短肽,由极性和非极性氨基酸(精氨酸—丙氨酸—天冬氨酸—丙氨酸)交替排列组成,根据分子亲水面上带“正”电或“负”电氨基酸残基的排列顺序,电荷分布类型为+-+-。当其溶于去离子水时,可形成极强的β片层二级结构,加入电解质溶液时,会导致自组装快速发生,促使这些β片层结构形成具有5~200 nm大小孔隙的含水量>99%纳米级三维网孔结构。本研究在透射电镜下可见RADA16-I在PBS溶液作用下发生自组装,与Matrigel和Collagen Ⅰ两种温敏型水凝胶相比,RADA16-I的纤维较长且形成密集的网孔结构,这种结构类似于高分子聚合物载体,允许一些小分子物质、代谢产物、气体、营养物质及生长因子缓慢扩散[8-10]。此外,RADA16-I成胶因受离子影响,相比温敏型水凝胶在实验操作上更易控制,且易塑形。
在体内,细胞外基质(extracellular matrice, ECM)构成复杂的网络结构,支持并连接于组织,调节组织的发生和细胞的生理功能。Matrigel和Collagen Ⅰ是常用的天然生物材料,富含构成ECM的组分,有利于肿瘤细胞的生长。RADA16-Ⅰ为化学合成材料,但是其序列设计类似于细胞膜上整合素的配体结合位点RGD多肽序列,这有利于细胞黏附。本研究显示A2780细胞在RADA16-Ⅰ材料中活性较好,能形成细胞微球体,这种生长方式类似于卵巢癌细胞在体内聚集形成的实体瘤,说明RADA16-Ⅰ能为A2780细胞提供类似于天然生物材料的微环境。
粘附是肿瘤细胞侵袭的始动步骤,细胞粘附分子与肿瘤的发生、发展、转移及耐药性等都有着密切的关系[11-12]。A2780细胞在RADA16-Ⅰ材料中生长时,既有较好的氧活性,又能维持细胞粘附分子(整合素β1、E-钙黏蛋白、N-钙黏蛋白)和细胞相关因子(VEGFA、EGF、FGF2、IGF1)的分泌与表达,这说明该三维材料能较好地维持肿瘤细胞生物学行为的稳定,适合用于卵巢癌相关机制的研究。本研究中发现,在RADA16-Ⅰ材料中A2780细胞增殖较Matrigel和Collagen Ⅰ慢,分析原因可能是由于Matrigel和Collagen Ⅰ来源于动物,通常不可避免的含有残留的生长因子或不明组分的其他杂质,而RADA16-Ⅰ是人工合成的生物材料,其成份清楚单一,不含有任何不确定的能促进肿瘤细胞生长的生物因子,其培养体系更利于体外培养分析细胞生物学特征和肿瘤相关机制的研究。
综上所述,纳米自组装短肽RADA16-Ⅰ在离子作用下能够自组装形成纳米级纤维网络,该支架材料适合A2780细胞体外三维培养研究。此外,基于自组装短肽基本结构单位易于设计和修改的特性,下一步还可以根据卵巢癌细胞的特征,通过改变氨基酸序列、带电性质及与特殊功能的配基结合等方法,为卵巢癌细胞量身打造支架材料,提供近似于体内生长的微环境。
