代谢组学技术在兽药违规使用监测中的应用及研究进展
2019-10-21郭旭茜韩雪李研东蔡英华于雷康牧旭艾连峰
郭旭茜 韩雪 李研东 蔡英华 于雷 康牧旭 艾连峰
摘 要:兽药残留分析检测技术的开发与创新是动物源性食品安全监测的重要研究内容。作为系统生物学的重要组成部分,代谢组学研究及其检测技术在动物源性食品安全领域发挥了不可或缺的作用。基于当前代谢组学技术在兽药残留检测领域的研究成果,阐述了代谢组学的概念、原理与分类;以“瘦肉精”和类固醇两类违禁兽药残留检测为例,简述了液相色谱串联质谱法(liquid chromatography-tandem mass spectrometry, LC-MS)、气相色谱串联质谱法(gas chromatography-tandem mass spectrometry, GC-MS)等代谢组学常用检测技术对动物血液、尿液等生物样本进行残留分析检测的应用现状,分析了非靶向代谢组学与靶向代谢组学存在的精确度差与通量低等问题,以及代谢组学技术对大型仪器设备与专业数据库过度依赖的局限性;进一步提出了代谢组学技术在兽药残留检测的应用中应根据样品特点及检测目的,将多技术平台(液相色谱-电喷雾飞行质谱、超高效液相色谱-四级杆飞行时间质谱)、分析平台(主成分分析、偏最小二乘判别分析)与多组学技术(基因组学、转录组学、蛋白组学)联合使用以提高代谢组学技术在兽药残留检测领域的适用性与应用范围,为兽药残留分析检测提供新的研究方向。
关键词:食品检验学;代谢组学;兽药残留;食品安全;检测
中图分类号:Q591.1 文献标志码:A
文章编号:1008-1542(2019)04-0359-07
近年来全球范围内食品安全事件层出不穷,对人类的身体健康以及食品产业发展产生了严重的不良影响,如新西兰恒天然肉毒杆菌、巴西的“黑心肉”以及中国的瘦肉精、三聚氰胺事件等。在常规食品分析检测中, 质谱、光谱、色谱以及其他一些仪器分析方法对已知目标物质的检测结果是较准确的[1],但在某些特殊情况下,这些有针对性的方法不能检测到该类物质或新代谢产生的化合物[2-3],且动物源性食品的兽药残留检测常存在兽药残留浓度较低,同时测定抗生素[4-5]、受体激动剂[6]、类固醇[7]等不同性质的兽药会较困难等,因此亟需开发新型的检测方法和策略来解决这一技术难题。
代谢组学(metabonomics)是研究受刺激或扰动后的生物体系(细胞、组织或生物体)代谢产物的变化或其随时间变化的一门科学,目的是分析生物系统内所有代谢物的含量[8]。1999年英国伦敦大学帝国学院的 NICHOLSON 教授首次定义了代谢组学[9], 它与基因组学、蛋白质组学、转录组学共同构成了“系统生物学”[10]。代谢组学技术能从小分子的角度来分析生物体系,在目标物质的分析方面具有独特的优势,近年来迅速发展并渗透到食品、中医药、农业、林业、畜牧业等多种领域,并发挥了不可替代的作用[11-12]。
代谢组学可以对已知的化学物质进行分析, 又能对未知化学物质进行分析,根据研究的目的和对象的不同,可分为靶向代谢组学和非靶向代谢组学;靶向代谢组学和非靶向代谢组学皆可用于研究兽药的代谢机制,靶向代谢组学针对的是特定的某一类代谢物,用于少量目标代谢物检测,关注目标通路代谢物,是绝对定性定量的,而非靶向代谢组学面对的是生物体内源性的整体代谢物全面检测,寻找潜在生物标志物,其操作简单,且非靶向检测代谢物通量高,发现新标志物的几率大。因此近些年来, 国内外一些学者陆续将代谢组学技术应用于食品安全领域,例如检测兽药残留,对掺假食品进行分析鉴别[13-14],检测食品或食品包装材料中的有害物质[15]等,靶向和非靶向代谢组学技术可表达出生物标志物与违禁添加的兽药之间的关系, 从而可作为指示物为相关预警监督提供一个平台[2,16]。
代谢组学作为一种新型的药物监控检测技术,可用来解决食品安全问题,为人类健康生活提供更好的保障。
通过总结、分析和讨论代射组学在兽药违规检测中的应用现状,为进一步应用代谢组学技术、开展食品安全风险监测与评估提供一定的参考[17]。
1 瘦肉精及其代谢产物的代谢组学分析
瘦肉精,即克倫特罗(clenbuterol,CLE),属于β-受体激动剂,临床上最初用来治疗哮喘、阻塞性肺炎等疾病;与之作用机理相似的还有莱克多巴胺(ractopamine,RAC)、沙丁胺醇(salbuterol,SAL)、硫酸沙丁胺醇、硫酸特布他林、西巴特罗、盐酸多巴胺等多种β-受体激动剂类药物,均可显著提高胴体瘦肉率和饲料转化率[6],近年来,包括中国在内的许多国家都出现食用β-受体激动剂残留产品而发生食物中毒的事件。中国针对瘦肉精的检测设置了一些标准,常用液相色谱串联质谱法(liquid chromatography-tandem mass spectrometry,LC-MS)进行动物组织中沙丁胺醇、莱克多巴胺、克伦特罗等残留量的检验[18-21],但是常规检测技术对某些禁用药物的新化合物或者低剂量联合使用往往无法检测出来[22],需进行更严格的监督检测来保障动物源食品安全,代谢组学技术可用来检测这一类药物的生物标志物,进而可有效帮助监测该药物的非法使用情况[22-31]。
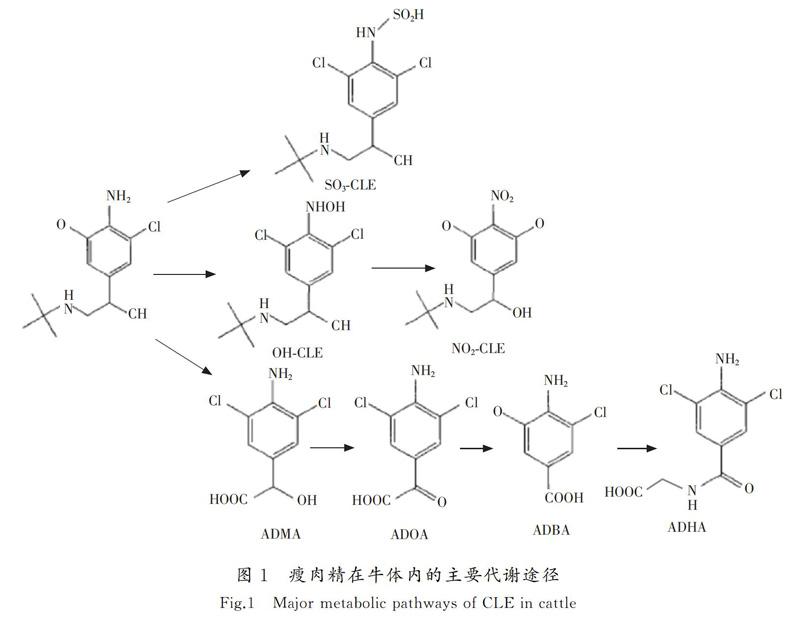
近年来研究人员陆续将代谢组学技术应用于违规使用瘦肉精而残留于动物体内的检测,虽检测过程有些不同,但皆证明了代谢组学技术在兽药残留检测方面的可行性以及可靠性,例如以2-吲哚甲酸作为生物标志物有助于对瘦肉精的滥用情况进行监测。因为服用瘦肉精后动物体内代谢水平会发生变化,通过识别异常代谢物水平,可找出潜在的生物标志物,对其进一步鉴定分析后可帮助了解瘦肉精在动物体内详细的代谢机制,进而对瘦肉精的滥用情况进行监测[28,30],瘦肉精在牛体内已知的主要代谢途径如图1所示[25]。
DERVILLY-PINEL等[23]研究β-受体激动剂(β-agonists)对牛尿液代谢的影响,发现代谢组学技术可通过生物标志物和统计模型来监测动物体内是否使用β-受体激动剂,并利用生物矩阵分析揭示药物的生物效应;DOMNGUEZ-ROMERO等[24]利用液相色谱-电喷雾飞行质谱法(liquid chromatography electrospray time-of-flight mass spectrometry,LC-TOF MS)检测大鼠单次给药后,克伦特罗、特布他林和沙丁胺醇的尿代谢产物情况,经鉴定共发现11种代谢产物,其中有4种未出现在以前尿液报告中。
毕言锋[25]应用超高效液相色谱-四级杆飞行时间质谱法(ultra high performance liquid chromatography quadrupole time-of-flight mass spectrometry,UPLC-Q-TOF MS)研究β-受体激动剂在猪体内的代谢规律, 在监控苯乙醇胺A(phenyletiianolamine A,PEAA)非法使用时, 发现脱甲基代谢产物(demethylation-phenyletiianolamine A,DM-PEAA)更适合作为尿液和组织中的残留检测的目标物,为选择残留检测标志物和建立残留分析方法提供了一定参考;吴玉苹[28]对使用β2-受体激动剂的猪尿进行分析,证实筛选出的共同差异代谢物2-吲哚甲酸和氟米龙醋酸酯在β2-受体激动剂监测的时效上是可行的;谷旭等[29]在猪尿液和血浆中检测出5种沙丁胺醇的代谢产物,其中2种尚未见文献报道,血浆中仅检测到原型药物和2种代谢物;WU等[31]分析了服用由3种低剂量β2-激动剂混合物组成的“鸡尾酒”后猪尿液的特征,结果检测到的2-吲哚甲酸和氟甲氧基乙酸生物标志物无论是单次还是混合物都可作为检测β2-激动剂非法使用的诊断标志物,证明了利用标记物监测β2-激动剂是可行的。
2 类固醇及其代谢产物的代谢组学分析
类固醇激素,又称甾体激素,蛋白质同化作用强烈持久,能促进动物超常态生长,可为养殖户带来巨大的经济效益,因而在养殖业中被大量使用[9]。但是,滥用该类激素会导致在动物组织中产生不同程度的残留,会导致机体代谢紊乱、发育異常甚至存在潜在的致癌、致畸风险。外源性类固醇是已知的类固醇,如替尼博龙,包含合成化学结构,被认为是非自然的,对其的检测只需进行定性的证明;内源性类固醇,如睾酮,黄体酮,含有已知的自然存在的结构,对其的检测更为复杂。
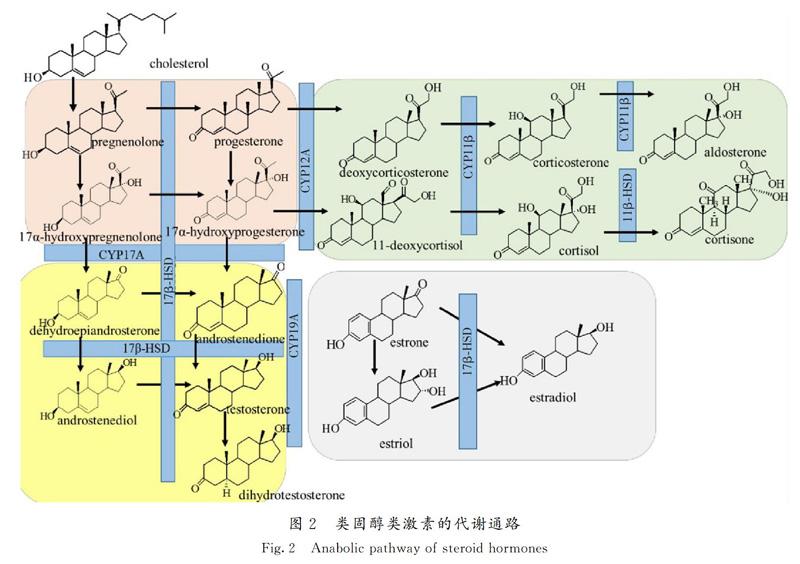
中国设立的国家标准中常采用液相色谱串联质谱法(LC-MS)检测动物源食品中激素的残留量[32-34],虽然在过去十年中,从气相色谱串联质谱法(gas chromatography-tandem mass spectrometry,GC-MS)到液相色谱串联质谱法(LC-MS),药物残留分析技术领域已经有了许多转变,但GC-MS仍是分析饱和甾体代谢物的重要工具[35],因为在LC-MS的电离条件下,饱和甾体化合物通常会受到电离性差的影响。高分辨率、高精度液相色谱质谱(liquid chromatography coupled to high resolution mass spectrometry,LC-HRMS)可显示出卓越的质量稳定性,可同时监测大量分析物,实现实时或回溯性的监测[36]。虽然没有一种方法能够检测到所有物种中所有内源性类固醇的滥用情况,但代谢组学技术在类固醇监测领域内已取得了重大进展[37-46],类固醇类激素的代谢通路如图2所示[47]。
DERVILLY-PINEL等[37]研究发现了类固醇给药后动物尿液中代谢组的改变状况,此研究突出了对生物标志物的针对性监测,可为合成代谢类固醇药物的筛选开辟新的研究思路;NZOUGHET等[38]利用LC-HRMS方法,首次以血清为样本类型,研究服用雌二醇后牛血清中的代谢水平变化,产生了结合一组选定标记强度的筛选模型,此研究首次表明血清代谢组学在检测牛的合成代谢滥用方面具有重要作用;REGAL等[39]利用LC-HRMS为基础的代谢组学方法研究了使用雌二醇/孕酮后的奶牛血清中代谢组的变化,其建立预测模型后可用来帮助检测牛体内是否非法使用这些激素,还找到了雌二醇/孕酮的潜在生物标志物,但其具体结构有待阐明。
ANIZAN等[40]研究类固醇类激素在牛体内的代谢情况,用全扫描模式研究尿代谢物的尿液曲线,筛选出了2种生物标志物5α-雄甾烷-3β,17α-二醇和5α-雄甾烷-2-烯-17-酮,可用于筛查牛体内类固醇的滥用情况;REGAL等[44]利用LC-HRMS系统对用雌二醇-17β处理的奶牛和对照动物的血清样本进行了代谢组学研究,发现有一个潜在的生物标志物在结构上被解释为二肽,并通过检测来测试其有效性,它已经被证实也在雌二醇处理动物的其他样品中;ANIZAN等[45]研究了雄烯二酮对牛尿液中二期甾体结合物代谢产物的影响,发现在被处理的动物样品中3-硫酸表柔酮浓度的变化有异常。
3 存在问题及局限性
代谢组学方法针对的是药理活性而不是单个的药物结构,应用组学方法的原理不是直接检测药物的存在,而是通过靶向或非靶向方法来检测其在动物体内的累积生物效应,它们产生并筛选数据,可用来表明是否可能发生了药物滥用情况。从生物学角度理解,代谢组学针对的是一个完整的生物体系,而不是针对单独一个细胞,对整体随时间改变而发生的代谢全过程进行检测、鉴别和分类[46]。
但是代谢组学研究本身是存在缺点的,要求非靶向代谢组学准确鉴定代谢物是很难的,且其灵敏度不够精确,对低丰度代谢物检测率低,其数据分析需要依赖公共数据库;同样,靶向代谢组学的研究也存在很多局限,其研究需要标准品,需要提前构建标准曲线,且通量低,所以对于一些未知物的检测是有一定限制的。
代谢组学技术分析手段有限,没有一种分析技术能够同时分析所有的代谢组,只能选择性的选取多种技术来进行并行分析;代谢组学所用的仪器设备价格昂贵,需要专业性很强的技术人员来操作;代谢组学研究会得到海量数据,处理复杂且耗时较长。在兽药检测的应用方面,同样存在缺陷与不足,代谢组学对于兽药检测的数据库到目前为止还不够完整;另外,生物体本身的代谢受体内外各种因素条件的干扰,会导致样本的较大差异性,有些条件难以控制会导致结果的低可信度[27,46];而且目前代谢组学应用于兽药研究的数据量还较少,导致研究结果可能会存在较大的偏倚。
4 展 望
代谢组学技术作为组学领域内的新兴学科,在食品安全领域,尤其是在动物源性食品的兽药检测中具有很好的应用前景,为食品质量与安全研究提供了新的方法、思路和依据。
系统代谢产物在各个生物体系中相类似,因此代谢组学技术的应用研究更具有普遍意义。相对于其他组学来说,基因和蛋白质表达微小有限的变化可通过相应代谢产物表达而放大,令分析检测更为容易。代谢产物分布广,性质差异较大,单靠一种分析手段难以进行无偏向性的全面分析。LC-MS技术、GC-MS技术以及以它们为基础的各种更高水平的技术平台,主成分分析(principal component analysis,PCA)、偏最小二乘判别分析(partial least squares discrimination analysis,PLSDA)等各种统计学分析平台,皆可为代谢组学技术提供不同角度的支持。因此,要根据所研究样品的特性及研究目的来选择方法,并综合利用技术平台和分析平台,以求得到更详尽的分析结果。
凭借代谢组学独特的视角研究兽药的代谢机制,利于寻找有价值的特异性标志物,可为兽药监测评估提供依据,在未来的应用研究中,可利用各种现代分析检测技术手段以及数据统计分析技术的互补联用作用,建立大规模的标准化的代谢组学数据库;随着高新技术的不断涌现,基因组学、转录组学、蛋白组学及代谢组学的多层组学整合分析是未来精准检测分析的发展趋势。通过对多组学的联合分析,可对生物体进行系统性研究,能够快速简便地获得更全面、准确的代谢信息。对代谢组学的研究方法进行不断的完善和更新,建立更加精确的系统分析方法,可为确保食品质量与安全、预防和减少食源性疾病发生概率提供重要技术支持,特别是对中国食品安全风险监测与评估等工作具有非常重要的现实意义。
参考文献/References:
[1] TENGSTRAND E, ROSN J, HELLEfNS K E, et al. A concept study on non-targeted screening for chemical contaminants in food using liquid chromatography-mass spectrometry in combination with a metabolomics approach[J]. Analytical and Bioanalytical Chemistry, 2013, 405(4): 1237-1243.
[2] 刘思洁,吴永宁,方赤光.代謝组学技术在食品安全中的应用[J].食品安全质量检测学报,2014,5(4):1081-1086.
LIU Sijie, WU Yongning, FANG Chiguang. Review on the application of metabonomics approach in food safety[J]. Journal of Food Safety and Quality,2014,5(4):1081-1086.
[3] GALLART-AYALA H, CHREAU S, DERVILLY-PINEL G, et al. Potential of mass spectrometry metabolomics for chemical food safety[J].Bioanalysis, 2015,7(1):133-146.
[4] 张亚莉,哈婧,赵静,等.动物组织中抗生素残留研究进展[J].河北科技大学学报,2013,34(6):517-525.
ZHANG Yali, HA Jing, ZHAO Jing, et al. Research development of antibiotics residue in animal tissues[J].Journal of Hebei University of Science and Technology,2013,34(6):517-525.
[5] 王玉春,赵星洁,刘英华,等.高效液相色谱法测定淡水鱼中抗生素残留量[J].河北科技大学学报,2007,28(3):215-217.
WANG Yuchun, ZHAO Xingjie, LIU Yinghua, et al. HPLC determination of antibiotics in freshwater fish[J]. Journal of Hebei University of Science and Technology,2007,28(3):215-217.
[6] 梁晓维. 莱克多巴胺在肉牛体内残留消除规律研究[D].兰州:甘肃农业大学,2015.
LIANG Xiaowei. Accumulation and Depletion of Ractopamine in Chinese Simmental Beef Cattle[D]. Lanzhou: Gansu Agricultural University,2015.
[7] 康占省. 动物源性食品中类固醇激素残留的检测方法研究[D].保定:河北大学,2011.
KANG Zhansheng. Studies on Analytical Methods of Steroid Hormones Residues in Animal-Derived Food[D]. Baoding: Hebei University,2011.
[8] 黎进. 基于超高效液相色谱-四级杆飞行时间质谱联用的胃癌患者血浆代谢组学分析[D].杭州:浙江中医药大学,2016.
LI Jin. Plasma Metabolomic Analysis of Human Gastric Cancer Based on Ultra-High Performance Liquid Chromatography-Quadrupole-Time-of-Flight/Mass Spectrometry[D]. Hangzhou: Zhejiang Chinese Medical University,2016.
[9] NICHOLSON J K, WILSON I D. Opinion: Understanding ′global′ systems biology: Metabonomics and the continuum of metabolism[J]. Nature Reviews Drug Discovery, 2003, 2(8): 668-676.
[10]俞邱豪,张九凯,叶兴乾,等.基于代谢组学的食品真实属性鉴别研究进展[J].色谱,2016,34(7):657-664.
YU Qiuhao, ZHANG Jiukai, YE Xingqian, et al. Progress on metabolomics for authenticity identification of food[J]. Chinese Journal of Chromatography,2016,34(7):657-664.
[11]ROBERTSON D G, FREVERT U. Metabolimics in drug discovery and development[J].Clinical Pharmacology Therapeutics,2013,94(5):559-561.
[12]ZHAO Yingyong, CHENG Xianlong, VAZIRI N D , et al. UPLC-based metabonomic applications for discovering biomarkers of diseases in clinical chemistry[J].Clinical Biochemistry, 2014,47(15):16-26.
[13]CALVANO C D, de CEGLIE C, MONOPOLI A, et al. Detection of sheep and goat milk adulterations by direct MALDI-TOF MS analysis of milk tryptic digests[J]. Journal of Mass Spectrometry, 2012, 47(9): 1141-1149.
[14]COZZOLINO R, PASSALACQUA S, SALEMI S, et al. Identification of adulteration in milk by matrix-assisted laser desorption/ionization time-of-flight mass spectrometry[J]. Journal of Mass Spectrometry, 2001, 36(9): 1031-1037.
[15]HERRERA A V, HERNNDEZ-BORGES J, RODRGUEZ-DELGADO M A, et al. Determination of quinolone residues in infant and young children powdered milk combining solid-phase extraction and ultra-performance liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography A, 2011, 1218(42): 7608-7614.
[16]孫玲伟,包凯,张洪友,等.代谢组学平台在兽药检测中的研究应用评价[J].黑龙江畜牧兽医,2014(1):27-30.
SUN Lingwei, BAO Kai, ZHANG Hongyou, et al. Research, application and evaluation of metabonomics platform for the determination of veterinary drugs[J]. Heilongjiang Animal Science and Veterinary Medicine,2014(1):27-30.
[17]胡传芹,曹学丽.代谢组学在食品安全风险监测与评估中的应用[J].食品安全质量检测学报,2015,6(10):4070-4074.
HU Chuanqin, CAO Xueli. Application of metabolomics method in food safety risk monitoring and assessment[J]. Journal of Food Safety and Quality,2015,6(10):4070-4074.
[18]GB/T 22286—2008, 动物源性食品中多种β-受体激动剂残留量的测定 液相色谱串联质谱法[S].
[19]SN/T 4817—2017,进出口食用动物中克伦特罗、莱克多巴胺、沙丁胺醇残留量的测定 液相色谱-质谱/质谱法[S].
[20]SB/T 10773—2012,动物肌肉中沙丁胺醇的快速筛查 胶体金免疫层析法[S].
[21]GB/T 5009.192—2003,动物性食品中克伦特罗残留量的测定[S].
[22]毕言锋,汪霞,徐士新,等.代谢组学及其在药物安全评价中的应用进展[J].中国兽药杂志,2011,45(6):34-37.
BI Yanfeng, WANG Xia, XU Shixin, et al. Development metabonomics and its application in drug safety evaluation[J].Chinese Journal of Veterinary Drug,2011,45(6):34-37.
[23]DERVILLY-PINEL G, CHEREAU S, CESBRON N, et al. LC-HRMS based metabolomics screening model to detect various β-agonists treatments in bovines[J]. Metabolomics,2015,11(2):403-411.
[24]DOMNGUEZ-ROMERO J C, GARCA-REYES J F, MARTNEZ-ROMERO R, et al. Detection of main urinary metabolites of β2-agonists clenbuterol, salbutamol and terbutaline by liquid chromatography high resolution mass spectrometry[J]. Journal of Chromatography B, 2013,923/924:128-135.
[25]畢言锋. 基于高分辨质谱技术的β-受体激动剂在猪体内的代谢研究[D].北京:中国农业大学,2014.
BI Yanfeng. Study on the Metabolism of β-Agonists in Swine Using High Resolution Mass Spectrometry[D]. Beijing: China Agricultural University,2014.
[26]刘佳. β-受体激动剂在肉牛体内代谢及残留规律研究[D].兰州:兰州大学,2017.
LIU Jia. The Accumulation and Depletion of β-Agonists in Beef Cattle[D]. Lanzhou: Lanzhou University,2017.
[27]COURANT F, PINEL G, BICHON E, et al. Development of a metabolomic approach based on liquid chromatography-high resolution mass spectrometry to screen for clenbuterol abuse in calves[J]. Analyst, 2009, 134(8): 1637-1646.
[28]吴玉苹. 基于UHPLC-QTOF/MS代谢组学技术对猪尿中β2-受体激动剂残留的研究[D].北京:中国农业大学,2015.
WU Yuping. Metabonomic Approach Based on Ultra-High Performance Liquid Chromatography-Quadrupole Time-of-Flight Mass Spectrometry for Urine Profiling of Swine Treated with β2-agonists[D].Beijing: China Agricultural University,2015.
[29]谷旭,刘义明,姚婷,等.超高压液相色谱-飞行时间质谱法对比分析沙丁胺醇在猪尿液和血浆中的代谢产物[J].分析化学,2014,42(11):1692-1696.
GU Xu, LIU Yiming, YAO Ting, et al. Identification of major metabolites of salbutamol in swine urine and plasma using ultra-high performance liquid chromatography-electrospray-time of flight-mass spectrometry[J].Chinese Journal of Analytical Chemistry,2014,42(11):1692-1696.
[30]LU Haiyan, ZHANG Hua, ZHU Tenggao, et al. Metabolic effects of clenbuterol and salbutamol on pork meat studied using internal extractive electrospray ionization mass spectrometry[J]. Scientific Reports,2017,7(1):5136.
[31]WU Yuping, BI Yanfeng, GALI B, et al. Metabolomic analysis of swine urine treated with β2-agonists by ultra-high performance liquid chromatography-quadrupole time-of-flight mass spectrometry[J]. Journal of Chromatography A, 2015,1400: 74-81.
[32]卢剑,车文军,张岩,等.凝胶净化色谱-固相萃取-超快速液相色谱-串联质谱法检测猪肉中9种β2-受体激动剂激素残留[J].食品科学,2012,33(24):311-314.
LU Jian, CHE Wenjun, ZHANG Yan, et al. Determination of nine β2-agonist hormones residues in pork by GPC-SPE-RRLC-MS/MS[J]. Food Science, 2012,33(24):311-314.
[33]GB/T 21981—2008,动物源食品中激素多殘留检测方法 液相色谱-质谱/质谱法[S].
[34]SN/T 4744—2017,进出口食用动物性激素残留量的测定 液相色谱-质谱/质谱法[S].
[35]BIZEC B L, PINEL G, ANTIGNAC J P. Options for veterinary drug analysis using mass spectrometry[J].Journal of Chromatography A, 2009, 1216(46):8016-8034.
[36]SCARTH J P, TEALE P, KUURANNE T. Drug metabolism in the horse: A review[J].Drug Testing and Analysis, 2011,3(1):19-53.
[37]DERVILLY-PINEL G, WEIGEL S, LOMMEN A, et al. Assessment of two complementary liquid chromatography coupled to high resolution mass spectrometry metabolomics strategies for the screening of anabolic steroid treatment in calves[J]. Analytica Chimica Acta, 2011,700(1/2): 144-154.
[38]NZOUGHET J J K, DERVILLY-PINEL G, CHREAU S, et al. First insights into serum metabolomics of trenbolone/estradiol implanted bovines; screening model to predict hormone-treated and control animals′ status[J]. Metabolomics,2015, 11(5): 1184-1196.
[39]REGAL P, ANIZAN S, ANTIGNAC J P, et al. Metabolomic approach based on liquid chromatography coupled to high resolution mass spectrometry to screen for the illegal use of estradiol and progesterone in cattle[J]. Analytica Chimica Acta, 2011,700(1/2):16-25.
[40]ANIZAN S, BICHON E, DUVAL T, et al. Gas chromatography coupled to mass spectrometry-based metabolomic to screen for anabolic practices in cattle: Identification of 5α-androst-2-en-17-one as new biomarker of 4-androstenedione misuse[J]. Journal of Mass Spectrometry, 2012,47(1):131-140.
[41]STELLA R, DERVILLY-PINEL G, BOVO D, et al. Metabolomics analysis of liver reveals profile disruption in bovines upon steroid treatment[J]. Metabolomics,2017,13(7): 10.1007/s11306-017-1220-0.
[42]JACOB C C, DERVILLY-PINEL G, BIANCOTTO G, et al. Global urine fingerprinting by LC-ESI(+)-HRMS for better characterization of metabolic pathway disruption upon anabolic practices in bovine[J]. Metabolomics, 2015,11(1):184-197.
[43]ANIZAN S, BICHON E, NARDO D D, et al. Screening of 4-androstenedione misuse in cattle by LC-MS/MS profiling of glucuronide and sulfate steroids in urine[J]. Talanta,2011,86:186-194.
[44]REGAL P, SEIJAS J A, CEPEDA A, et al. Structure elucidation and HPLC-MS/MS determination of a potential biomarker for estradiol administration in cattle[J]. Analytical and Bioanalytical Chemistry,2013,405(29): 9537-9546.
[45]ANIZAN S, NARDO D D,BICHON E, et al. Targeted phaseⅡmetabolites profiling as new screening strategy to investigate natural steroid abuse in animal breeding[J].Analytical Chimica Acta,2011,700(1/2):105-113.
[46]李勇. 鸡体内兽药喹烯酮代谢组学方法建立及应用[D].北京:中国人民解放军军事医学科学院,2008.
LI Yong. Development and Application of Veterinary Drug Quinocetone Metabonomics Technology in Chicken[D].Beijing: Chinese People′s Liberation Army Academy of Military Medical Sciences,2008.
[47]鹿倩,杨莉,王峥涛.血液中类固醇激素分析方法的研究进展[J].中草药,2018,49(15):3710-3720.
LU Qian, YANG Li, WANG Zhengtao. Research progress on analytical methods for blood steroid hormones[J]. Chinese Traditional and Herbal Drugs ,2018,49(15):3710-3720.
